一种改良的快速提取小型昆虫总RNA的方法
2013-09-11朱春晖谭新球张德咏
高 阳, 朱春晖, 谭新球,刘 勇, 彭 静, 张德咏*
(
1.湖南省植物保护研究所,长沙 410125;2.园艺作物病虫害治理湖南省重点实验室,长沙 410125;3.中南大学研究生院隆平分院,长沙 410125)
随着许多重要农业昆虫如蚜虫等小型昆虫全基因组的测定,昆虫基因改造和转录组研究的日趋深入,RNA的提取越来越成为昆虫分子生物学操作的关键环节。然而许多重要农业昆虫如烟蚜、烟粉虱和西花蓟马个体较小,蛋白质含量高,RNA含量少,提取困难。目前常用的昆虫RNA提取方法有试剂盒法、CTAB 法、Trizol法、SDS-KAC-热酚法[1]、改进的一步法[2]等,但这些方法都有一定缺陷,如费用高、操作步骤多、提取耗时长等。
对于小型昆虫来说,能否有效地去除蛋白质和几丁质、尽可能减少RNA损失是提取高质量RNA成败的关键。硅粒吸附法是一种有效的RNA提取方法,由于其操作简便、安全性高并且稳定性好等优点,被广泛地应用于植物组织和病毒的总RNA提取[3-4]。本文对该方法进行了适当的改进后,应用于烟蚜、烟粉虱和西花蓟马总RNA的提取。现报道如下。
1 材料和方法
1.1 材料
本试验使用的材料为烟蚜[Myzus persicae(Sulzer)]、烟粉虱 Q 隐种[Bemisia tabaci(Gennadius)Q sibling species]和西花蓟马[Frankliniella occidentalis(Pergande)]的活体成虫,采集于湖南省农科院植物保护研究所温室内。
1.2 试剂
异硫氰酸胍购自BIO BASIV INC,聚乙烯吡咯烷酮P-40(PVP-40)和二氧化硅(SiO2)购自Sigma公司,Trizol试剂购自Invitrogen公司,水饱和酚(pH<5.2)购自BoMei公司,其他均为国产分析纯化学试剂。研磨缓冲液(GB)、洗涤缓冲液(WB)、10%月桂酰肌氨酸钠溶液(NLS)、NaI溶液和硅粒悬浮溶液均按照文献方法[2]制备。
1.3 RNA提取方法
1.3.1 改良的硅粒吸附法
参照张德咏等[3]方法并改进。取烟蚜虫体20头(烟粉虱Q隐种和西花蓟马100头),用ddH2O漂洗,吸水纸吸干后放入1.5mL灭菌离心管中,加入500μL GB和100μL NLS(10%)溶液,用高压灭菌的一次性研磨棒进行研磨。随后70℃温浴10min,不时摇动。冰上放置5min后离心10min(13000r/min)。取500μL上清液,加入等体积水饱和酚∶氯仿∶异戊醇(25∶24∶1),摇动混匀后,室温下离心5min(12000r/min)。取上清液,加入150μL无水乙醇,300μL NaI,25μL硅粒悬浮溶液,室温下不停摇动10min。离心1min(6000r/min),倒掉上清液。加500μL WB洗涤2~3次(充分悬浮至上清液中无漂浮的硅颗粒为止),每次6000r/min离心1min。沉淀加ddH2O 75μL,70℃温浴4min后离心3min(13000r/min),取上清50μL,-20℃保存。
1.3.2 Trizol法
取烟蚜虫体20头(烟粉虱Q隐种和西花蓟马100头)放入1.5mL灭菌离心管中,在液氮保护下用高压灭菌的一次性研磨棒进行研磨。加入1mL Trizol试剂进行裂解,在室温下放置5min后加入0.2mL氯仿,充分混匀,在室温下放置2min,离心15min(4℃,12000g);取上层水相,加0.5mL异丙醇,在室温下放置10min,离心10min(4℃,12000g);弃上清,加1mL 75%乙醇进行洗涤离心5min(4℃,7500g),弃上清;沉淀的RNA在室温下自然干燥;用50μL DEPC水溶解RNA沉淀,-70℃保存。
1.3.3 改进的一步法
取烟蚜虫体20头(烟粉虱Q隐种和西花蓟马100头),参照景天忠等[2]的方法进行,最后用50μL DEPC水溶解RNA沉淀,-70℃保存。
1.4 总RNA琼脂糖凝胶电泳检测
从总RNA提取物中取5μL,与2μL 6×loading buffer和3μL SYBR GreenⅠ荧光染料混合后,在2.0%的琼脂糖凝胶中电泳20min(电压140V)。用FluorChem FC2凝胶成像系统(Alpha Innotech,USA)拍照检测。
1.5 总RNA紫外分光光度计检测
分别取烟蚜RNA提取物10μL,烟粉虱Q隐种和西花蓟马RNA提取物各20μL,加ddH2O稀释到500μL,用TU-1901双光束紫外可见分光光度计(北京普析)测定其在230、260和280nm的吸光度,对RNA的纯度进行评估。
1.6 RT-PCR反应检测RNA的质量
取1μL烟蚜、烟粉虱Q隐种和西花蓟马的RNA,用两步法做 RT-PCR,根据已有文献[5-7]设计3对引物(由华大基因合成),如表1所示。其中烟蚜、烟粉虱Q隐种和西花蓟马扩增目标条带的长度分别为900、230和180bp。

表1 三种小型昆虫RT-PCR引物Table 1 All primers used for RT-PCR
RT-PCR反应条件:
第一链的合成:取昆虫总RNA 9μL,加1μL 3′端引物(20μmol/L);保温5min;取出后迅速放到冰上,加入配好的反转录体系混合液,(2000U反转录酶1μL,2mmol/L dNTPs 2μL,5×反转录酶缓冲液5μL,灭菌ddH2O 17μL);使用 PCR 仪于42℃反应50min。
第二链的合成:以第一链为模板进行PCR反应,反应体系如下:10×反应缓冲液2.0μLdNTP混合物(10mmol/L)0.4μL,5′端 引 物 (10μmol/L)1.0μL,3′端引物(10μmol/L)1.0μL,模板1.0μL,Taq DNA聚合酶,5U/μL 0.4μL,加灭菌ddH2O至终体积为20μL。
PCR反应条件如下:95℃预变性5min;95℃变性45s;55~56℃退火50s;72℃延伸1min;步骤2~4循环30次;72℃延伸10min,4℃保存。
1.0%琼脂糖凝胶电泳鉴定PCR产物,用FluorChem FC2(Alpha Innotech,USA)凝胶成像系统拍照检测扩增结果,烟蚜RPS2扩增产物送华大基因测序。
2 结果与分析
2.1 总RNA的质量比较
用改进的一步法、改良的硅粒吸附法和Trizol法等3种方法提取3种小型昆虫总RNA(图1),结果表明3种方法中改良的硅粒吸附法提取的RNA损失最小,条带最清晰,完整性较好。而且改良硅粒吸附法提取的3种昆虫总RNA电泳条带清晰无弥散,28SrRNA和18SrRNA的亮度接近2∶1,说明改良硅粒吸附法提取的RNA无降解,质量较好,可用于小型昆虫的总RNA提取。
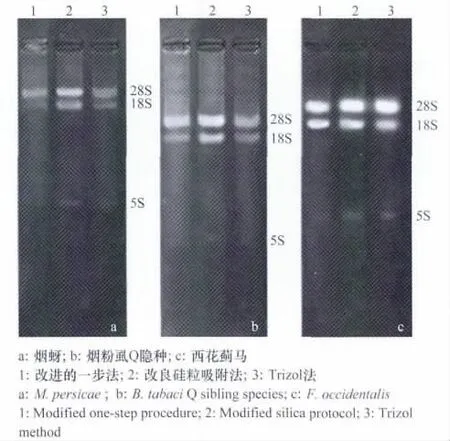
图1 三种方法提取三种昆虫的总RNA(5μL)Fig.1 The RNAs of three insects extracted by three methods
2.2 RNA浓度、纯度及产率检测
通过紫外分光光度计检测3种方法提取的3种昆虫总RNA,结果如表2所示。由表2可见,改良的硅粒吸附法所得的3种昆虫总RNA A260/A280值都在1.8以上,蛋白质污染相对较少。另外A260/A230值都接近2.0,说明其他污染也较少。
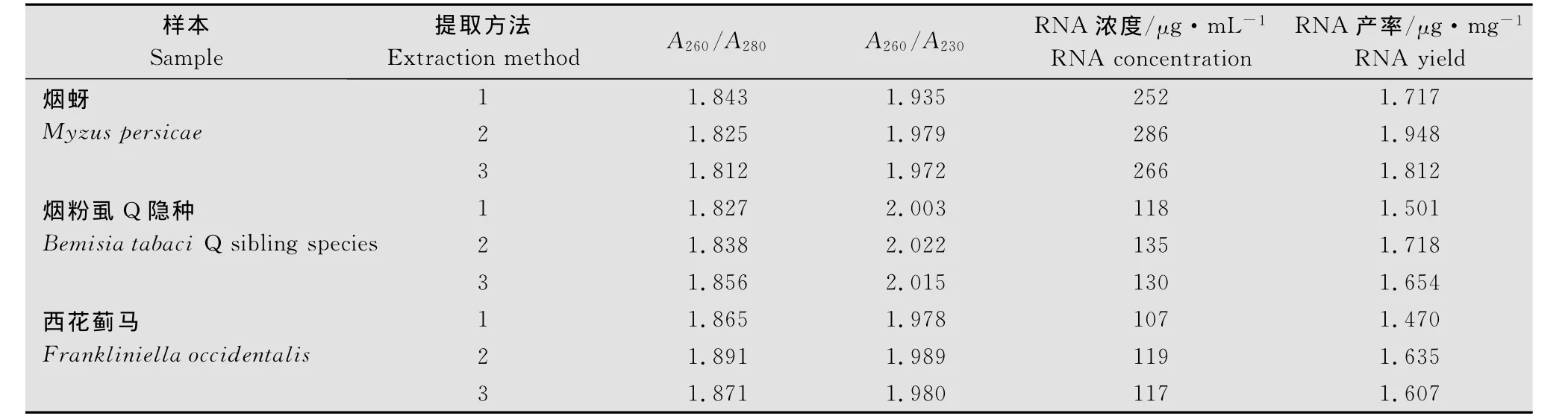
表2 三种昆虫的RNA纯度及浓度Table 1 The purity and concentration of RNA extracted from three insects
与常规的改进的一步法和Trizol法等方法相比,改良的硅粒吸附法提取的3种昆虫总RNA产率略高,说明该方法是一种较好的提取昆虫总RNA的方法。
2.3 PCR检测
用改良的硅粒吸附法提取的3种昆虫总RNA作为模板同时进行两步法RT-PCR反应和普通PCR反应,经2.0%琼脂糖凝胶电泳检测,结果(见图2)表明:3种昆虫的RT-PCR产物条带单一,且与预期的大小一致。试验中以RNA为模板进行PCR以及CK对照均无目标条带。其中烟蚜RT-PCR产物测序后进行同源性分析,结果表明,本研究扩增得到的片段与文献中烟蚜RPS2基因序列(登录号:XM_001945112)同源性为96.46%。该结果说明:此方法提取的总RNA可以用于RT-PCR。
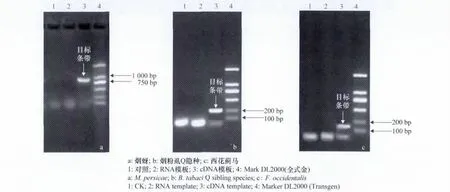
图2 电泳检测结果
3 讨论
硅粒吸附法是一种快速、高效和经济的植物总RNA提取方法[4],本文对其进行改良后应用于小型昆虫总RNA提取。由于烟粉虱等小型昆虫个体小,RNA含量少,蛋白质含量高,本试验对材料的研磨破碎过程进行了简化,同时增加了水饱和酚∶氯仿∶异戊醇(25∶24∶1)对蛋白质的抽提。试验结果显示,不使用水饱和酚∶氯仿∶异戊醇(25∶24∶1)对蛋白质进行抽提,基本得不到RNA产物,原因是昆虫蛋白质的存在会黏附硅颗粒,使其失去作用而导致试验失败。
试验发现,使用改良的硅粒吸附法提取的小型昆虫RNA稳定性好,试验所用到的试剂用灭菌ddH2O配制即可。采用本方法提取的RNA稳定的原因可能是硅粒对RNA的特定吸附作用,同时配合RNA酶的强抑制剂,使提取的RNA中的RNA酶去除得非常干净。此外,试剂中的聚乙烯吡咯烷酮P-40(PVP-40)最好不要用PVP系列的其他产品代替,否则提取的RNA纯度会受到影响(结果未显示)。
与传统的Trizol法和改进的一步法相比,改良的硅粒吸附法是一种经济高效的小型昆虫总RNA提取方法,RNA产率高,纯度佳。同时由于减少了挥发性有毒试剂DEPC的使用,本方法对实验人员的毒害性大大降低。
综上所述,改良的硅粒吸附法提取的小型昆虫总RNA质量好,完整性高,能够满足RT-PCR试验的要求。另外,整个试验操作简单、省时,所用试剂普遍、廉价,是提取小型昆虫总RNA的理想方法。
[1] 邓顺,张友军,褚栋.一种提取小型昆虫总RNA的有效方法[J].昆虫知识,2007,44(4):593-596.
[2] Jing T Z,Wang Z Y,Liu K Y,et al.A modified one-step procedure for rapid RNA isolation from insect[J].Journal of Forestry Research,2006,17(2):129-131.
[3] 张德咏,谭新球,罗源华,等.用单管逆转录-聚合酶链式反应检测辣椒黄瓜花叶病毒[C]∥成卓敏.农业生物灾害预防与控制研究.北京:中国农业出版社,2005:282-287.
[4] Rott M E,Jelkmann W.Characterization and detection of several filamentous viruses of cherry:Adaptation of an alternative cloning method(DOP-PCR),and modification of an RNA extraction protocol[J].European Journal of Plant Pathology,2001,107:411-420.
[5] Lourdes F C,Elisa G,Dionisio L A,et al.The helper-component protease transmission factor of tobacco etch potyvirus binds specifically to an aphid ribosomal protein homologous to the laminin receptor precursor[J].Journal of General Virology,2010,91:2862-2873.
[6] 白润娥,李静静,唐雅菲,等.Q型烟粉虱化学感受蛋白基因BtabCSP1的克隆与分析[J].中国农业科学,2011,45(18):3892-3898.
[7] 丁艳红.西花蓟马对寄主气味的行为反应及其触角气味结合蛋白基因的克隆[D].武汉:华中农业大学,2011.
