牛巴贝斯虫实时荧光PCR检测方法的建立
2013-09-11刘启生王振宝张玉婷巴音查汗
刘启生,王振宝,王 真,哈 森,张玉婷,巴音查汗*
(1.新疆农业大学动物医学学院,新疆乌鲁木齐830052;2.伊犁出入境检验检疫局,新疆伊犁835000)
牛巴贝斯虫(Babesia bovis)是一种蜱媒血液原虫,牛属动物感染后,出现发热、贫血、血红蛋白尿、共济失调等症状,严重时引起死亡,给畜牧业造成严重经济损失[1]。B.bovis与双芽巴贝斯虫(B.bigem ina)、牛环形泰勒虫(Theileria annulata)等梨形虫(牛焦虫)常常混合感染牛只,严重危害养牛业的健康发展[2-3],梨形虫的混合感染和隐性感染对牛血液原虫病的防治带来了一定困难。
目前,国外学者对B.bovis进行分子生物学检测的报道较多,常规PCR、套式PCR和基于SYBR Green染料的实时荧光PCR在B.bovis的检测方面均有应用[4-6]。常规PCR存在灵敏度低,检测周期较长等缺点;套式PCR灵敏度高,但两步的PCR反应繁琐、易污染,不适用于大规模的流行病学调查;实时荧光PCR技术敏感性高、特异性强、检测速度快,与常规PCR相比不存在交叉污染和核酸染料对人体的危害等缺点,近年来逐渐应用于各种病原体的定性检测[7-10]。本研究建立检测B.bovis的实时荧光PCR方法,为B.bovis的早期、快速检测,梨形虫病的防控及分子流行病学研究提供了一种新的检测手段。
1 材料和方法
1.1 标准虫株 B.bovis、B.bigemina虫株由中国农业科学院兰州兽医研究所提供;T.annulata虫株由本实验室分离保存。
1.2 主要试剂 全血DNA提取试剂盒购自QIAGEN公司;Taq DNA聚合酶、MgCl2、dNTPs、DL2000Marker、胶回收试剂盒、pMD19-T载体、质粒提取试剂盒等均购自宝生物工程(大连)有限公司。
1.3 引物与探针 通过比对GenBank中B.bovis 18S rRNA基因的保守序列,使用PrimerPrim ier5和Primer Express 3.0软件设计一对引物和一条探针:BboF:5'-GTGTTTCAAGCAGGTTTCGC-3'; BboR: 5'-CGT GCGTCATCGACAAATCT-3'; BboP: 5'-FAM-TGAG CATGGAATAACCTTGTATGACCCT-TAMRA-3',目的片段大小为160bp。引物和探针均由北京鼎国生物技术有限公司合成。
1.4 虫体DNA提取及标准品制备 采用全血DNA提取试剂盒提取B.bovis DNA,应用特异性引物进行常规PCR扩增,产物经琼脂糖凝胶电泳检测,回收目的片段连接至pMD19-T载体,构建重组质粒并由北京鼎国生物技术有限公司测序,将鉴定正确的重组质粒作为标准阳性模板并测定浓度。
1.5 荧光定量PCR反应体系和反应条件的优化以标准品为模板,对Mg2+、dNTPs、引物、探针退火延伸温度和时间进行优化。
1.6 标准曲线的建立和敏感性试验 将标准阳性重组质粒经微量核酸蛋白分析仪测定浓度,用TE缓冲液稀释成10倍系列梯度浓度(1.31×108copies/μL~1.31×100copies/μL)作为模板,于-20℃保存。按优化好的体系条件进行实时荧光PCR,绘制标准曲线。同时以上述梯度浓度模板进行常规PCR试验,比较两者的灵敏度。
1.7 特异性试验 提取B.bovis、B.bigem ina、T.annulata和健康牛血的DNA作为模板,用双蒸水做为空白对照,进行实时荧光PCR扩增,评价试验的特异性。
1.8 稳定性试验 取4个不同浓度的样品作为模板进行重复性试验,每个浓度做4个平行,重复3次。收集数据,计算组内、组间变异系数,评价试验的稳定性。
1.9 临床样品的检测 从分别采自吐鲁番、伊犁的23份疑似病例血液样品提取DNA,进行实时荧光PCR检测,同时对样品进行常规PCR检测,评价实时荧光PCR的临床应用性。
2 结 果
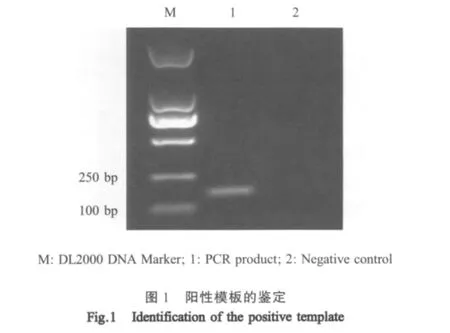
2.1 阳性模板的鉴定 以B.bovis DNA为模板经常规PCR反应,扩增的目的片段与预期(160bp)一致(图1),阳性重组质粒经测序比对,与GenBank中登录的B.bovis18S rRNA基因序列的同源性达到98%~100%。
2.2 荧光定量PCR反应体系和条件的确定 经优化建立如下反应体系:10×PCR buffer(Mg2+free)2.5μL,MgCl2(25mmol)3.5μL,dNTPs(10mmol)0.5μL,BboF/BboR(10μmol)各 1μL,Taq Man探针(10μmol)0.5μL,Taq DNA聚合酶(5u/μL)0.5μL,模板DNA 1μL,加灭菌双蒸水至25μL。反应条件为:95℃ 2m in;95℃ 10s、55℃ 60s,45个循环;每个循环延伸结束时采集荧光信号。
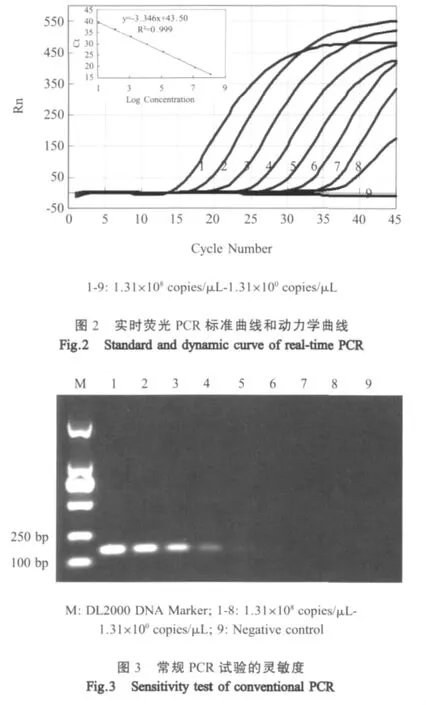
2.3 标准曲线及实时荧光PCR灵敏度 以10倍系列梯度浓度(1.31×108copies/μL~1.31×100copies/μL)的阳性重组质粒作为模板进行实时荧光PCR反应,浓度为1.31×101copies/μL时依然有扩增曲线(图 2)。模板浓度与CT值呈良好的线性关系,相关系数R2=0.999,回归方程为:CT=-3.346lg(X)+43.50。扩增效率为99%,符合实时荧光PCR的试验预期结果。常规PCR的检测浓度下限为1.31×104copies/μL(图3),灵敏度远低于实时荧光PCR。
2.4 特异性试验 应用实时荧光PCR进行特异性试验显示,B.bovis出现特异性的扩增曲线,B.bigemina、T.annulata、健康牛血和空白对照均未产生特异性荧光信号。结果表明建立的实时荧光PCR具有良好的特异性(图4)。
2.5 稳定性试验 选取 1.31×108copies/μL、1.31×106copies/μL、1.31×104copies/μL、1.31×102copies/μL 4个浓度的阳性模板进行组内和组间重复性试验,计算出组内组间CT值的变异系数分别为0.35%~1.70%、0.32%~0.60%(表1),均小于3%,表明该方法具有良好的重复性。


表1 实时荧光PCR的重复性试验Table 1The reproducibility test of real-time PCR
2.6 临床样品的检测 将23份临床全血样品分别应用实时荧光PCR和常规PCR进行检测,结果显示,实时荧光PCR能够检出12份阳性,常规PCR只检出7份阳性,并且常规PCR检出的7份阳性样品荧光PCR均显示为阳性,实时荧光PCR和常规PCR的检出率分别为52.17%和30.43%,表明该实时荧光PCR有良好的临床灵敏性和应用性。
3 讨论
目前,牛巴贝斯虫病的诊断一般为血涂片镜检,该方法虽然方便直观,但敏感性差,检出率低,对低水平感染检测不能适用;间接荧光抗体试验(IFAT)和酶联免疫法(ELISA)等血清学方法应用较为广泛,但存在不能区分耐过动物、不易区分相近虫种的交叉感染的缺点[11];实时荧光PCR方法可以直接检测病原核酸,准确性高,对隐性感染和低水平感染具有良好的检出率。实时荧光PCR主要分为染料法和探针法,探针法的优势在于在上下游引物之间引入一条与目的模板特异性结合的荧光标记探针,增强了实时荧光PCR的特异性和敏感性。本研究针对B.bovis 18S rRNA基因设计引物和Taq Man探针,建立了B.bovis实时荧光PCR检测方法,该方法最低可以检测1.3×101copies靶基因,对低水平感染有更好的检出率,敏感性较常规PCR高1000倍;与其他几种牛属动物易感血液原虫无交叉反应,特异性强,能够准确快速定性检测;组内和组间试验的变异系数分别为0.35%~1.70%、0.32%~0.60%,方法的稳定性好;临床样品检测表明该方法具有良好的应用性。
综上所述,本研究建立的实时荧光PCR检测方法,可以灵敏、特异的快速定性检测B.bovis,该方法的建立将为蜱传原虫病的流行病学调查提供快速有效的检测手段,为蜱媒病的相关研究提供有效的技术支持。
[1]Homer M J,Aguilar-Delfin I,Telford SR,et al.Babesiosis[J].Clin M icrobiol Rev,2000,13(3):451-469.
[2]吴永红,刘玲,王真,等.南疆部分散养户牛场梨形虫及其媒介蜱感染情况的调查[J].新疆农业科学,2011,48(10):1918-1922.
[3]臧鹏伟,王伟东,徐魁梧,等.南京地区新生奶牛犊的巴贝斯虫病病例分析[J].畜牧兽医,2007,39:41-42.
[4]Fahrimal Y,Goff W L,Jasmer,D P.Detection of Babesia bovis carrier cattle by using polymerase chain reaction amplification of parasite DNA[J].JClin M icrobiol,1992,30(6):1374-1379.
[5]AbouLaila M,Yokoyama N,Igarashi I.Development and evaluation of two nested PCR assays for the detection of Babesia bovis from cattle blood[J].Vet Parasitol,2010,172:65-70.
[6]Buling A,Criado-Fornelio A,Asenzo G,et al.A quantitative PCR assay for the detection and quantification of Babesia bovis and B.bigem ina[J].Vet Parasitol,2007,147:16-25.
[7]周霞,剡根强.荧光定量PCR技术及其在预防兽医学研究中的应用[J].石河子大学学报(自然科学版),2005,23(5):623-627.
[8]Higgins JA,Fayer R,Trout JM,et al.Real-time PCR for the detection of Cryptosporidium parvum[J].JM icrobiol Methods,2001,47(3):323-337.
[9]王群,郑小龙,朱来华,等.马媾疫锥虫SYBR GreenⅠ荧光定量PCR检测方法的建立[J].中国预防兽医学报,2012,34(9):724-727.
[10]蒋春燕,王泰健,王琴,等.实时荧光定量PCR技术[J].动物医学进展,2005,26(12):97-101.
[11]Livio M C J,Elida M L R,Olindo A M F,et al.Comparison of different direct diagnostic methods to identify Babesia bovis and Babesia bigem ina in animals vaccinated with live attenuated parasites[J].Vet Parasitol,2006,139:231-236.
