NO对月季采后超氧化歧化酶的影响
2013-09-11邱芬,赵根
邱 芬,赵 根
(1.浙江大学农业与生物技术学院,浙江杭州 310058;2.湖州市农业科学研究院,浙江湖州 313000)
月季 (Rosa hybrida)被誉为花中皇后[1-2],采后生理及贮藏保鲜技术的研究对其鲜切花生产和采后生理理论研究具有重要意义。薛秋华等[3]研究了萨蔓莎切花衰老过程中超氧化歧化酶 (SOD)活性的变化,为延缓月季衰老提供依据。SOD是活性氧清除反应过程中第一个发挥作用的抗氧化酶,在抗氧化酶类中处于核心地位。研究表明,喷施低浓度SNP(sodium nitroprusside,硝普钠)可有效提高南方红豆杉幼苗SOD活性[4]。NaCl胁迫下添加外源NO提高了燕麦幼苗的株高和SOD活性[5]。王松华等[6]研究发现,外源 NO 对 Ni毒害有缓解作用。还有研究表明,100 μmol·L-1Ni处理能使小麦幼苗 SOD等抗氧化酶活性升高[7-8]。本试验将以SNP为外源NO供体对月季采后SOD活性影响展开研究。SNP是目前常用的NO供体。通过试验观察SNP处理后鲜切花月季中的SOD活性的变化,从而分析外源NO对月季SOD活性的影响。
1 材料与方法
1.1 试验材料
供试材料为月季品种萨蔓莎。订购60枝未经过任何处理的切花,直接干储运回试验室供用。选择含苞待放,花枝大小形态基本一致的健壮花枝39枝作为试验材料。
1.2 主要仪器及试剂
主要仪器。UV-2550紫外可见分光光度计,台式高速冷冻离心机 (杭州达科,吉西今科学仪器有限公司),FA1104型电子天平 (上海衡平仪器仪表厂),移液枪等。
储备液A。称取15.6 g NaH2PO4·2H2O于烧杯中用蒸馏水溶解,移入500 mL容量瓶中用蒸馏水定容至刻度,充分混匀。
储备液B。称取35.85 g Na2HPO4·12 H2O于烧杯中用蒸馏水溶解,移入500 mL容量瓶中用蒸馏水定容至刻度,充分混匀。
分别取上述A液8.5 mL和B液91.5 mL,用300 mL蒸馏水充分混匀后即为0.05 mol·L-1磷酸缓冲液 (pH值7.8,含0.1 mmol·L-1EDTA)。
NBT(氯化硝基四氮唑蓝)反应液。称取0.012 04 g核黄素溶于100 mL蒸馏水中,取4 mL,称取0.387 g甲硫氨酸,0.010 3 g NBT,加入磷酸盐缓冲液 (pH值7.8)196 mL溶解。
PVP(聚乙烯吡咯烷酮)。
1.3 试验方法
1.3.1 瓶插处理
以100 μmol·L-1SNP为NO的供体。试验在室温下进行,保持温度、光照等因素相同,在系统误差之内。观察月季切花在单一因素 (SNP处理)下的SOD活性变化情况。以蒸馏水为对照组。
1.3.2 瓶插预处理
将运回试验室的花材去除多余叶片,留取花梗30±2 cm,由基部45°剪后即插入蒸馏水中,使花梗基部浸入水中3 cm左右,恢复24 d(误差0.5 h),使其充分吸水。经过预处理,挑取健壮、开放程度基本一致的月季切花共39枝,挑出3枝作试验样品,待测,记为第0天,其余36支分为对照 (CK)和处理 (T)2组,重复3次。其中对照组以蒸馏水为瓶插液,处理组用100 μmol·L-1SNP为瓶插液,将其置于常温、漫射光试验台上,每日观察记录。
对照组 (CK)。将其中18枝平均放入3个盛有等量蒸馏水的瓶中,每瓶6枝,编号分别为CK1,CK2和 CK3。
处理组。将另外18枝平均放入3个盛有等量100 μmol·L-1SNP的瓶中,每瓶6枝,编号分别为 T1,T2,T3。
1.3.3 测定时间段
根据开花级数通行标准,从蕾期至萎蔫划分为6级:0级,花萼抱合直立;1级,花萼开展至水平;2级,花瓣开始松散;3级,花瓣初开,外层花瓣展开;4级,盛开,多层花瓣展开;5级,盛末,花瓣全开花朵露心;6级,蔫初,花瓣翻卷或萎蔫。在第0天 (2~3级)、切花达到盛花期(3~4级,第3天)、开始衰败期 (5级,第9天)、失去观赏价值期 (6级,第13天)各取样1次。
1.3.4 测定指标
SOD活性。测定部位为花瓣、花萼、花梗。
在每个时间段测定时,从3个对照瓶中各取1枝,分别测定3个部位的上述指标,记录数据。处理瓶测定方法同上。
1.4 月季SOD提取液的制备
取样部位为花瓣、花萼、花梗,各部位样品分别取0.6 g(精确到0.01 g)。为减小系统误差,花瓣取样采用先去除最外层花瓣,然后将剩余花瓣剪碎混匀称取样品;花萼同花瓣的取样方法;花梗取的是距花托5~10 cm茎段,剪碎混匀取样。其中边取样边用液氮快速研磨,尽可能准确测定试验指标。在每个时间段测定时,从3个对照瓶 (CK)和3个处理瓶 (T)中,每瓶取形态相近的花材1枝,统一剪取花瓣、花萼、花梗,用电子天平各准确称0.6 g样品 (精确到0.01 g),共18份。每份提取粗酶液时,将样品放进冰浴预冷的研钵中,加液氮快速研磨成粉末,然后加3次pH值7.8的磷酸盐缓冲液,每次加2 mL,再加少量2%的PVP快速碾磨成匀浆,完成后将样品转入到10 mL的离心管中,用2 mL磷酸缓冲液洗涤研钵,将洗液一并转入离心管中,成对调节平衡后用冷冻离心机在4℃,12 000 g·min-1下离心20 min,上清液即为SOD提取液,将其转入小试管中保存于4℃冰箱中备用。
1.5 紫外分光光度法测定SOD活性
1.5.1 紫外分光光度法
利用NBT法测定。取小试管18支并编号,依次加入各酶液上清液50 μL和3 mL NBT反应液为样品管。另取3支小试管,加入50 μL磷酸缓冲液和3 mL NBT溶液,2支用双层黑纸套筒全程遮光做调零用,另1支作对照管,和样品管一起在25℃下灯光照25 min(观察颜色变化,不能太深)。测560 nm下吸光值 (D)。
1.5.2 数据处理
15 μL酶液+3 mL考马斯亮蓝,于595 nm下测月季可溶性蛋白D值。
牛血清蛋白标准曲线作为蛋白标准曲线:Y=0.290 8X+0.004 6(Y为吸光值,X为蛋白质含量),利用NBT光照还原紫外分光光度法将试验测得的月季D值代入Y,求得X。
月季可溶性蛋白质含量:
M(mg·g-1鲜重)=X·VT·FW-1·V-11。
式中,VT为样液总体积 (mL),V1为测定时样品用量 (mL),FW为鲜重 (g)。
SOD活性=(DCK-Df)VT(0.5DCK·0.6M·V1)-1。
式中,DCK为照光对照管的光吸收值,Df为样品管的光吸收值,VT为样液总体积 (mL),V1为测定时样品用量 (mL),M为1 g样品中可溶性蛋白的含量。
2 结果与分析
2.1 花瓣SOD活性的变化
表1显示,瓶插前期,第0天 (复水后第1天)对照和处理花瓣SOD活性基本一致;第3天(切花达到盛花期)测定,SOD活性跟第0天相比,数值上升很多,说明瓶插前期,SOD活性值呈逐渐上升趋势;第6天 (开始衰败期)测定,SOD活性值有所下降,第9天 (失去观赏价值期)测定,SOD活性值又下降一些。说明切花瓶插第3天,处于开花最佳时期时,SOD活性达到最大,第6天和第9天花开始衰败和失去观赏价值,SOD活性随之下降;在整个瓶插过程中,花瓣SOD活性呈先升后降的趋势。经SNP处理的月季切花花瓣的SOD活性值明显大于对照组。
2.2 花萼SOD活性的变化
表2显示,瓶插前期,第0天 (复水后第1天)对照和处理花托SOD活性基本一致;第3天(切花达到盛花期)测定,与第1天相比,SOD活性上升很多,说明瓶插前期,SOD活性值呈逐渐上升趋势;第6天 (开始衰败期)测定,SOD活性值有所下降;第9天 (失去观赏价值期)测定,SOD活性值又下降一些。说明切花瓶插第3天,处于开花最佳时期时,SOD活性达到最大,第6天和第9天花开始衰败和失去观赏价值,SOD活性随之下降。在整个瓶插过程中,花瓣SOD活性呈先升后降的趋势。而经过SNP处理的月季切花花萼的SOD活性值明显大于对照组。

表1 不同时间NO对月季花瓣SOD活性的影响
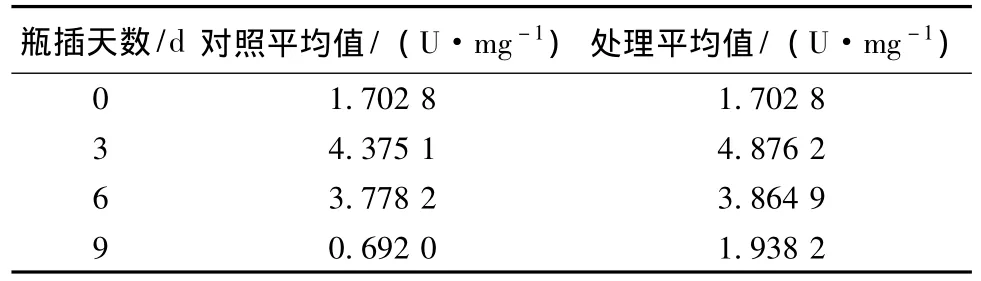
表2 不同时间NO对月季花萼SOD活性的影响
2.3 花梗SOD活性的变化
表3显示,瓶插前期,第0天 (复水后第1天)对照和处理花弯茎SOD活性基本一致;第3天 (切花达到盛花期)测定,与第1天相比,SOD活性值上升很多,说明瓶插前期,SOD活性值呈逐渐上升趋势;第6天 (开始衰败期)测定,SOD活性值有所下降;第9天 (失去观赏价值期)测定,SOD活性值又下降一些。说明切花瓶插第3天,处于开花最佳时期时,SOD活性达到最大,第6天和第9天花开始衰败和失去观赏价值,SOD活性随之下降。在整个瓶插过程中,花瓣SOD活性呈先升后降的趋势。经SNP处理的月季切花花弯茎的SOD活性值明显大于对照组。
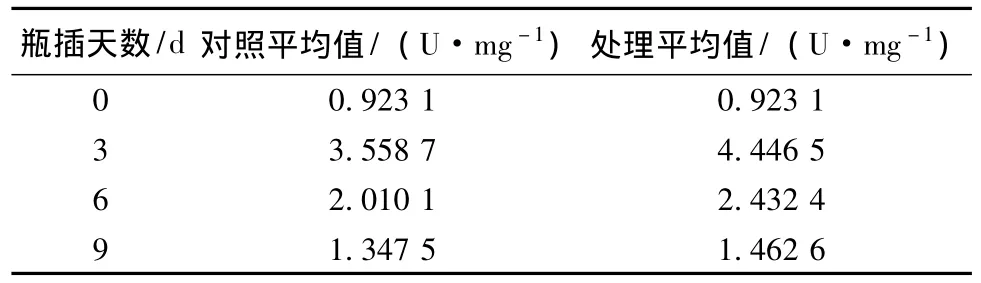
表3 不同时间NO对月季花梗SOD活性的影响
综上可知,月季切花在瓶插过程中,不同部位的SOD活性值均呈先迅速上升,达到最大值后逐渐下降的趋势。月季切花瓶插前期,SOD活性迅速增强,表明切花吸水量增加,清除活性氧保护酶的活性提高,提高了清除活性氧的能力。瓶插后期随着切花的蒸腾作用超过其吸水速率,花瓣中SOD和CAT活性下降,活性氧的产生与清除平衡系统受到破坏,导致膜脂过氧化加剧,MDA大量积累,质膜损伤,透性增加,造成花朵衰老,最终死亡。
试验显示,处理组SOD活性值高于对照组,说明NO有增强SOD活性的功能。张少颖等[9]首次将NO保鲜的研究用于月季切花,并获得了预期的效果。此外,100 μmol·L-1SNP能降低月季切花各部位的萎蔫率,说明外源NO能够延缓月季切花的衰老,延长瓶插寿命。
3 小结和讨论
试验通过用 100 μmol·L-1的外源 NO 供体SNP作为瓶插液对月季切花进行处理培养,结果表明,不同测定时间的SOD活性均明显高于对照组(蒸馏水处理)。可能NO通过某种途径诱导了SOD抗氧化酶基因的表达,增强了其活性。有研究显示,NO能诱导CAT和APX活性,并对CAT,SOD转录水平有影响[10]。100 μmol·L-1SNP 对盐胁迫下白骨壤 (A.marina)叶片SOD活性的影响是通过非 cGMP 依赖途径实现的[11]。Beligni等[10]发现,GA可减少大麦糊粉层中CSOD的含量,而NO可延缓GA所引起的CAT和SOD的减少。目前,适当浓度的外源NO能提高植物抗逆性的论断已基本上得到认同[12]。试验证明,100 mol·L-1硝普钠 (SNP)+干旱处理显著提高了刺槐幼苗叶片的SOD 和 POD 活性[13]。刘建新等[14]研究也表明,100 μmol·L-1SNP显著提高了幼苗叶片SOD含量。试验研究确定了外源NO对月季采后SOD活性的影响,得出NO能增强SOD活性,延缓月季切花衰老,延长采后寿命的结论,对月季切花保鲜技术研究具有重要意义。但在外源NO保鲜技术如何运用到实际切花保鲜方面还有待进一步探索研究,期待月季切花采后保鲜乃至其他切花保鲜道路上的重大突破。
[1]吴锦娣,王舒藜,焦雪辉,等.月季切花标准化生产[J].温室园艺,2010(8):50-53.
[2]白建波,周银丽,陶宏征,等.水杨酸对月季切花的保鲜效果[J].江苏农业科学,2012,40(7):270-272.
[3]薛秋华,林如.月季切花衰老与含水量、膜脂过氧化及保护酶活性的关系 [J].福建农业大学学报,1999,28(3):304-308.
[4]李美兰,李德文,于景华,等.外源NO对南方红豆杉幼苗光合色素及抗氧化酶的影响 [J].植物研究,2013,33(1):39-44.
[5]冯瑞章,魏琴.外源NO对NaCI胁迫下燕麦幼苗氧化损伤的缓解效应[J].草原与草坪,2012,32(6):7-10.
[6]王松华,周正义,何庆元,等.一氧化氮对小麦叶片镍毒害的缓解作用 [J].云南植物研究,2007,29(1):115-121.
[7]张兰,张彬彬,戚哲民.一氧化氮在植物体内的产生及其生物学功能 [J].滨州学院学报,2006,22(6):62-65.
[8]郭芹,王吉德,李雪萍,等.一氧化氮处理对采后番木瓜果实乙烯生物合成的影响 [J].广东农业科学,2013(3):75-78.
[9]张少颖,饶景萍,高慧.一氧化氮对切花月季瓶插过程中乙烯合成代谢的影响[J].西北农林科技大学学报:自然科学版,2007,35(11):171-175.
[10]Beligni M V,Fath A,Bethke P C,et al.Nitric oxide acts as an antioxidant and delays programmed death in barley aleurone layers[J].Plant Physiol,2002,129:1642-1650.
[11]刘招龙,张绍铃,孙益林.外源一氧化氮对梨叶片感染轮纹病菌后膜脂过氧化的影响 [J].应用生态学报,2007,18(7):1568-1572.
[12]LamattinaL, BeligniM V, Garcia-MataC. Method of enhancing the metabolic function and the growing conditions of plants and seeds[P].United States Patent,6242384,2001-06-05.
[13]李建新,任永信.外源NO对干旱下刺槐幼苗抗氧化特性的影响 [J].河南农业科学,2012,41(11):129-131.
[14]刘建新,王金成,贾海燕,等.外源NO对渗透胁迫下黑麦草种子萌发及活性氧代谢的影响[J].干旱地区农业研究,2012,30(6):128-133.
