射波刀治疗结直肠癌肝转移临床观察
2013-09-10刘春雷袁智勇庄洪卿宋勇春李凤彤
刘春雷 袁智勇 庄洪卿 宋勇春 董 洋 李凤彤 王 平
射波刀治疗结直肠癌肝转移临床观察
刘春雷 袁智勇 庄洪卿 宋勇春 董 洋 李凤彤 王 平
目的:研究射波刀(Cyberknife)治疗结直肠癌肝转移癌的临床疗效。方法:回顾性分析2006年10月至2012年5月收治的22例结直肠癌肝转移患者临床资料。患者病灶数1~4个,射波刀治疗前一周在CT或B超引导下穿刺植入金标于肿瘤内或距肿瘤2 cm范围内。根据肝转移灶部位不同给予放疗总剂量为(39~50)Gy/(3~6)次。射波刀治疗期间患者均不行同步化疗。结果:所有患者均顺利完成全程放疗。中位生存期50(15~55)个月,1、2、3年的生存率分别为100.0%、94.0%和72.5%。全组患者的无进展生存期中位数28(2.3~44)个月。1年及以上的局部控制率86.2%,放疗前接受全身系统治疗局控相对较好(P=0.07)。常见的副反应为Ⅰ~Ⅱ级恶心、呕吐及乏力,无Ⅲ级以上急性不良反应。结论:射波刀治疗结直肠癌肝转移安全有效。
结直肠癌 肝转移癌 立体定向放疗 射波刀
结直肠癌(colorectal carcinoma,CRC)是常见的恶性肿瘤之一,在我国发病率有逐年上升的趋势。肝脏是结直肠癌重要的转移部位[1-2]。而肝转移又是结直肠癌患者死亡的重要原因,仅10%~15%的肝转移癌符合手术切除[3]。射波刀具有使肿瘤局部剂量高而其周围正常组织受量低的特点,广泛应用在体部肿瘤治疗中[4-5]。其对结直肠癌肝转移的治疗也取得了令人鼓舞的疗效。现回顾分析天津医科大学附属肿瘤医院收治的结直肠癌肝转移患者临床资料,
现将初步结果报道如下。
1 材料与方法
1.1 一般资料
自2006年10月至2012年5月收治的22例患者,共32个肝转移灶。其中男15例,女7例;年龄46~85岁(中位年龄59岁)。所有患者KPS评分≥70分。肝转移同时合并肝外转移2例。所有患者均经影像学资料及血液学检测结果确诊为肝转移(表1)。
1.2 治疗方法
所有患者均采用射波刀(Cyberknife,CK)立体定向放射外科手术平台治疗,并用Synchrony呼吸追踪系统实时对肿瘤进行追踪放疗。放疗定位前一周在B超或CT引导下穿刺植入3~5 mm长的金标于肿瘤内或肿瘤周围2 cm以内的位置,植入金标数1~4枚。金标植入1周后用真空气垫固定患者于治疗体位,并行层厚为1 mm的强化CT模拟定位图像扫描。若患者定位前行MRI检查,可与强化CT图像融合后进行靶区勾画。其中有定位前MRI图像共17例,余单独根据CT定位图像勾画靶区。肿瘤靶区(gross tumor volume,GTV)为影像资料显示的肝转移灶;计划靶区(planning target volume,PTV)为GTV外扩0.5 cm。正常组织剂量限值:胃V21<5 cm3,最大剂量点<30 Gy;十二指肠V15<5 mL,最大剂量点<24 Gy;脊髓最大剂量<22 Gy;双侧肾脏总的V15<33%。肝转移治疗相关参数详表2。

表1 患者一般情况Table 1 Clinical characteristics of the patients
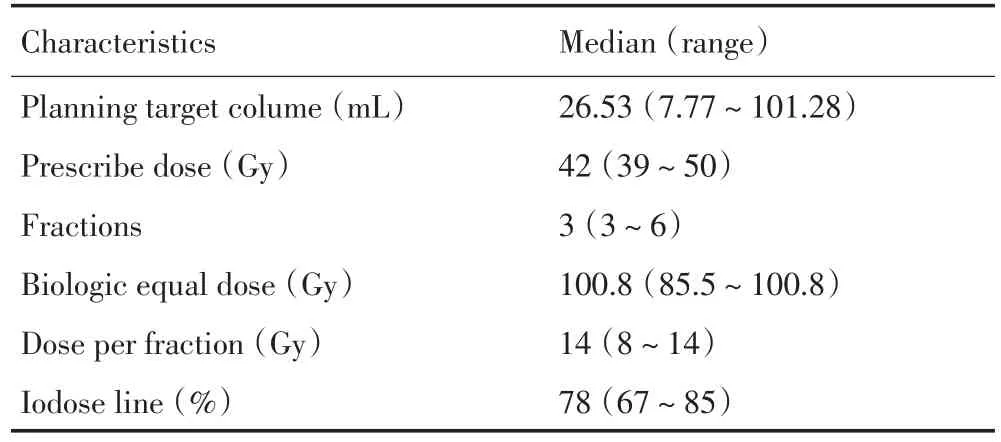
表2 肝转移射波刀治疗参数Table 2 Parameters of Cyberknife treatment
1.3 临床评价及随访
根据RECIST标准对肝转移灶局部反应情况进行评价。1)局部控制(local control,LC):局控时间为自放疗开始至肿瘤局部进展,即使新出现肝内转移或肝外转移,放疗病灶未进展则计算局控时间;2)生存期(overall survival,OS):自放疗开始至随访截止日期或患者死亡日期;3)无进展生存期(progression-free survival,PFS):自放疗开始至出现肝内复发或新转移或肝外转移的时间。副反应根据NCI CTCAE 3.0进行评估。所有患者在随访中行上腹部CT或MRI检查,放疗后1个月、3个月及6个月各随访1次,此后根据患者治疗效果具体情况进行随访。
1.4 统计学分析
采用SPSS 16.0软件行Kaplan-Meier法计算生存率并Log-rank法检验和单因素预后分析。P<0.05为差异有统计学意义。
2 结果
2.1 局部控制情况
所有患者肝转移灶均进行局部疗效评价:CR 19个,PR 11个,SD及PD各1个。全部病灶1年及截止随访日期的局部控制率为86.2%(图1)。局部控制单因素分析显示,射波刀治疗前14例曾行全身治疗(化疗或生物治疗)的患者肝转移局部控制率较好,结果接近有统计学意义(P=0.07)。其他统计因素未发现对局部控制有影响。
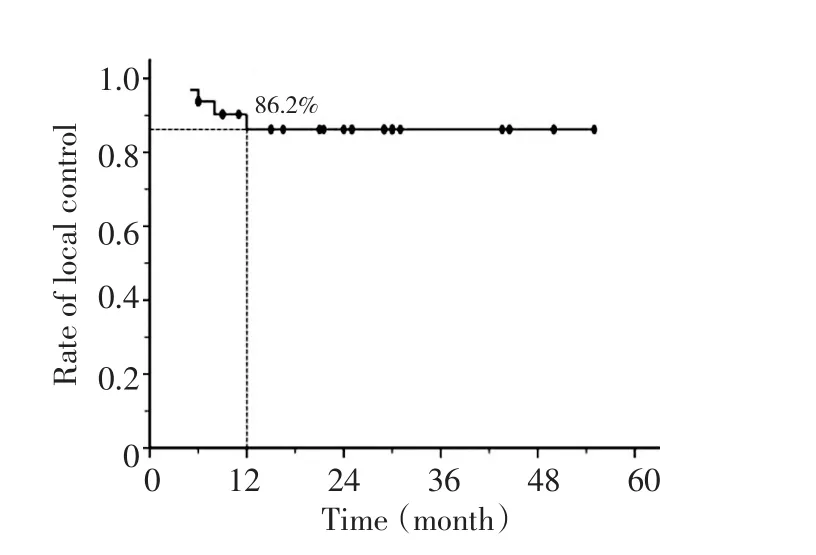
图1 射波刀治疗的局部控制曲线Figure 1 Curve of local control for Cyberknife treatment
2.2 生存情况
截止2012年8月所有患者无失访。全组22例的中位生存期为50个月(图2);中位无进展生存期(PFS)为28个月。射波刀治疗后肝内出现新转移灶2例,肝外其他部位现新转移灶5例。疗后接受化疗9例,生物治疗5例,肝转移手术治疗2例。随访截止共4例死亡,其中2例肺转移,1例肝内多发转移,1例肝内及肝外同时出现转移。
2.3 治疗相关不良反应情况
所有患者对射波刀治疗耐受良好,均顺利完成全程放疗。常见的急性不良反应为Ⅰ~Ⅱ级的恶心、呕吐及乏力,给予对症或支持治疗后均缓解。未出现Ⅲ级以上的急性期不良反应和晚期不良反应(表3)。
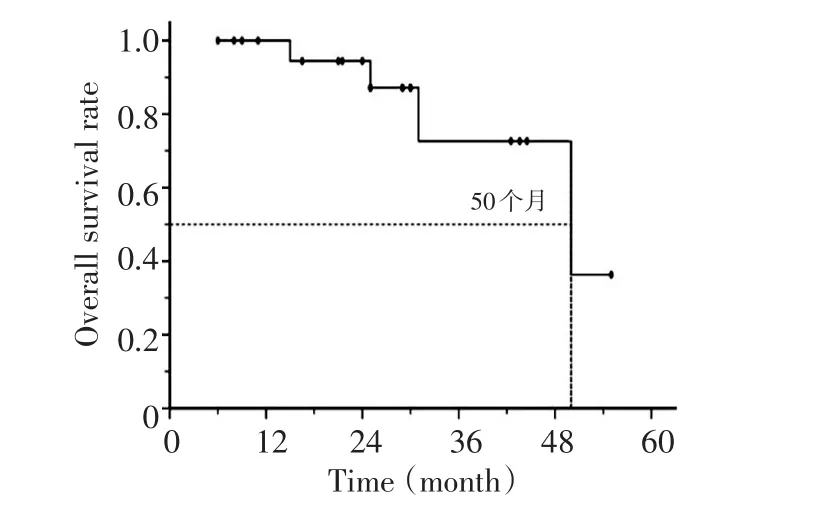
图2 射波刀治疗的生存曲线Figure 2 Curve of overall survival for Cyberknife treatment

表3 射波刀治疗相关急性及晚期不良反应 例Table 3 Acute and late toxicity of Cyberknife treatment
3 讨论
在过去的二十多年局部治疗已成为结直肠癌肝转移治疗的常规方法。两项回顾性研究结直肠癌肝转移手术治疗结果显示,其5年生存率为28%~37%。在这两项研究中,有不良预后因素的肝转移患者(如切缘阳性、合并肝外转移、淋巴结阳性等)其5年生存率为14%[6-7]。因此手术切除肝转移灶一直被认为是首选的局部治疗手段。但由于肝转移灶的大小及所在位置的影响,有80%~90%肝转移患者不能手术切除,新辅助化疗仅能使10%~30%患者降期继而接受手术治疗[8]。因此,其他局部治疗方法如冷冻疗法(Cryotherapy)、激光热疗(laser-induced thermotherapy,LITT)及射频消融(radiofrequency ablation,RFA)逐渐应用于肝转移癌治疗中[9-11]。放疗作为局部治疗手段也逐渐应用于肝转移癌的治疗,但上个世纪八九十年代很多研究结果推荐的全肝放疗因可导致放射性肝疾病的严重风险,限制了放疗剂量的提高而达不到满意的肿瘤控制。
立体定向放疗因为具有肿瘤靶区剂量分布集中、靶区周边剂量梯度变化较大及靶区周边正常组织受照剂量较小等特点,自1995年第一篇文献报道以来逐渐应用于体部肿瘤的放射治疗[12]。射波刀治疗肝转移癌时通过追踪植入的金标及呼吸同步技术,真正的达到了图像引导的立体定向放疗。本研究中患者均接受射波刀治疗,全部肝转移灶1年及以上的局部控制率为86.2%,仅1例出现放疗病灶局部进展。本研究发现放疗前接受全身治疗的患者局部控制较好,结果无统计学意义可能与样本量较少有关。Chang等[13]报道结直肠癌肝转移、肺转移及淋巴结转移采用15Gy×3次立体定向放疗,共141个转移灶的总体2年局部控制率为79%,新辅助化疗能提高局部控制率。总体局部控制率与文献报道肝转移癌立体定向放疗后的2年局控率66%~92%[14-15]。射频消融在肝转移癌中应用较其他局部治疗应用广泛,最近Otto等[16]报道28例结直肠癌肝转移患者接受RFA治疗后的累积局部失败率为32%,1年的局部控制率为58%,而在1年内33%的患者肝转移灶再次接受局部治疗。
本组研究全组病例的3年生存率为72.5%,尚无5年生存率结果,但与手术治疗结直肠癌肝转移的3年生存率相比很接近[17]。手术治疗肝转移癌往往对患者有很严格的选择条件,而接受立体定向放疗的患者很大部分已经接受了化疗等全身治疗或其他局部治疗,这些患者与接受手术患者相比较其预后相对较差。很多研究结果报道RFA治疗结直肠癌肝转移的3年生存率为30%~46%[18-19],与立体定向放疗及手术比较相对较低,原因可能是RFA治疗后局部复发率高导致。因为结直肠癌患者肝转移是主要的死亡原因之一,所以治疗肝转移灶达到局部治愈至关重要。射波刀能获得与手术相近的生存率可能与其较高的局部控制率有关,并且在放疗转移灶时对其周围可能存在的亚临床病灶也给予了一定的剂量照射,更好的降低了肝内复发的可能。
同时射波刀治疗肝转移肿瘤并不受其所处的位置影响,根据肿瘤部位可以调整单次放疗剂量及总剂量达到安全治疗的目的。在本组病例中并未出现Ⅲ级以上放疗相关的急性及晚期不良反应,本研究结果与文献报道相符。Rusthoven等[15]报道的一项多中心立体定向放疗肝转移癌Ⅰ/Ⅱ期临床研究结果显示,47例有1~3个肝转移灶的患者中1例放疗后出现了3级胸壁软组织溃疡的不良反应。Vautravers等[5]比较40 Gy/4次与45 Gy/3次的立体定向放疗对肝转移癌疗效研究中,42例患者中1例出现了3级表皮炎症的不良反应。肝转移癌其他局部治疗方法的副反应文献也有报道。Ng等[20]采用Cryotherapy治疗219例患者,其中1例出现治疗相关死亡并27.6%的患者出现严重并发症。Eickmeyer等[10]报道LITT治疗2 131例原发或肝转移癌患者中,3例出现治疗相关死亡。Curley等[11]报道采用RFA治疗608例患者出现3例治疗相关死亡,治疗相关并发症发生率为9.5%。而立体定向放疗在肝转移癌治疗中未见治疗相关死亡报道,本组结果表明立体定向放疗治疗肝转移癌安全可靠。
综上所述,射波刀立体定向放疗结直肠癌肝转移获得很好的局部控制,这可使其生存期显著延长,且对不能手术或存在其他局部治疗禁忌的患者提供了一种很好的治疗选择。联合全身治疗可能提高射波刀治疗的疗效,这还需要更长时间更多样本的研究。
1 McMillan DC,McArdle CS.Epideminology of colorectal liver metastases[J].Surg Oncol,2007,16(1):3-5.
2 Kitasato Y,Ishida Y,Okabe Y,et al.Endoscopic retrograde biliary drainage for the liver metastases from colorectal cancer and obstructive jaundice[J].Gan To Kagaku Ryoho,2012,39(12):1860-1862.
3 Andreou A,Aloia TA,Brouquet A,et al.Recent advances in the curative treatment of colorectal liver metastases[J].Gastrointest Cancer Res,2011,4(4):S2-8.
4 Martin T,Odd TB,Einar W,et al.Stereotactic Body Radiation Therapy Is Effective and Safe in Patients with Early-Stage Non-Small Cell Lung Cancer with Low Performance Status and Severe Comorbidity[J].Case Rep Oncol,2011,4(1):25-34.
5 Vautravers-Dewas C,Dewas S,Bonodeau F,et al.Image-guided robotic stereotactic body radiation therapy for liver metastases:is there a dose response relationship?[J].Int J Rad Oncol Biol Phys,2011,81(3):39-47.
6 Van JM,Meijerink M,Sietses C,et al.Long-term results of radiofrequency ablation for unresectable colorectal liver metastases:a potentially curative intervention[J].Br J Radiol,2011,84(1002):556-565.
7 Fong Y,Fortner J,Sun RL,et al.Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer:Analysis of 1001 consecutive cases[J].Ann Surg,1999,230(3):309-318.
8 Morris EJ,Forman D,Thomas JD,et al.Surgical management and outcomes of colorectal cancer liver metastases[J].Br J Surg,2010,97(7):1110-1118.
9 Choi J,Bischof JC.Review of biomaterial thermal property measurements in the cryogenic regime and their use for prediction of equilibrium and non-equilibrium freezing applications in cryobiology[J].Cryobiology,2010,60(1):52-70.
10 Eickmeyer F,Schwarzmaier HJ,Müller FP,et al.Survival after laser-induced interstitial thermotherapy of colorectal liver metastases-a comparison of first clinical experiences with current therapy results[J].Rofo,2008,180(1):35-41.
11 Curley SA,Marra P,Beaty K,et al.Early and late complications after radiofrequency ablation of malignant liver tumors in 608 patients[J].Ann Surg,2004,239(4):450-458.
12 Nagata Y,Wulf J,Lax I,et al.Stereotactic radiotherapy of primary lung cancer and other targets:results of consultant meeting of the International Atomic Energy Agency[J].Int J Radiat Oncol Biol Phys,2011,79(3):660-669.
13 Chang DT,Swaminath A,Kozak M,et al.Stereotactic body radiotherapy for colorectal liver metastases:a pooled analysis[J].Cancer,2011,117(17):4060-4069.
14 Wulf J,Guckenberger M,Haedinger U,et al.Stereotactic radiotherapy of primary liver cancer and hepatic metastases[J].Acta Oncol,2006,45(7):838-847.
15 Rusthoven KE,Kavanagh BD,Cardenes H,et al.Multi-institutional phaseⅠ/Ⅱ trial of stereotactic body radiation therapy for liver metastases[J].J Clin Oncol,2009,27(10):1572-1578.
16 Otto G,Duber C,Hoppe-LotichiusM,et al.Radiofrequency ablation as first-line treatment in patients with early colorectal liver metastases amenable to surgery[J].Ann Surg,2010,251(5):796-803.
17 Aloia TA,Vauthey JN,Loyer EM,et al.Solitary colorectal liver metastasis:Resection determines outcome[J].Arch Surg,2006,141(5):460-466.
18 Wong SL,Mangu PB,Choti MA,et al.American Society of Clinical Oncology 2009 clinical evidence review on radiofrequency ablation of hepatic metastases from colorectal cancer[J].J Clin Oncol,2010,28(3):493-508.
19 Guenette JP,Dupuy DE.Radiofrequency ablation of colorectal hepatic metastases[J].J Surg Oncol,2010,102(8):978-987.
20 Ng KM,Chua TC,Saxena A,et al.Two decades of experience with hepatic cryotherapy for advanced colorectal metastases[J].Ann Surg Oncol,2012,19(4):1276-1283.
(2012-08-30收稿)
Clinical outcomes of Cyberknife treatment for liver metastases of colorectal cancer
Chunlei LIU,Zhiyong YUAN,Hongqing ZHUANG,Yongchun SONG,Yang DONG,Fengtong LI,Ping WANG
Zhiyong YUAN;E-mail:zhiyong0524@163.com
Department of Radiation Oncology,Tianjin Medical University Cancer Institute and Hospital;Key Laboratory of Cancer Preven tion and Treatment of Tianjin City,Tianjin 300060,China
Objective:This study aims to evaluate the clinical efficacy of Cyberknife for treating colorectal cancer(CRCa)patients with liver metastases.Methods:Data of 22 CRCa patients with liver metastases were retrospectively studied.All patients were admitted to Tianjin Cancer Hospital from October 2006 to May 2012.They were implanted with a gold marker in the lesions or around the tumor less than 2 cm under computer tomography or ultrasound.The total radiation dose was(39-50)Gy/(3-6)fractions according to the location of liver metastases.None
concurrent chemotherapy during Cyberknife radiotherapy.Results:All patients successfully completed the Cyberknife treatment.The median overall survival was 50 months(range,15 to 55 months).The one-,two-,and three-year survival rates were 100%,94%,and 72.5%,respectively.The median progression-free survival was 28 months(range,2.3 to 44 months).The local control for one year or more was 82.6%.The patients that received systemic therapy before Cyberknife showed relatively good local control(P=0.07).The most common toxicity was grade 1 or 2 nausea,vomiting,and weakness.No gradeⅢor worse acute toxicity was found.No late toxicity was also observed.Conclusion:Cyberknife is a safe and effective treatment for CRCa patients with liver metastases.
colorectal carcinoma,liver metastases,stereotactic radiation therapy,Cyberknife
10.3969/j.issn.1000-8179.2013.06.013
天津医科大学附属肿瘤医院放疗科,天津市肿瘤防治重点实验室,天津市肺癌诊治中心(天津市300060)
袁智勇 zhiyong0524@163.com
(2013-01-23修回)
杨红欣)
