宫内发育迟缓大鼠肾脏Wilms 瘤1 基因DNA 甲基化与蛋白尿关系
2013-09-10匡新宇汤小山
陈 径 匡新宇 徐 虹 沈 茜 汤小山
近年来,成人疾病源于胎儿期的假说[1]获得了越来越多的支持,宫内环境与成年期疾病的相关性逐渐受到关注。研究显示不良的宫内环境不仅可引起宫内发育迟缓( IUGR) ,而且可通过“发育程序化”途径,对机体各器官结构和功能产生长期以至终身的影响,如高血压、冠心病、2 型糖尿病和慢性肾脏病等[1]。生后长期随访证实,IUGR明显增加了发生蛋白尿和终末期肾病的风险[2,3],但其机制仍未阐明。本课题组前期研究发现Wilms 瘤1( WT1) 基因可能是IUGR 引起生后肾小球数目减少等肾脏病变的重要分子[4],并且已有研究发现WT1 基因的表达可能与DNA甲基化相关[5]。因此,本研究拟通过已建立的IUGR 大鼠模型,观察宫内环境对生后成年期大鼠肾脏功能的影响,并对WT1 基因甲基化水平进行定量分析,探讨其在“发育程序化”肾脏疾病中的作用。
1 方法
1.1 实验动物 清洁级雌性SD 大鼠6 只,体重250 ~300 g。复旦大学药学院实验动物中心提供。
1.2 IUGR 大鼠模型建立 雌性SD 大鼠与雄性大鼠交配受孕后,分为2 组,每组3 只。其中一组以孕期全程低蛋白饲料(6%低蛋白等热卡饲料) 饲养[6],自由采食,直至自然分娩,所生新生鼠出生体重在正常新生鼠平均体重2 s 以下者为IUGR 新生鼠[7],作为IUGR 组。另一组以孕期常规饲料(22%蛋白) 饲养至自然分娩,新生鼠作为对照组。两组均选取8 只新生雄鼠作为研究对象,母乳喂养3周,第4 周断乳后以常规饲料喂养至12 周龄( 成年期) 。
1.3 标本采集 12 周龄时,代谢笼收集两组大鼠24 h 尿液用于尿蛋白定量检测;10%水合氯醛麻醉后,腹主动脉插管收集血标本测定血生化指标;肾脏在腹主动脉插管后注入4℃预冷的生理盐水反复灌洗,摘取右侧肾脏,分离皮质并速冻于液氮中,-80℃保存,用于肾组织总RNA 抽提;同时摘取左侧肾脏,用于肾小球数目测定。
1.4 观察指标
1.4.1 生化指标 采用日立7060 型全自动生化分析仪检测血清总蛋白、白蛋白、肌酐、尿素氮、尿酸和胱抑素-C 水平;比色法测定24 h 尿蛋白定量。
1.4.2 肾小球数目测定 左侧肾脏置于10%中性福尔马林溶液中,常规石蜡包埋。石蜡切片机平行于肾脏短轴经肾门横断修块,3 μm 切片,苏木精-伊红染色。由复旦大学附属儿科医院病理科医生单盲计数肾小球数目。
1.4.3 WT1 基因及甲基化转移酶( DNMT) mRNA 的表达
抽提大鼠肾脏总RNA,并逆转录为cDNA,采用实时PCR法检测WT1、DNMT1、DNMT3a 和DNMT3b mRNA 表达水平,以β-actin 作为内参,引物见表1。目的基因与β-actin的Ct 值的差值为ΔCt 值,目的基因与参照样品ΔCt 值的差值为ΔΔCt 值,以2 -ΔΔCt 为相对含量进行分析。
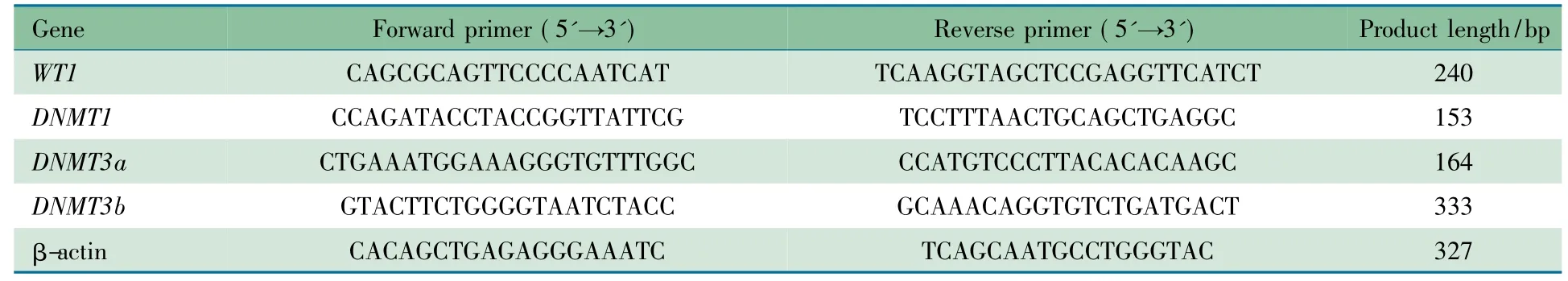
表1 实时PCR 所用引物序列及基因扩增长度Tab 1 Sequences of primer and the length of product with real-time PCR
1.4.4 WT1 基因启动子区DNA 甲基化状态测定 采用AxyPreP 基因组DNA 小量试剂盒抽提大鼠肾皮质基因组DNA。使用EZ DNA Methylation-Gold-Kit( Zymo Research)进行基因组DNA 转化。WT1 基因启动子区CpG 岛采用Epityper 软件设计PCR 引物( http: //epidesigner. com,表1) 。每对引物反义链添加T7-启动子,正义链添加10-mer调整熔点差异。以亚硫酸氢盐转化后的DNA 为模板,应用热启动TaqDNA 酶扩增目的基因片段。使用MassARRAY Nanodispenser RSl000 点样仪将纯化后PCR 产物点至SpectroCHIP 芯片上,运用MassARRAY Workstation Compact进行SpectroCHIP 检测,检测结果采用Epityper 软件分析( Sequenom) 。
经软件分析,WT1 基因启动子区共有2 个CpG 岛,120个CpG 位点,根据CpG 位点的密集程度共设计3 段PCR引物,扩增片段信息如表2 所示。
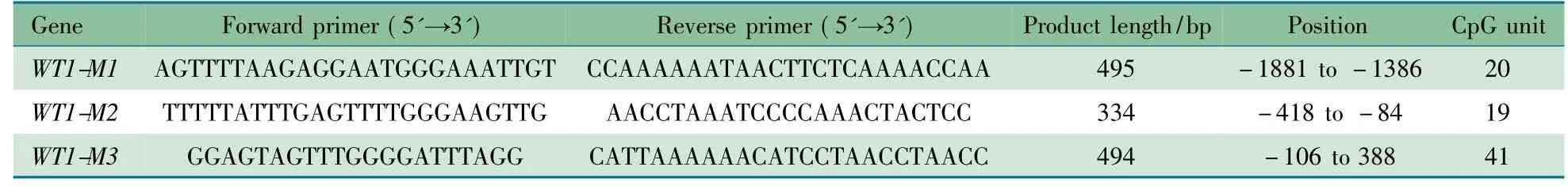
表2 MassARRAY 定量甲基化分析引物序列、长度、位置及包含CpG 位点数量Tab 2 Primer sequences,product length,position,and CpG units by MassArray quantitative methylation analysis
1.5 统计学方法 采用SPSS 10.0 软件进行统计学分析。计量资料以x±s表示,两组间比较采用独立样本t 检验,相关性分析采用Pearson 相关分析。P <0.05 为差异有统计学意义。
2 结果
2.1 两组大鼠体重比较 IUGR 组新生雄鼠出生体重显著低于对照组,(4.8 ±0.2) vs (7.4 ±0.1) g( P <0.000 1) ,并且直至12 周龄时体重仍低于对照组( P =0.043) ,未能达到生长追赶( 表3) 。
2.2 两组大鼠肾功能比较 与对照组相比,12 周龄时IUGR 组大鼠24 h 尿蛋白定量显著增高( P =0.016) ; 血清胱抑素C 水平也显著升高( P =0.036) ,但血清总蛋白、白蛋白、肌酐、尿素氮和尿酸水平差异无统计学意义( P 均>0.05) ( 表3) 。
2.3 两组大鼠肾小球数目比较 12 周龄时IUGR 组大鼠肾小球数目明显少于对照组( P=0.001) ( 表3) 。
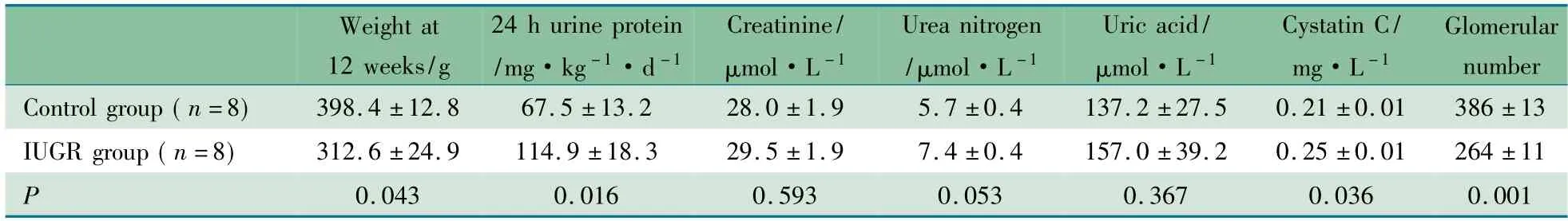
表3 两组大鼠12 周龄时体重、生化指标和肾小球数目比较( x±s)Tab 3 Comparison of body weight,biochemical parameters and the number of glomerular at 12 weeks of age between two groups( x±s)
2.4 两组大鼠肾组织WT1 基因mRNA 的表达 12 周龄时IUGR 组大鼠肾组织WT1 基因mRNA 的表达显著高于对照组,(3.55 ±0.53) vs (1.58 ±0.59) ,P=0.047。
2.5 两组大鼠肾脏WT1 基因甲基化水平 12 周龄时,IUGR 组大鼠WT1 基因启动子区DNA 平均甲基化水平较对照组显著降低,( 0.13 ±0. 01) vs ( 0. 18 ±0. 02) ,P =0.029,其中M1 和M3 段降低更为显著,P 值分别为0.028和0.012。Pearson 相关性分析显示,WT1 基因mRNA 水平和WT1 基因M1 段甲基化水平呈负相关,r = -0.939,P =0.000 1。
2.6 两组大鼠肾脏甲基转移酶表达 12 周龄时,IUGR 组大鼠DNMT1 和DNMT3b mRNA 表达水平较对照组显著降低,DNMT1:(2.06 ±0.28) vs ( 3.89 ±0.36) ( P =0.003) ,DNMT3b:(0.94 ±0.13) vs ( 1. 53 ±0. 13) ( P =0. 010) ;DNMT3a mRNA 水平则与对照组差异无统计学意义,(4.68 ±0.44) vs (5.10 ±0.51) ,P =0.749。Pearson 相关性分析显示,DNMT1 和DNMT3b mRNA 水平与WT1 基因M1 段甲基化水平呈正相关,DNMT1: r = 0. 935,P =0.000 1;DNMT3b:r=0.895,P=0.000 1。
3 讨论
本研究以孕期低蛋白饮食建立IUGR 大鼠模型,结果显示,成年期时IUGR 组大鼠尿蛋白排泄明显增多,且肾脏WT1 基因mRNA 表达显著增高; 研究还显示IUGR 组大鼠肾脏WT1 基因DNA 甲基化水平显著降低,且与DNMT1、DNMT3b mRNA 的表达减低相关,提示DNMT1 和DNMT3b调节的WT1 基因启动子区甲基化水平的降低,可能参与了WT1 基因过表达的发生,可能是IUGR 大鼠成年期发生蛋白尿的重要机制之一。
IUGR 组大鼠出生体重显著低于对照组,且肾小球数目显著减少,与本课题组前期研究结果一致[8]。同时,本研究结果显示IUGR 组大鼠血清胱抑素C 水平显著增高。胱抑素C 作为肾功能早期受损的敏感指标,提示IUGR 组大鼠肾脏滤过功能受损。Brenner 等[9]提出先天性肾单位数目减少是引起肾脏损害的重要机制之一。IUGR 大鼠由于先天肾小球数目减少,使得剩余肾小球处于高灌注和高滤过状态,以代偿和维持肾功能的稳定。这种长期的代偿过程,可能加重肾脏负担,并将最终影响肾脏功能。
WT1 基因在发育成熟的肾脏中仅在足细胞中表达,以维持足细胞的正常功能[10]。作为转录因子,WT1 基因还可与NPHS1 和PODXL 启动子区结合,使足细胞重要分子Nephrin 和podocalyxin 的表达失衡[11,12],从而影响足细胞的结构和功能。肾小球足细胞作为肾小球滤过膜的关键组分,对维护肾小球的滤过屏障至关重要。而本课题组前期研究也发现,成年期IUGR 大鼠存在足细胞足突的部分融合[8]。因此,推测WT1 基因mRNA 的过表达可能引发了足细胞的损伤,参与了IUGR 所致蛋白尿的发生。
在本研究模型中,孕期母体蛋白摄入的限制是唯一干预手段。有证据显示,不良宫内环境,如孕母饮食[13]、行为[14]及子宫动脉血流[15],都可引起表观遗传学变化,从而调控基因的表达。DNA 甲基化是表观遗传学的重要方式之一,主要发生在CpG 二核苷酸的胞嘧啶上,可以诱导转录的终止[16]。本研究通过MassARRAY 甲基化定量分析方法发现IUGR 组大鼠成年期肾脏WT1 基因甲基化水平显著降低,并且其M1 段甲基化水平与WT1 基因mRNA 的表达量呈显著负相关,提示WT1 基因甲基化水平的改变可能参与了其表达变化的调控。
DNA 甲基化是通过甲基转移酶家族介导的,包括DNMT1、DNMT2、DNMT3a、DNMT3b 和DNMT3L,其中只有DNMT1、DNMT3a 和DNMT3b 具有甲基转移活性。DNMT1主要在DNA 复制和修复中维持其甲基化水平,是细胞中表达最多的甲基转移酶[17];而DNMT3a 和DNMT3b 则是在胚胎发育阶段建立甲基化状态,即甲基化的从头合成,因此DNMT3a 和DNMT3b 在胚胎干细胞呈高表达水平,相反,在已分化成熟的细胞中则呈现低水平表达[18]。本研究中,12周龄时IUGR 大鼠肾脏DNMT1 和DNMT3b mRNA 的表达显著降低,并与WT1 基因甲基化水平呈正相关,提示DNMT1 和DNMT3b 调节的WT1 基因启动子区甲基化水平的降低可能是WT1 基因过表达的重要机制之一。
总之,研究结果显示IUGR 大鼠肾脏存在WT1 基因甲基化模式的异常改变,并且可能参与了WT1 基因的异常表达,这些改变可能是IUGR 大鼠成年期出现蛋白尿的分子机制之一。这一结果为进一步完善“发育程序化”肾脏疾病的发病机制提供了更为广阔的思路。
本研究的不足之处:仅对IUGR 大鼠肾脏WT1 基因的表达、WT1 基因甲基化水平进行了检测,而WT1 基因甲基化的异常改变是否参与了WT1 基因表达的调控,并且通过何种途径导致了蛋白尿的发生仍有待进一步研究。
[1]Godfrey KM, Barker DJ. Fetal nutrition and adult disease.Am J Clin Nutr,2000,71(5S):1344-1352
[2]Keijzer-Veen MG, Schrevel M, Finken MJ, et al.Microalbuminuria and lower glomerular filtration rate at young adult age in subjects born very premature and after intrauterine growth retardation. J Am Soc Nephrol,2005,16(9):2762-2768
[3]Lackland DT, Bendall HE, Osmond C, et al. Low birth weights contribute to high rates of early-onset chronic renal failure in the Southeastern United States. Arch Intern Med,2000,160(10):1472-1476
[4]Chen J(陈径), Xu H, Guo W, et al. Mechanism of nephron deficit in rat model of intrauterine growth retardation. Chin J Nephrol(中华肾脏病杂志),2007,23(5):318-322
[5]Mares J, Kríz V, Weinhäusel A, et al. Methylation changes in promoter and enhancer regions of the WT1 gene in Wilms'tumours. Cancer Lett,2001,166(2):165-171
[6]Jones SE, Bilous RW, Flyvbjerg A, et al. Intra-uterine environment influences glomerular number and acute renel adaptation to experimental diabetes. Diabetologia,2001,44(6):721-728
[7]Lin QD(林其德). 胎儿宫内发育迟缓的定义及分类.Chinese Journal of Practical Gynecology and Obstetrics(中国实用妇科与产科杂志),2002,18(1):5-6
[8]Chen J, Xu H, Shen Q, et al. Effect of postnatal high protein diet on kidney function of rats exposed to intrauterine protein restriction. Pedatric Res,2010,68(2):100-104
[9]Brenner BM, Chertow GM. Congenital oligonephropathy and the etiology of adult hypertension and progressive renal injury.Am J Kidney Dis,1994,23(2):171-175
[10]Guo JK, Menke AL, Gubler MC, et al. WT1 is a key regulator of podocyte function: reduced expression levels cause crescentic glomerulonephritis and mesangial sclerosis. Hum Mol Genet,2002,11(6): 651-659
[11]Wagner N, Wagner KD, Xing Y, et al. The major podocyte protein nephrin is transcriptionally activated by the Wilms'tumor suppressor WT1. J Am Soc Nephrol,2004,15(12):3044-3051
[12]Palmer RE, Kotsianti A, Cadman B, et al. WT1 regulates the expression of the major glomerular podocyte membrane protein Podocalyxin. Curr Biol,2001,11(22):1805-1809
[13]Dolinoy DC, Huang D, Jirtle RL. Maternal nutrient supplementation counteracts bisphenol A-induced DNA hypomethylation in early development. Proc Natl Acad Sci USA,2007,104(32):13056-13061
[14]Weaver IC, Cervoni N, Champagne FA, et al. Epigenetic programming by maternal behavior. Nat Neurosci,2004,7(8):847-854
[15]Pham TD, MacLennan NK, Chiu CT, et al. Uteroplacental insufficiency increases apoptosis and alters p53 gene methylation in the full-term IUGR rat kidney. Am J Physiol Regul Integr Comp Physiol,2003,285(5): 962-970
[16]Hanson M, Godfrey KM, Lillycrop KA, et al. Developmental plasticity and developmental origins of non-communicable disease: theoretical considerations and epigenetic mechanisms.Prog Biophys Mol Biol,2011,106(1):272-280
[17]Portela A, Esteller M. Epigenetic modifications and human disease. Nat Biotechnol,2010,28(10):1057-1068
[18]Esteller M. Epigenetic gene silencing in cancer: the DNA hypermethylome. Hum Mol Genet,2007,16(1):50-59
