甘蔗不同部位宿根矮化病分子检测研究
2013-09-10张荣跃单红丽王晓燕罗志明
张荣跃,单红丽,王晓燕,尹 炯,申 科,罗志明
(云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,开远 661699)
甘蔗宿根矮化病(Ratoon Stunting Disease,RSD)是一种世界性的重要甘蔗病害,由一种寄居木质部的细菌(Leifsonia xyli subsp.xyli,Lxx)引起[1]。蔗株染病后矮化,分蘖减少,蔗茎变细,节间缩短,一般减产12%~37%,蔗糖分降低0.5个百分点[2]。RSD没有明显的外部和内部症状,从外观难以鉴定,从而导致病害广泛蔓延传播,该病主要通过带病蔗种和收获、砍种刀具等传播蔓延,且传播性极强[3],目前有效的防治方法是生产、繁殖和推广脱毒健康种苗。
目前我国对甘蔗宿根矮化病菌的检测方法主要使用PCR检测法。由于Lxx主要寄生于蔗株维管束组织,所以PCR检测RSD主要使用甘蔗汁,但使用甘蔗汁检测RSD取样和取汁程序比较繁琐,而且榨汁过程容易污染,并且对于甘蔗苗期和组培苗等无法取汁进行检测,有其局限性,采用甘蔗其它部位检测RSD可避免这些情况。本文采用常规PCR方法对甘蔗不同部位进行了多次重复检测,比较了甘蔗不同部位与蔗汁检测RSD的准确率,为今后使用甘蔗其它部位检测RSD提供科学数据。
1 材料与方法
1.1 样品采集
供试样品采自于云南省农业科学院甘蔗研究所第二科研基地脱毒种苗试验对照,株龄10个月,品种为粤糖93-159和ROC25,每个品种随机取样3株,每株取不同部位(叶片、叶鞘、茎尖、茎部组织)和蔗汁[4],3株同一品种甘蔗的同一部位混合成一个样品,置于-20℃保存备用。
1.2 PCR检测
1.2.1 甘蔗总DNA提取 甘蔗样品用液氮磨成粉末,取约0.3g于1.5mL离心管中,立即加入1000 μL 65℃预热的2%CTAB提取液,65℃水浴1h,期间颠倒离心管数次;12000r/min离心10min,取上清液,加入等体积氯仿∶异戊醇(24∶1),充分混匀;12000r/min离心10min,取上清液,加入2/3体积的异丙醇,混匀后置于-20℃沉淀2h;12000r/min离心10min,弃上清,沉淀用70%乙醇洗涤2次,室温风干,溶于30μL ddH2O中,-20℃保存备用。
1.2.2 蔗汁DNA的提取 取4mL蔗汁,12000r/min 4℃离心15min,弃上清,沉淀加300μL灭菌双蒸水混匀;加入600μL经65℃预热的2%CTAB提取液,65℃水浴1h,期间颠倒离心管数次;加入600μL氯仿/异戊醇(24∶1)充分混匀,12000r/min离心10min;取上清,加入2/3体积的异丙醇,混匀后置于-20℃冰箱中沉淀2h;12000r/min离心10min,弃上清,沉淀用70%乙醇洗涤2次,室温风干后,溶于30μL ddH2O中,-20℃保存备用。
1.2.3 PCR扩增 引物序列采用文献[5]报道的RSD病原细菌Lxx 16S~23SrDNA基因间隔区特异引物,委托上海生工生物技术有限公司合成,预期扩增产物长度为438bp。其序列为:
上游引物 Lxxl:5′-CCGAAGTGAGCAGATTGACC-3′
下游引物 Lxx2:5′-ACCCTGTGTTGTTTTCAACG-3′
PCR 反应体系 (20 μL) 包括 2×PCR Taq Master 8μL,Cxx1 和 Cxx2 各 0.2 μL,ddH2O 8.6μL,DNA 3μL。PCR 扩增程序:95℃ 5min;94℃ 30s,56℃ 30s,72℃ 1min,35 个循环,72℃ 5min。
2 结果与分析
采用常规PCR检测方法对粤糖93-159和ROC25的叶片、叶鞘、茎尖、茎部组织和蔗汁样品分别进行了5次重复检测,检测结果(表1)表明,两个品种叶片均只有1次检测呈阳性,检出率均为20%;粤糖93-159叶鞘检测出5次阳性,检出率为100%,ROC25叶鞘检测出4次阳性,检出率为80%,两个品种叶鞘平均检出率为90%;两个品种茎尖均检测出2次阳性,检出率均为40%;茎部组织和蔗汁每次检测均为阳性,检出率均为100%。
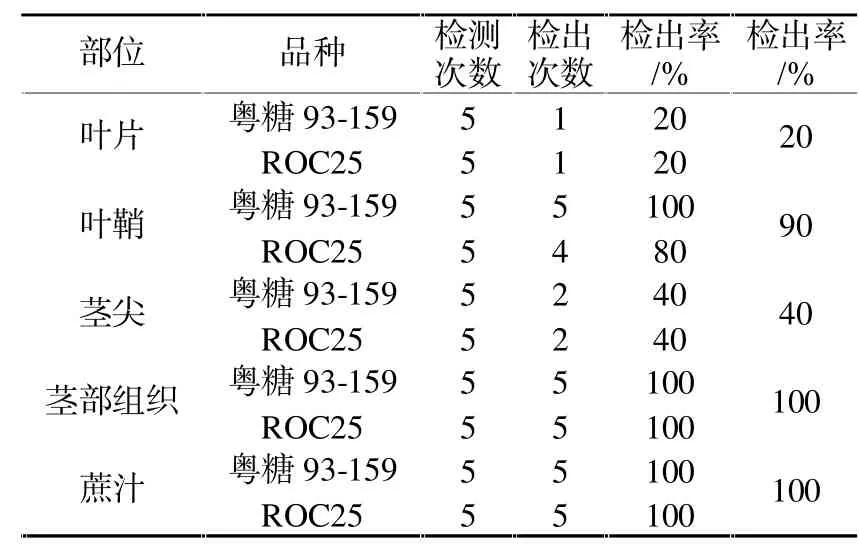
表1 甘蔗不同部位宿根矮化病菌PCR检测结果
3 结论与讨论
本研究使用常规PCR对甘蔗不同部位进行Lxx检测,检测结果表明甘蔗不同部位均可检测出Lxx。从检测的重复性来看,茎部组织最好,然后依次为叶鞘和茎尖,叶片检测的重复性最差。
赵婷婷等研究表明甘蔗不同时期的叶片和叶片的不同部位均可检出宿根矮化病,且差异不明显[6]。本文对国内2个主栽品种的常规PCR检测结果表明,使用叶片虽可以检测出宿根矮化病,但检测的稳定性却不好,是所测甘蔗部位中重复性最差的,5次重复检测仅有1次阳性,检出率仅为20%,这可能表明叶片是甘蔗所有部位中带菌量最少的部位。本研究使用的方法对于叶片检测重复性较差,下一步研究的重点将是改进检测方法,提高叶片检测RSD的稳定性。
沈万宽等发现甘蔗植株内Lxx的带菌量从茎基部至茎顶端逐步减少,基部维管束含菌量最大,往上逐渐减少,在叶鞘和叶片中含菌量最少,并且病原菌在甘蔗茎内主要分布于茎节下腊粉带对应的木质部中[7],本研究中茎部组织和蔗汁每次检测都呈阳性,这与Lxx主要集中在茎部维管束组织中有关。本研究使用的叶片和叶鞘取自同一片叶子,但二者Lxx的检出率却相差很大,这可能表明叶片和叶鞘的带菌量相差很大。
本研究所选用的两个甘蔗品种粤糖93-159和ROC25,其中粤糖93-159被认为是比较感RSD,而ROC25认为是比较抗RSD的,从检测结果来看,这两个品种各部位的检测结果没有明显的差异。本研究为今后使用甘蔗其它部位进行RSD检测提供了参考,在今后的RSD检测中,如果甘蔗茎秆榨汁困难可以使用茎部组织进行检测,在取茎秆困难的情况下可以使用叶鞘来检测,而叶片则不建议用来检测RSD。
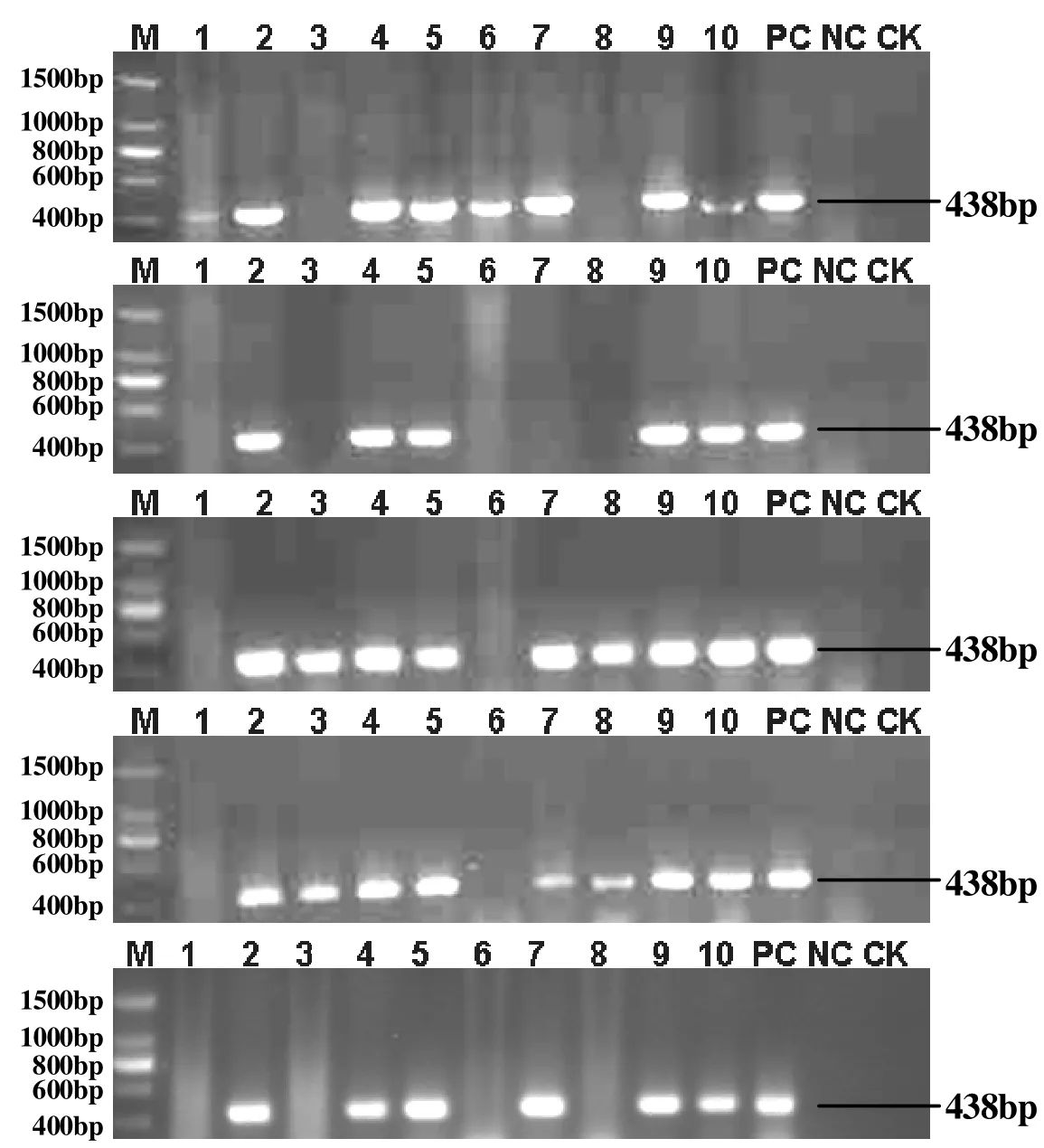
图1 两个甘蔗品种不同部位RSD的5次重复检测
[1]Davis MJ,Gillaspie AG,Harris RW,et al.Ratoon stunting disease of sugarcane:Isolation of the causal bacterium[J].Science,1980,210:1365-1367.
[2]James G.A review of ratoon stunting disease[J].International Sugar Journal,1996,98(1174):532-541.
[3]黄孟群,肖镇杰.广东甘蔗宿根矮化病调查报告[J].甘蔗糖业,1987(2):39-40.
[4]李文凤,卢文洁,黄应昆,等.甘蔗宿根矮化病菌PCR检测体系的优化与应用[J].云南农业大学学报,2011,26(5):598-601.
[5]Pan Y B,Grisham M P,Burner D M,et al.A polymerase chain reaction protocol for the detection of Clavibacter xyli subsp.Xyli,the causal bacterium of sugarcane ratoon stunting disease[J].Plant Disease,1998,82(3):285-290.
[6]赵婷婷,王俊刚,杨本鹏,等.甘蔗叶片宿根矮化病的PCR检测[J].热带作物学报,2011,32(5):870-873.
[7]沈万宽,周国辉,邓海华,等.甘蔗宿根矮化病菌PCR检测及目的片段核苷酸序列分析[J].中国农学通报,2006,22(12):413-416.
