上海地区391例早期自然流产绒毛细胞培养方法比较及核型分析
2013-09-10姚红霞郭茗骆敏周佳
姚红霞 郭茗 骆敏 周佳
(同济大学附属第一妇婴保健院 产前诊断中心,上海 200040)
国内绒毛染色体制备方法多采用直接法,该法所制备的染色体质量差,中期分裂相少,只能满足染色体计数的需要,无法进行满意的染色体结构分析。这也是目前国内早孕期产前诊断开展受到限制的重要原因之一。探讨早期自然流产绒毛细胞不同培养方法的优劣,以便更好地开展孕早期优生优育工作。
1 资料与方法
1.1 研究对象 2007年1月至2010年4月在本院门诊自然流产或胎停发育的患者,孕周6~11周,均为单胎妊娠,B超提示胚胎停止发育(无心管搏动、不能见到胚芽等),排除孕期感染及有害物质接触史。
1.2 标本采集 在人流手术过程中,无菌取出绒毛组织10~25mg,将绒毛组织置于无菌生理盐水小瓶内送检。
1.3 方法 运用直接法、贴壁培养法和消化培养法对早期自然流产绒毛细胞进行培养,以找出产前诊断中所适用的最佳方法。
1.3.1 直接法 把送检实验室的样品放于一次性培养皿中,挑出绒毛枝,洗去血块;将绒毛枝放于15ml尖底试管内,加入(0.4%氯化钾+0.4%枸橼酸钠)溶液5ml,EDTA-胰蛋白酶液0.05ml,秋水仙素(浓度为20μg/ml)20μl;在37℃水浴培养40分钟,每隔10分钟将标本悬浮一次;加入1ml固定液,离心10分钟,弃上清,加入5ml固定液,10分钟后吹打离心,换固定液一次,挑出绒毛枝后离心,滴片。
1.3.2 贴壁培养法 无菌条件下,用无菌生理盐水将绒毛洗净,去除红细胞及蜕膜组织,在解剖镜下观察,去除任何可疑的非绒毛组织,确认所接种的组织均为绒毛。在一次性平皿中用眼科手术剪剪成1~2mm3小枝或小块,移入25mm2培养瓶中分散于瓶的一边,于对侧瓶壁加入培养基,于37℃CO2培养箱中培养1~3小时待组织贴壁牢固后即可翻瓶,使组织块泡在培养液中。一般3~7天可见上皮样或成纤维样细胞生长。根据生长情况换液一次。一般培养6~20天,待细胞生长旺盛时,进行收获。
1.3.3 消化培养法 无菌条件下,用无菌生理盐水将绒毛洗净,去除红细胞及蜕膜组织,在解剖镜下观察,去除任何可疑的非绒毛组织,确认所接种的组织均为绒毛。在一次性平皿中用眼科手术剪将绒毛组织剪碎,放入装有30~50倍组织量的0.25%EDTA-胰蛋白酶液的离心管中,37℃下消化20~30分钟后加培养基终止消化,将离心管中的组织溶液离心,500rpm,5分钟。取上清离心,1500rpm,10分钟。去上清,加入培养基5ml,于37℃CO2培养箱中培养。当有贴壁细胞并形成多个克隆后即可收获。
1.4 收获和制片 采取培养法收获,即每个培养瓶中加入30μl秋水仙素细胞终止分裂液,37℃培养箱中作用4小时,将上面液体倒入试管内,瓶内加入胰酶消化液2ml把瓶壁上的细胞消化下来,加入1%枸橼酸钠KCI溶液4ml,37℃水浴中低渗20分钟,然后加入1ml 3∶1固定液 (甲醇3∶冰醋酸1)预固定2分钟,离心后去上清液,重新加入固定液4ml,20分钟,离心后去上清再加入4ml固定液10分钟。然后制片。显带染色同羊水细胞染色体制备,具体方法见参考文献[1]。
2 结 果
2.1 培养的391例绒毛样本中,2007年1月至2009年2月期间,用直接制片法59例,成功5例,占8.5%;2009年3月至2010年12月期间,用贴壁培养法进行细胞培养79例,培养成功35例占44%;2011年1月至2012年4月期间,用消化法进行细胞培养253例,培养成功119例占47%,见表1。直接制片法与消化贴壁培养法有非常显著的差异(P<0.01),直接制片法与消化培养法也有非常显著的差异(P<0.01),而贴壁法与消化法无显著差异(P>0.05)

表1 各种培养方法成功率比较
2.2 培养成功的159例绒毛中,常染色体和性染色体三体核型最多占比43.4%,三倍体核型占比6.29%;正常核型占比41.5%,异常核型检出率58.5%,见表2。
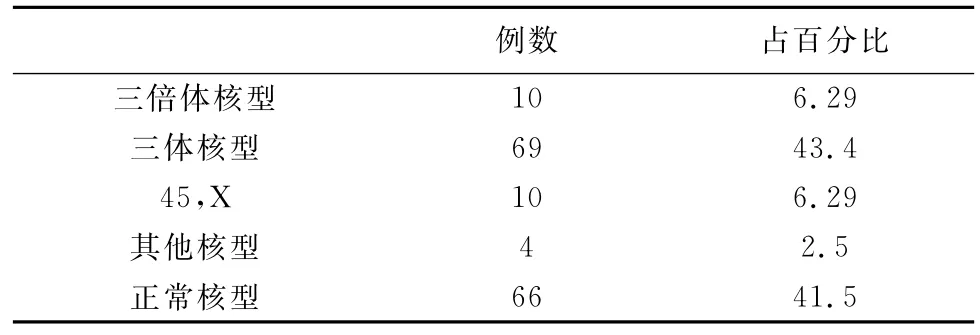
表2 159例培养成功流产绒毛的核型分析
3 讨 论
自然流产是妇产科的一种常见病,其发生率约占临床妊娠的10%~20%,且绝大多数发生于孕早期。诱发自然流产原因很多,涉及到遗传、免疫、解剖、感染、内分泌、血栓形成倾向甚至环境以及其他未知原因等[2]。导致妊娠早期自然流产或胚胎停止发育原因很多,其中胚胎染色体异常是早期流产最常见的原因[3]。自然流产是近年来发病率呈上升趋势的一种病因复杂的常见病,帮助自然流产夫妇找到疾病发生的原因,将能有效地指导孕妇成功妊娠并减轻其心理负担。
由于自然流产标本大多是胚胎停止发育后清宫取出的组织,细胞在体内已停止生长多日,培养失败率达10%~40%[4],笔者的实验也与之相符。
在进行无菌操作时,取材处理绒毛和培养中尤为关键,因而要求手术医生必须给予配合保持标本无菌,其次实验室人员要严格无菌操作。在我们培养失败的178例,其中167例为污染标本,疑为取材不当所致,11例为培养过程中污染。使培养成功率受到影响。
对自然流产的绒毛组织进行的核型分析能否成功取决于制备出的染色体质量。据观察,妊娠终止时间和从胚胎死亡到自然流产或清宫的间隔时间的长短对染色体质量有影响。早孕7~10周的绒毛细胞发育良好,11周以后,退变绒毛增多,致核分裂相减少,染色体形态不佳,增加了核型分析的难度。如果胚胎在母体内死亡时间较长或清宫较晚,则胚胎枯萎,绒毛细胞发生变性,培养成功率将降低。
长期培养法在国外已作为常规产前诊断手段,但国内实验室由于条件和技术的限制还不能常规开展。本实验室从2009年开始应用胰酶消化法处理绒毛组织后培养,培养成功率明显增加,绒毛细胞的培养周期亦明显缩短,在提高工作效率的同时,也减少了污染的机会,具有很大应用价值。
国内绒毛染色体制备多用直接法,此法制备的染色体质量差,中期分裂相少,只能满足染色体计数的需要,无法进行满意的染色体结构分析,因而无法满足产前诊断的需要,但该方法不易有母体细胞污染发生,且成本较低。而绒毛细胞贴壁培养法制备的染色体质量好,中期分裂相相对较多,能满足产前诊断的需要,但会有母体细胞污染存在,成本也较高。具体用哪种方法需要具体问题具体分析。
在159例成功培养的流产绒毛中,异常核型检出率58.5%,与国外有关文献报道相符[5,6]。胚胎染色体异常是早期自然流产的主要原因,在临床上对早期自然流产胚胎开展绒毛染色体检查有利于判断流产的原因,并达到针对性地指导优生优育的目的。
[1] 郝娜,戚庆伟,周京,等.早孕期绒毛细胞培养和染色体制备方法的应用研究[J].中国实用妇科与产科杂志,2006,22(11):839-840.
[2] Macklon NS,Garaedts JP,Fauser BC.Conception to ongoing pregnancy the‘black box’of early pregnancy loss[J].Hum Reprod,2002,8(4):333-343.
[3] 乐杰.妇产科学[M].北京:人民卫生出版社,2008.
[4] Lomax B,Tang S,Separovic E,et al.Comparative genomic hybridization in combination with flow cytometry improves results of cytogenetic analysis of spontaneous abortions[J].Am J Hum Genet,2000,66(5):1516-1521.
[5] Stern JJ, Dorfmann AD, Gutierrez-Najar AJ,et al.Frequency of abnormal karyotypes among abortuses from women with and without a history of recurrent spontaneous abortion[J].Fertil Steril.1996,65:250-253.
[6] Ogasawara M, Aoki K, Okada S,et al.Embryonic karyotype of abortuses in relation to the number of previous miscarriages[J].Fertil Steril,2000,73:300-304.
