不同林龄胡杨克隆繁殖根系分布特征及其构型
2013-09-07黄晶晶井家林曹德昌李景文夏延国
黄晶晶,井家林,曹德昌,张 楠,李景文,*,夏延国,吕 爽
(1.北京林业大学森林培育与保护教育部重点实验室,北京 100083;2.北京林业大学生物学院,北京 100083)
根系是植物摄取、运输和贮存碳水化合物和营养物质以及合成一系列有机化合物的器官[1],同时也是寻觅新的生境、繁殖的器官[2-3]。由于干旱区资源环境相对比较匮乏,干旱区植物根系在适应环境时形成了一定的适应机制,McCulley[4]研究干旱区深根系植物通过水分的再分配,对深层营养的提升作用。李修仓[5]在研究干旱区无性系芦苇[6]根系分布对水分的响应时发现:旱生芦苇根系深度达250 cm以上,毛细根分布最多区域在0—30 cm土层。曾凡江[7]在研究干旱区的骆驼刺根系时发现:水土条件较好时,水平根系分布广泛,产生根蘖苗获取资源;水土条件匮乏时,垂直根系分布发达。张大勇[8]研究认为植物的不同功能在其生活史中一般存在着权衡关系,干旱区植物根系在发育过程中也存在着多种功能的权衡。
胡杨(Populus euphratica)我国干旱荒漠地区唯一能够形成森林的乔木种[9]。近年来黑河上游下泄水量不足、地下水位的下降和人为的破坏[10-12],胡杨林退化严重[11-12]。由于有性繁殖失败[13-14],目前额济纳胡杨林主要依靠无性根蘖繁殖维持胡杨林的更新[15-16]。胡杨的生理特性及所处的生态环境与 Cottonwood[17]有很大的相似性[18],David[19-20]研究cottonwood(Populus deltoides)时发现,该物种的繁殖更新与该区域的水文动态节律关系密切。Rood[21]研究cottonwood根系构型时发现:根系分布的深浅受到水文动态节律和河流流量的影响,李建林[22]研究了极端干旱区胡杨吸水根系的分布,赵文智等[16]的研究表明胡杨的根蘖发生与水分关系密切,曹德昌[13,18]的研究表明胡杨根蘖和林窗特性、土壤特性以及深度有关。但这些主要是研究吸水根分布情况,根蘖数量和生长的影响,没有涉及胡杨根系不同功能如何权衡、根蘖如何发生的,与根系特征存在着怎样的关系等关键性问题。在研究中发现胡杨的根蘖和不定芽主要发生在位于土壤10—50 cm这部分根系上,而且与根系构型特征有密切的关系。基于此本文重点研究胡杨繁殖根系如何分布、根系构型成什么规律、根蘖产生和根系构型关系呈现出什么样的规律?以揭示胡杨根系在适应荒漠区环境的特殊适应机制。同时,这些问题的研究在胡杨林保护与维持方面具有重要理论与实践意义。
1 研究地概况和研究方法
1.1 研究地概况
研究地在黑河下游内蒙古额济纳旗地区,典型的大陆干旱气候,降雨稀少,蒸发强烈,温差很大,年平均降雨42 mm,年平均蒸发量为3755 mm,是降雨的89倍多。样地设在二道桥胡杨林保护区,地理坐标为:北纬41°58',东经101°03',平均海拔930 m,根据2006—2011年做的3块固定样地(100 m×100 m)胡杨林数据,选取两个50 m×50 m样地,调查样地的基本数据。
1.2 研究方法
1.2.1 基于根窗的根蘖数据测定
2011年5月份在两种样地中分别做5个根观察窗。首先,在二道桥两个样地中分别选取5株根蘖苗,以每个苗为中心进行挖取剖面,挖取一个长度为2 m,宽度为1 m,深度为60 cm的剖面,然后把玻璃贴在剖面上,固定四个角。其后,进行遮阳处理,玻璃面上搭盖一层遮阳布,坑的上面完全铺盖一层遮阳网。数据采集于根系平衡一两个月后进行。首先,在玻璃板上对照刻度尺用记号笔划出刻度,标记深度,萌蘖点位置;此后每隔一个星期,利用扫描仪(Canoscan LiDE 700F,Canon,janpan)扫描根窗上的图像,利用WinRHIZO 2009根分析软件(Regent struments Inc.,Quebec,Canada)
1.2.2 不同胡杨林龄根系构型和空间分布测定。
试验一:中龄林和成熟林的根系构型与根蘖研究。在包含中龄林和成熟林的样地中,以根蘖苗为参考中心,用铁铲挖取确定根系的走势,沿着根系走势(10 m范围内)挖出完整的根系。每个林龄生境做5个重复,在挖取时,尽量保持胡杨的根系构型空间位置,同时拍照,记录胡杨根系的不定芽的个数、一级侧根数、二级侧根数,分枝夹角。把取出的完整根系带回实验室清洗,然后利用Epson Twain Pro根系扫描仪对根系进行扫描,获取根系构型参数数据。
试验二:胡杨繁殖根系的空间构型分布的研究。根据以往胡杨根蘖的研究[12,14,15,18],挖取繁殖根系(在自然生长条件下,深度分布分为10—50 cm,可以产生萌蘖芽,并且根蘖芽最终可以长成根蘖的根系)。在两种林龄生境中分别选取5丛根蘖苗,以此为参照中心,挖长宽为100 cm×60 cm深度为90 cm的坑,10 cm一层取出根系,把挖出来的根系装入事先准备好的低温保温箱中,带回实验室清洗,利用Epson Twain Pro根系扫描仪对根系进行扫描,利用WinRHIZO 2009根分析软件(Regent struments Inc.,Quebec,Canada)分析提取数据。收获的数据包括:总根长(cm)、根平均直径(mm)、根表面积(cm2)、根总体积(cm3)、根分叉数、根尖点,平均分支角度,分形维数。按直径把根分为6个级别:1—4级从0 mm开始,每隔0.5 mm分一级,一直到2 mm,第5个径级为2—5 mm,第6个径级为5—20 mm,第7个径级为大于20 mm,对大于1cm根系数据直接利用游标卡尺和直尺进行测量。
1.2.3 根长密度,根表面积密度测量
根长密度 (RLD),RLD=L/V(L是根系长度,V为土壤体积);
根表面积密度(SAD),SAD=S/V(S是根系表面积,V是土壤的体积)。
1.2.4 土壤数据的测量
土壤的含水量和土壤可溶性盐测定,利用土壤测定仪(HH2 Moisture Meter&Wet Sensor WET-2,(精度±3)%,Delta-T Devices Ltd.,英国)测量含水量,土壤电导率,两者测量方法为:在每一层土层的4个角和中心处选取点。
利用Shapiro-Wilk和Levene检验对数据的正态性和方差齐次性进行检验,如果数据不满足此条件即对其进行一定的数据转换。方差分析对各根系形态(RLD、SAD),并对根系构型参数进行主成分分析,采用sigmaplot10.0进行图表绘制。
2 结果与分析
2.1.1 胡杨林样地基本特征
胡杨样地(1)的树木平均胸径为44 cm。林下主要有多枝柽柳(Tamarix ramosissima),苦豆子(Sophara alopecuroides),芨芨草(Achnaterum splendens),猪毛菜(Salsola collina),骆驼刺(Alhagi sparsifolia),黑果枸杞(Lycium ruthenicum Murr),蒲公英(Taraxacum mongolicum)。土壤有机质含量为0.548%。胡杨样地(2)的树木平均胸径为78 cm。林下主要有:多枝柽柳(Tamarix ramosissima),苦豆子(Sophara alopecuroides),猪毛菜(Salsola collina)。土壤有机质为0.380%。两种林型的主要干扰类型为:旅游,放牧。依据胡杨林龄和胸径的关系[14],用测量胡杨的胸径来表征胡杨林龄[23],把胡杨林样地划分为中龄林,成熟林龄。
2.1.2 胡杨根长密度垂直分布特征
根长密度(RLD)是单位土壤体积的根长,表征根系在某一土壤层的根长的多少。根长密度对根系吸水和营养物质影响较大[27]。研究结果显示(表1),在中龄林内,径级d<2 mm的根长密度在0—10 cm土层的根长密度最大,为0.3874 cm/cm3,显著高于其余各层(P<0.05);径级2—5 mm的根长密度在0—10 cm土层的根长密度最大,为0.0294 cm/cm3,显著高于其余各层(P<0.05);径级5—20 mm的根长密度在20—30 cm土层的根长密度最大,为0.0053 cm/cm3,显著高于其余各层(P<0.05);径级d>20 mm的根长密度在50—60 cm最大,为0.0061 cm/cm3,显著高于其余各层(P<0.05)。
在成熟林内,径级d<2mm的根长密度,在0—10cm土层的根长密度最大,为0.1407 cm/cm3,显著高于其余各层(P<0.05);径级2—5mm的根长密度,在50—60 cm土层的根长密度最大,为0.0158 cm/cm3,显著高于其余各层(P<0.05);径级5—20 mm的根长密度,在50—60 cm土层的根长密度最大,为0.0158 cm/cm3,显著高于其余各层(P<0.05);径级d>20mm在50—60 cm土层的根长密度最大为0.0060 cm/cm3显著高于其余各层(P<0.05)。
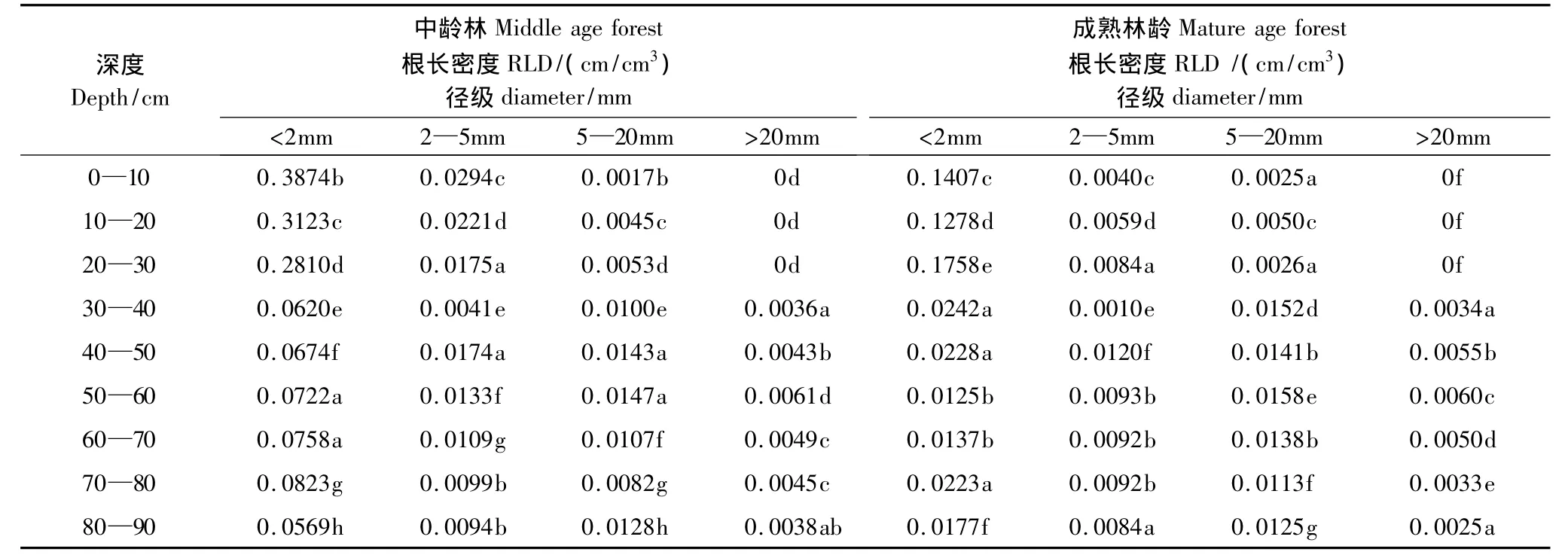
表1 不同林龄不同深度各个径级的根长密度的方差分析Table1 Analysis of variance of root length density influenced by forest age,soil depth,root diameter
2.1.3 胡杨根表面积密度垂直分布特征
根表面积密度(SAD)是单位土壤体积的根表面积。根系表面积密度是研究水分吸收或养分吸收的重要参数之一。研究结果显示(表2),在中龄林生境径级d<2 mm的根表面积密度,在0—10 cm为0.0791 cm2/cm3,显著大于其各层(P<0.05);径级2—5 mm的根表面积密度,在0—10 cm为0.0262 cm2/cm3,显著大于其各层(P<0.05);径级5—20 mm的根表面积密度,在60—70 cm为0.0484 cm2/cm3,显著大于其各层(P<0.05);径级d>20 mm的根表面积密度在50—60cm为0.0500 cm2/cm3,显著大于其各层(P<0.05)。
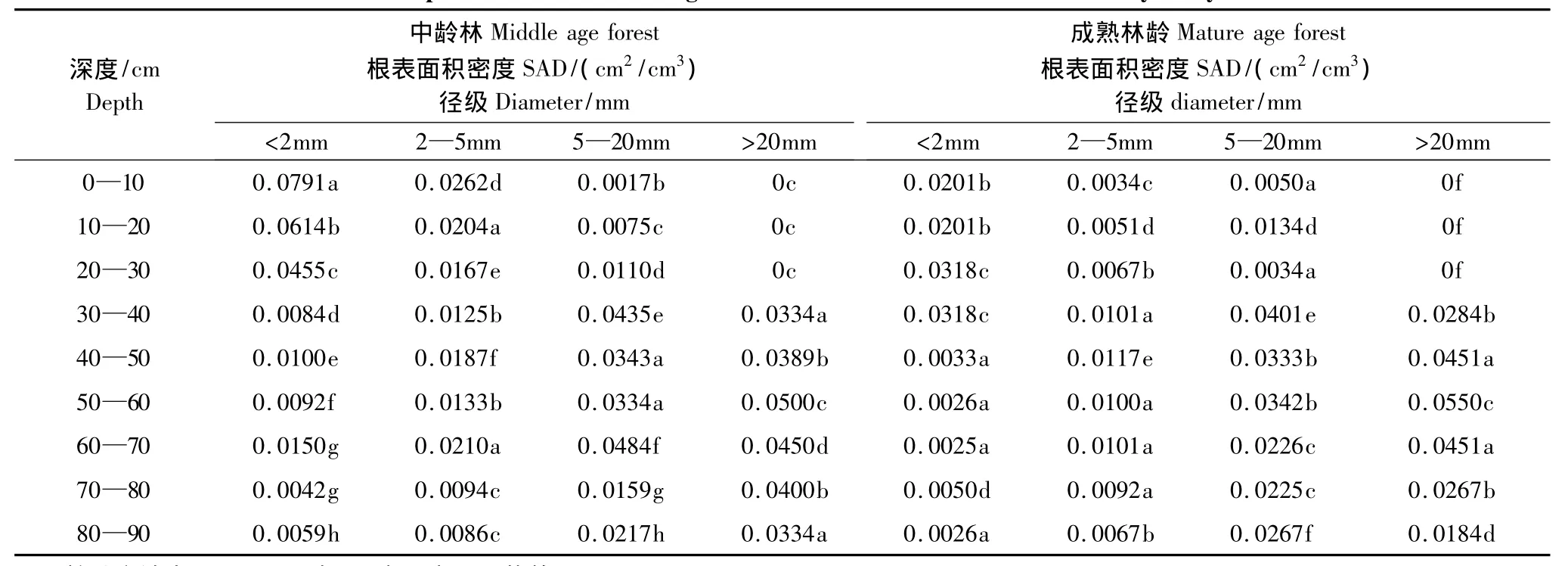
表2 不同林龄不同深度各个径级的根表面积密度的方差分析Table2 Different depths of different forest age diameter of the root surface area density analysis of variance
在成熟林生境径级d<2 mm的根表面积密度,在20—40 cm为0.0318 cm2/cm3,显著大于其各层(P<0.05);径级2—5 mm的根表面积密度,在40—50 cm为0.0117 cm2/cm3,显著大于其各层(P<0.05);径级5—20 mm的根表面积密度,在30—40 cm为0.0401 cm2/cm3,显著大于其各层(P<0.05);径级d>20 mm的根表面积密度,在50—60 cm为0.0550 cm2/cm3,显著大于其各层(P<0.05)。
图(1)、(2)显示,两种林龄根系密度,径级小于2 mm(吸水根系)的根长密度,随着深度的增加,根长密度呈降低的趋势;根表面积密度也是呈现出相同的规律。0—70 cm中龄林和成熟林根长密度分别占总根量的90%,92.8%,并且中龄林的每层土样根长密度都是要显著大于成熟林的(P<0.05);根表面积呈现出同样的规律,径级为2—5 mm中龄林根长密度是随着深度的增加,根长密度降低;中龄林根表面积密度呈现出同样的规律。成熟林的根长密度是随着深度的增加,先增加后降低;根表面积密度也是同样的规律。在30—40 cm土层,成熟林的根长密度显著大于中龄林的(P<0.05),中林龄的前30 cm土层根长密度显著大于成熟林的(P<0.05)。在0—30 cm,40—50 cm,60—70 cm土层,中林龄的根表面积密度显著大于成熟林的(P<0.05)。对于径级2—5 mm、>20 mm的两种林龄根系密度,其均呈现出先增加后降低的规律。
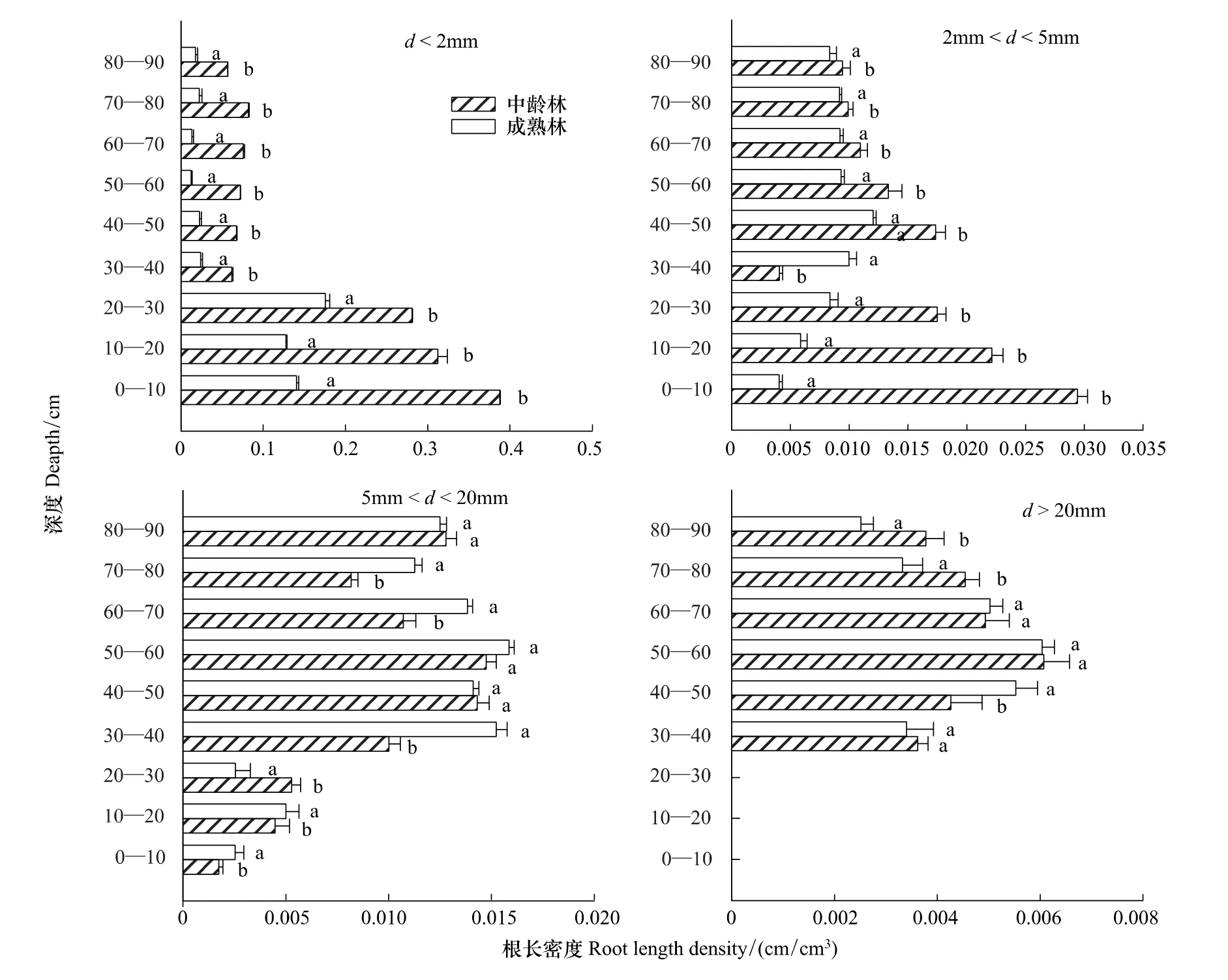
图1 两种林龄不同深度各径级的根长密度对比Fig.1 Two kinds of forest age at each diameter level root length density contrast in different depth
2.2.1 胡杨构型参数的主成分分析
根系构型是植物适应生态环境的外部形态表现形式。为了研究不同林龄生境根系构型参数,那些根系构型主成分因子,来反映胡杨繁殖根系生态适应策略。对根系构型的13个参数(主根轴长,根表面积,根体积,总根长,平均径级,根分枝数,根尖点,分形维数,平均分支角度,一级侧根数,一级侧根长,二级侧根数,二级侧根长度)进行了主成分分析,在中龄林生境中分析结果如表(3):根表面积、根分枝数、根分形维数,平均分枝角度4个参数是分析根系构型的主成分因子,其特征值分别为3.869、1.594、1.411,1.019,均大于1;根表面积、根分枝数、根分形维数,平均分枝角度4个参数的方差贡献率分别为42.91%、17.71%、15.68%,11.32%,累计方差贡献累为87.70%。成熟龄林生境数据分析结果如表(4):根体积、根分枝数,平均分枝3个参数是分析根系构型的主成分因子,其特征值分别为3.620、1.743,1.082,均大于1;根体积、根分枝数,平均分枝角度的方差贡献率分别为45.25%、21.78%,13.57%,累计方差贡献为80.60%。
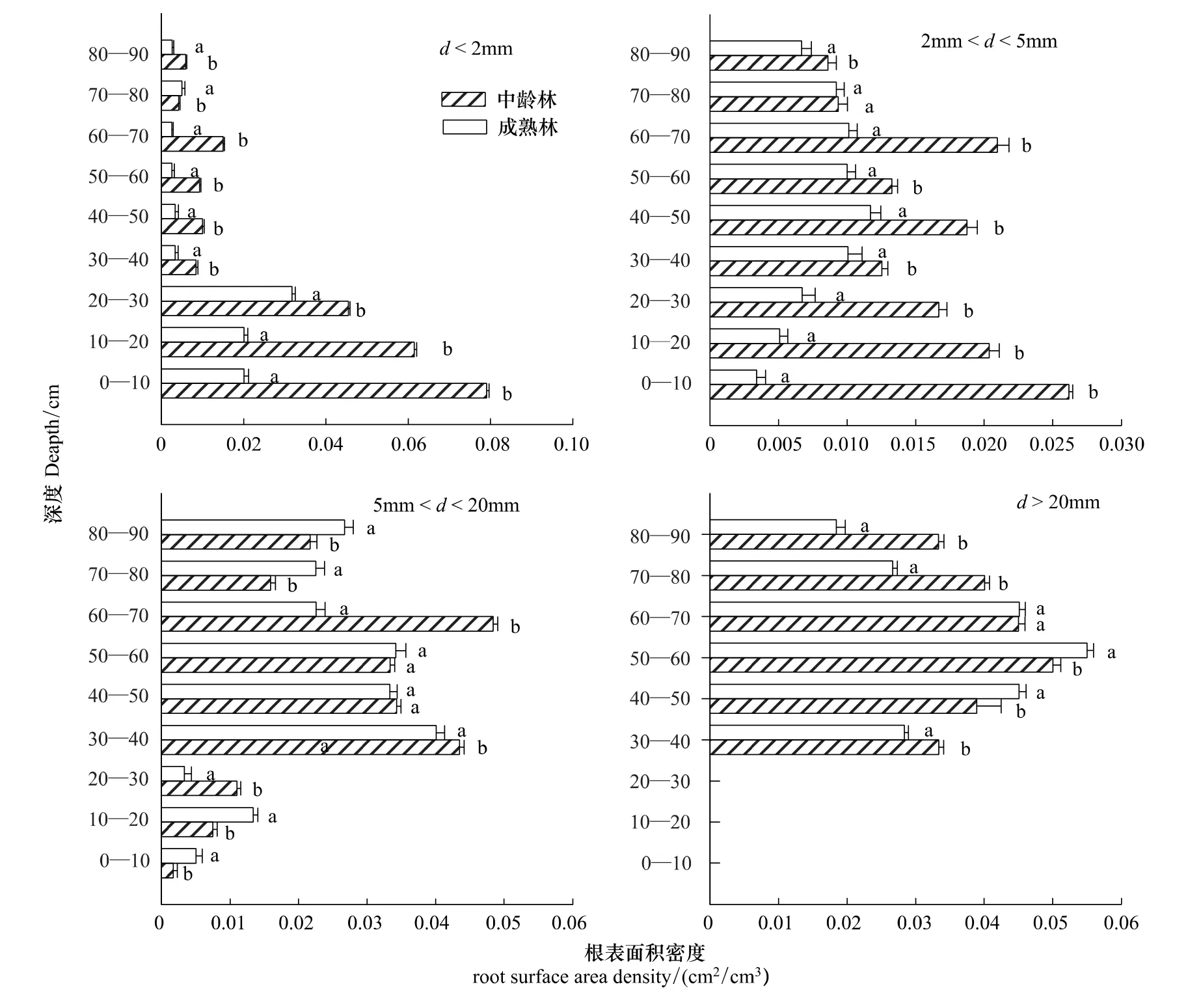
图2 两种林龄不同深度各径级的根表面积密度对比Fig.2 Two kinds of forest age at each diameter level root surface area density contrast in different depth
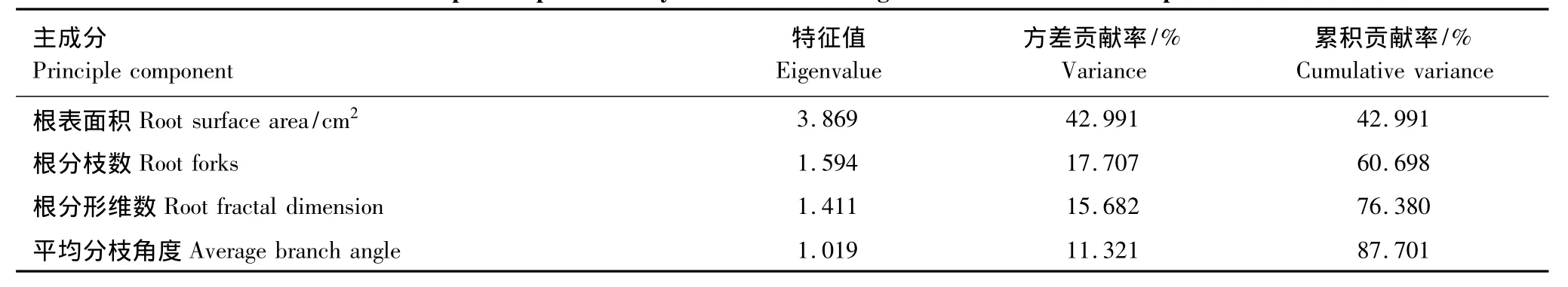
表3 中龄林根系构型参数主成分分析Table3 Principal component analysis on the Middle age forest root architecture parameters
为了研究在不同径级水平上,哪种径级对根系构型参数影响显著,对不同径级进行主成分分析。分析结果如表(4):在中龄林生境中1—2 mm这两个径级的根表面积特征值为4.794、1.021,均大于1;贡献率分别为79.15%,17.01%,,累积贡献率为96.16%。在成熟林生境1—2 mm这两个径级的根表体积特征值分别为3.902,1.162,均大与1;贡献率分别为65.08%,19.37%,累积贡献率为84.44%。由此,1—2 mm 2个级别径级是根表面积,根体积的主成分因子,即1—2 mm 2个级别的径级对根系构型影响显著。通常定义直径在2 mm以下的根为细根[24-26],因此得出胡杨细根对根系构型参数有重要的影响。
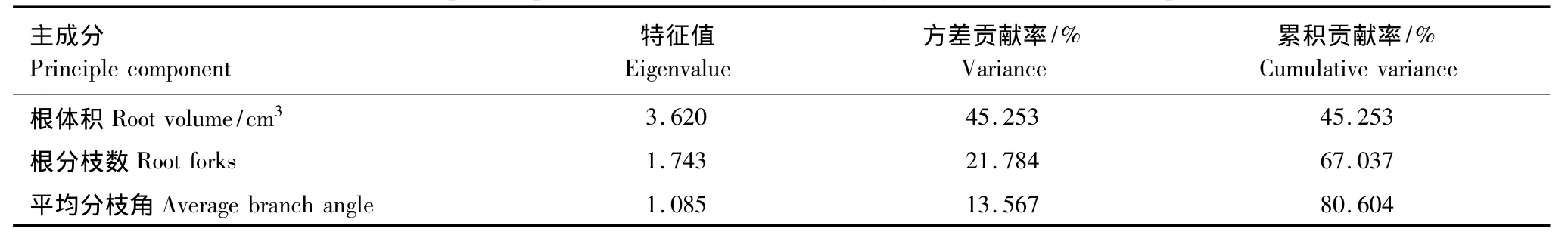
表4 成熟林根系构型参数主成分分析Table4 Principal component analysis on the Mature age forest root architecture parameters
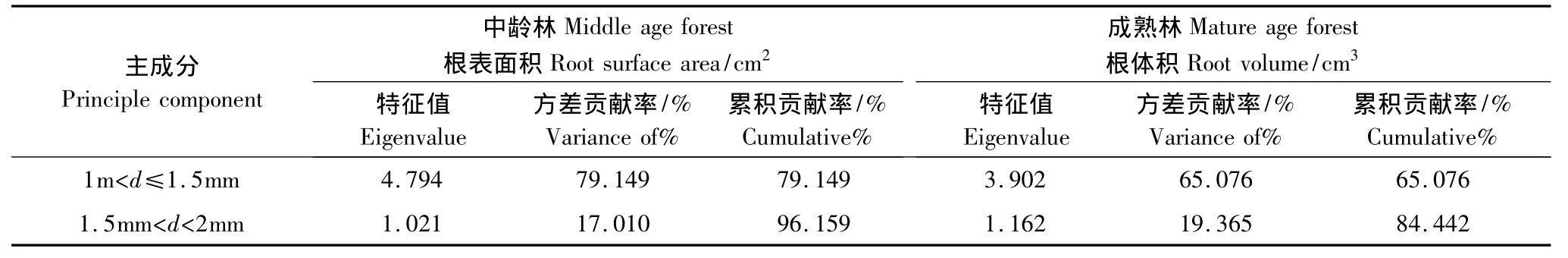
表5 各种径级下根表面积和根体积的主成分分析Table5 principal component analysis of different root diameter(d)level under the root surface area and root volume
2.2.2 两种林龄胡杨繁殖根系构型对根蘖的影响
采用Pregizer等根序的分级法[30],以独立出现萌蘖芽的侧根定义为一级根,将明显可见的具有一组独立侧根定义为二级根,数据分析显示,如表6,两种林龄的一级根上萌蘖芽的个数对比差异不显著(P<0.05),二级根上萌蘖芽的个数对比差异不显著(P<0.05)。中林龄的二级根萌蘖芽的个数是一级根萌蘖芽个数的3.24倍,成熟林的二级根萌蘖芽的个数是一级根萌蘖芽个数的3.36倍。两种林龄的一级侧根数,分枝角度在同一组对比差异不显著(P<0.05)。繁殖根系构型分析表明,繁殖根系产生不定芽,不定芽生长成根蘖差异不显著,可能是由生物学特性所决定原因。一级侧根数,和分枝角度是繁殖根系一种空间拓展能力的表征,与林龄是无关的。

表6 不同林龄胡杨根蘖,繁殖根系构型参数的方差分析Table6 Analysis of variance on root sucker,cloning root architecture parameters in different popular forest
2.2.3 基于根窗的胡杨根蘖的生长规律
根蘖苗横向和纵向生长速率是一个周期的平均生长长度。从图(3)可以看出,20 cm深度,中林龄的两种林龄纵向生长速率是成熟林的1.6倍;30 cm深度,成熟林的两种林龄纵向生长速率是中林龄的4倍;在40 cm深度,成熟林的两种林龄纵向生长速率是中林龄生境的17倍;50 cm深度,成熟林是中龄林的4倍;60 cm深度,成熟林的两种林龄纵向生长速率是中龄林的7倍。径向生长速率的对比,10 cm深度,成熟林是中龄林2倍,30 cm、40 cm深度成熟林是中龄林生境的2倍,50 cm深度成熟林是中龄林的4倍,60 cm深度成熟林生境是中龄林生境6倍.
2.3 土壤的水分和电导率的空间分布规律
表7中显示,中龄林生境中,80—90 cm土层的含水量最大,显著大于其余各层(P<0.05);成熟林生境中,80—90 cm土层的含水量最大,显著大于其他各层。中龄林生境土壤含水率变化规律为,随着深度的增加,含水率增加,并在40—50 cm处出现一个峰值;成熟林生境的含水率变化规律为,随着深度的增加,含水率增加。两种龄林在土深0—10 cm的含水率都是最低的,中龄林生境在40—50 cm处的含水率显著高于50—80 cm处的含水率,这可能由于胡杨根系对水力具有提升作用[28],造成该土层含水率增加。
中龄林生境在80—90 cm土深处,电导率显著大于其他各层(P<0.05);成熟林生境的电导率的最大值出现在0—10 cm处(P<0.05)。中龄林生境在40—90 cm处时,土壤的电导率很高,成熟林靠近0—40 cm处的土层表面的电导率很高。
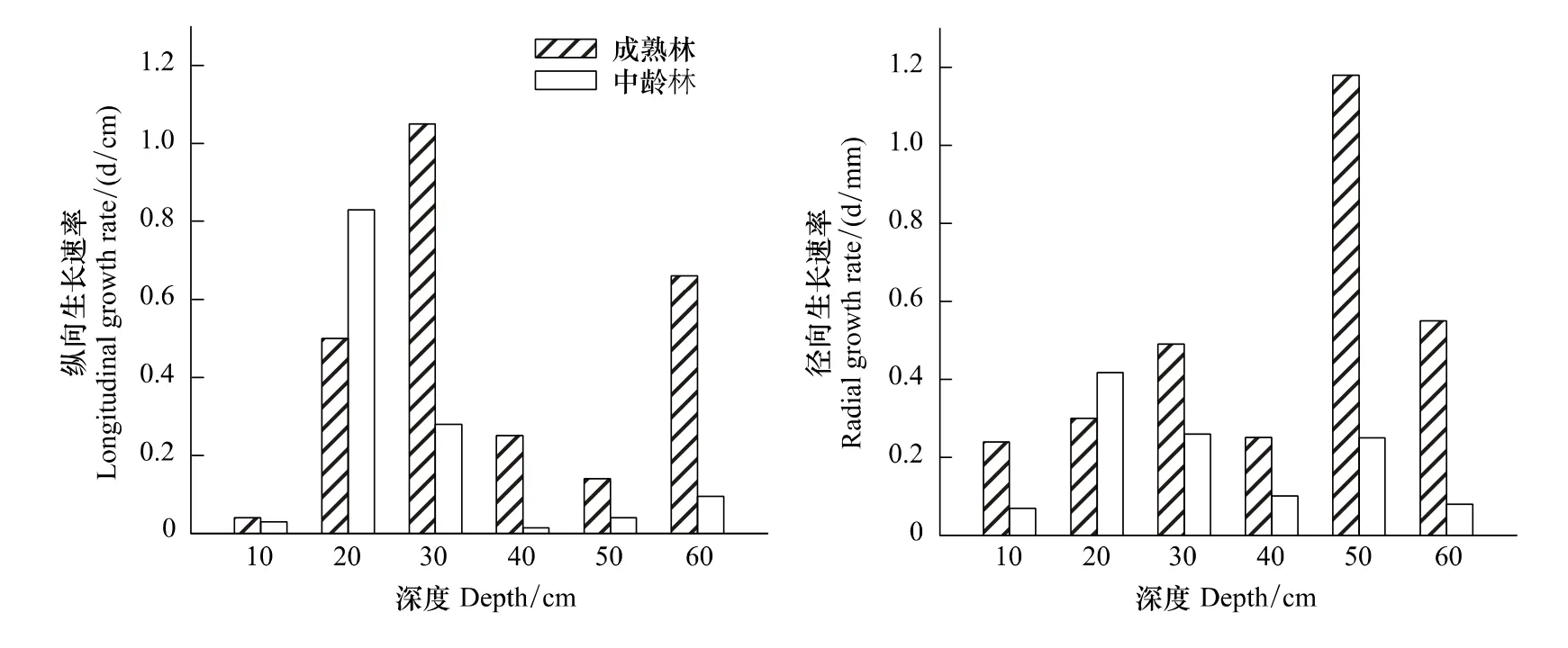
图3 两种林龄的根蘖苗生长速率对比Fig.3 Two kinds of forest age root sucker growth rate contrast
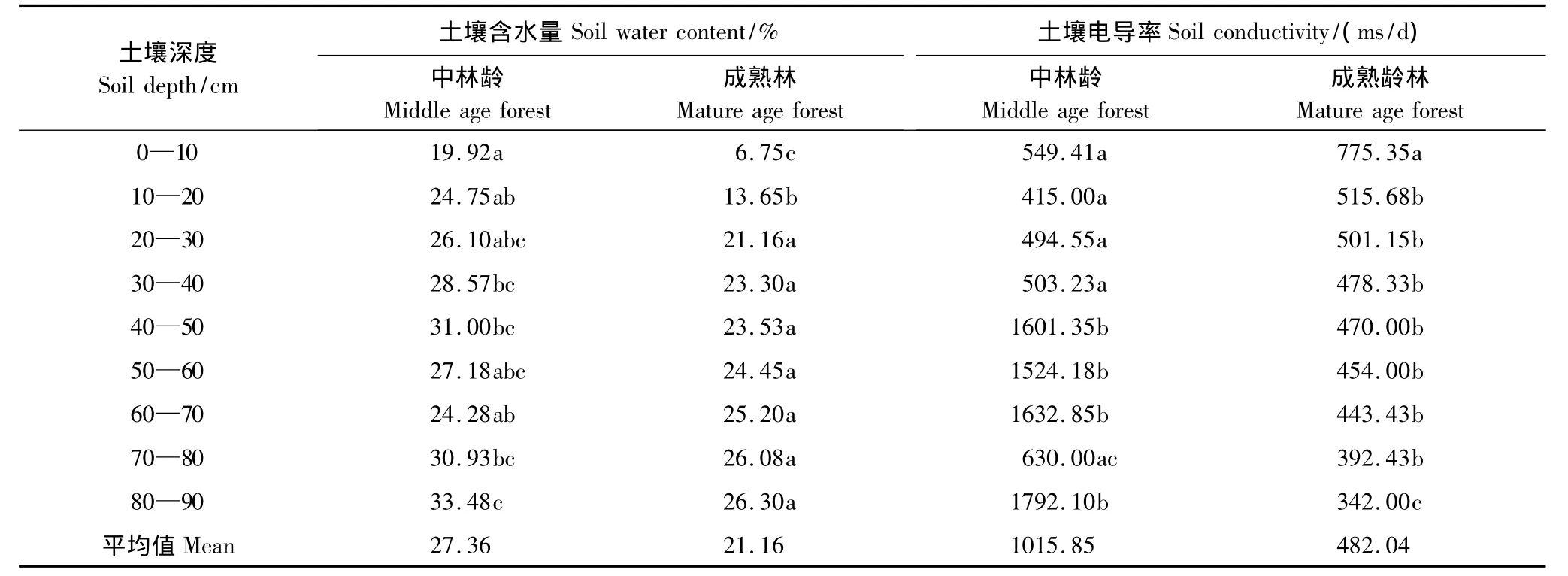
表7 不同生境中各土层深度土壤含水量和土壤电导率平均值比较Table7 Average value of the soil depth,soil moisture and soil electrical conductivity in different habitats
3 讨论与结论
3.1 胡杨繁殖根系分布特征
研究表明,杨树根系密度的垂直规律为随深度呈现出递减趋势[29]。本研究显示,两种林龄细根(d<2 mm)分布规律呈现为随着深度增加,根长密度和根表面积密度先降低、再略有上升的趋势。叶茂[30]等在研究塔里木河胡杨根系时发现,前30 cm无细根的分布;杨丽[31]研究额济纳胡杨林根系得出,细根的根长密度是呈现出指数函数的分布,这些和本研究的结论均一致。亦有研究表明,表层土壤含水能力较差时会引导根系向深处生长来需找水资源[32]。本试验表明:在40 cm以上的土壤深度处,胡杨细根的根长密度随深度增加略微增加,原因可能是土壤的含水率随深度的增加而呈现出增加趋势(如表7),在极端干旱的环境条件下,根系为了寻找水源,增加根长密度。
对于两种林龄的细根(d<2 mm)的根长密度、根表面积对比,中龄林都是显著大于成熟林(P<0.05)的(图3),原因为:一方面,可能在于不同林龄生境的土壤环境因素(表7);另一方面,这可能由于植物学特性、林龄的差异所造成。有研究表明,根长密度随林龄的增加而增加[33],而本试验结果却得到相反的结果,这可能由于中龄林的根系活力比成熟林的根系活力要强,中龄林根系为了扩张更大空间、寻找资源;相对而言,成熟林具有较为稳定的根系空间布局,需要生长更多的吸水根来满足植物的生长和发育。
对于径级2 mm<d<5 mm的根长密度、根表面积对比,数据显示:成熟林根长密度在30—40 cm处,以上指标是显著大于中龄林的,其余各层都是中龄林的以上指标显著大于成熟林的(P<0.05)。对于根表面积的对比,只有在70—80 cm土层处,中龄林生境和成熟林生境的差异不显著(P<0.05),其余各层差异显著。对于径级为5 mm<d<20 mm的两种林龄的根长密度和根表面积密度对比,成熟林的根长密度在0—10 cm、30—40 cm,70—80 cm三层显著大于中龄林的对应指标(P<0.05)。成熟林根表面积密度在0—20 cm、80—90 cm两层是显著大于中龄林的(P<0.05)。对于径级d>20 mm的两种林龄的根长密度、根表面积密度对比,成熟林根长密度在40—50 cm土层处,显著大于中龄林的对应指标(P<0.05),成熟林根表面积密度在40—60 cm土层处显著大于中龄林的(P<0.05)。由此得到:成熟林的中等粗根(5 mm<d<20 mm)和粗根(20 mm<d)在深层和中浅层分布较多,这与胡杨是一种水平根系很发达的浅根系物种有关[34]。中等粗根分布在深层土壤是为了运输吸水根从深处吸收的营养物质和水分,粗根在中浅层分布则起到支撑固定和延伸作用,当遇到风沙、干旱等时节,能起到保证物种生存的重要作用。胡杨根系在生长过程受外界环境如水分、营养元素诱导,不断延伸寻找优质斑块,条件适宜时产生大量各种径级的根系来满足不同功能需要,例如有的根系在于固着、适应水分过程,吸收营养物质,有的根系可能更着重于寻觅新的生境、繁殖。
3.2 胡杨繁殖根系的构型特征
3.2.1 两种林龄胡杨根蘖与繁殖根系构型的关系
武逢平[12]研究胡杨在额济纳绿洲3种生境内的根蘖繁殖特性,发现不同生境类型根蘖苗生长情况不一样,曹德昌[18]研究不同林隙胡杨根蘖的发生特征,发现根蘖的发生与环境因子的相关性不显著,提出了根蘖发生机制的随机性与环境资源异质性的假说。本研究表明,两种林龄繁殖根系产生不定芽,同组对比差异不显著的。两种林龄的一级侧根数,和分枝角度同组对比差异不显著。从根系构型对根蘖影响来看,影响并不显著。不同根系构型上的不定芽的试验数据显示,两种林龄的二级根上萌蘖芽个数是一级根上萌蘖芽个数的3—4倍,与林龄无关,而是由生物学特性决定的,可能与根系激素的极性运输有关[35-36]。
3.2.2 不同林龄胡杨根蘖生长规律分析
基于根观察窗试验发现,两种林龄胡杨在不同深度都有根蘖苗产生,表现为:由自身生物学特性决定的随机性[11]。两种林龄生境不同深度的根蘖苗生长速率不一样,只有在20 cm深度处,中龄林根蘖苗生长速率是大于中龄林生境的,在其他深度处都是成熟林龄林大于中龄林生境的。其中原因一方面可能是由生物学特性决定,即成熟林繁殖能力要强于中龄林;另一方面,亦可能在于克隆植物对资源异质性的分配发生了“趋富特化”,即将相对多的生物量投向吸收丰富资源的器官和部分[37]。成熟林的胡杨通过克隆根系来为资源相对中龄林比较匮乏的繁殖根系输送营养物质供给根蘖苗生长,以消除这种由于资源异质性所带来的不利条件。
3.2.3 胡杨繁殖根系构型特点
根表面积、根体积、根分枝数、根分形维数,平均分枝角度5个参数是分析根系构型的主成分因子。中龄林生境中,根表面积、根分枝数、根分形维数,平均分枝角度4个参数是分析根系构型的主成分因子,成熟龄林生境数据结果为:根体积、根分枝数、平均分枝角度。中林龄胡杨根系是通过根表面积来高效率利用营养和水分资源,拓展根系空间分布格局,并造成根分枝数变多、分形维数变大、根系分枝程度和分生能力变强、分枝角度变大、根系侧根趋于水平生长,以增强根的觅食能力[38]。成为成熟林后,空间结构相对稳定,根系空间格局相对已经成型,根系分形维数就不再是构型参数的主成分因子,根系表面积亦被根系体积所代替。胡杨的生活史也是靠根系构型阶段性调整来适应周围的生态环境,根系构型参数亦处于阶段性的变化中。
细根在养分和水分吸收[39]、土壤养分周转[40]及生态系统生产力等方面发挥着重要作用,且细根能分泌多种物质,包括无机和有机成分,并具有化学他感作用[41]。根系直径在1—2 mm各个径级,对根系表面积和根体积影响极其显著,即细根(d<2 mm)的对胡杨繁殖根系构型影响比较显著。细根对根系构型参数解释越强,说明细根对根系构型影响越强。
3.2.4 胡杨繁殖根系分布及构型对土壤的适应机制
两种林龄的含水率对比,中龄林每层都是要大于成熟林的,这可以从两种林龄的根长密度和根表面积密度的对比图看出,中林龄的细根在每层都是要显著大于成熟林(P<0.05),表明细根对水分的响应比较敏感。在0—60 cm深度,中龄林与成熟林同层含水率对比,中龄林都是要大于成熟林。但是两种林龄的胡杨不同根系构型上萌蘖芽对比差异不显著,两种林龄的分枝角度,一级侧根数同组对比差异不显著(P<0.05)。表明在极端环境下,只要是满足生长繁殖的最低条件,胡杨繁殖根系会高效率利用有限资源,来完成繁殖、拓展功能。
4 结论
胡杨根系细根对水分和营养物质的响应比较敏感,在表层能大量分布、占据空间,为繁殖根系的繁育做铺垫。中等粗根(5 mm<d<20 mm)和粗根(d>20 mm)在深层分布,分别在水平和垂直方向上拓展空间,起到支撑和运输水分营养物质和繁殖的功能。
胡杨繁殖根系产生根蘖,受到水盐阈值的控制,主要还是由生物学特性决定,只要能满足生理的最低要求,胡杨根蘖就可以通过根系构型差异所决定的根系分布来消除极端环境带来的不利条件,并繁衍后代、拓展本物种的分布。
在极端干旱环境下,胡杨细根在其根系功能权衡中扮演着重要角色。在极端干旱区退化的胡杨林内由于地下水位下降,无法生长表层细根、无法形成根蘖。只有当地下水位提高、并满足表层根系生长后,胡杨根蘖才能成功繁殖。
[1] Zhang X Q,Wu K H,Dieter Murach.A review of methods for fine-root production and turnover of trees.Acta Ecologica Sinia,2000,20(5):875-883.
[2] Cook R E.Clonal plant populations.American Scientist,1983,71:244-253.
[3] Dong M.Plant Clonal Growth in Heterogeneous Habitats:Risk-spreading.Acta Phytoecologica Sinica,1996,20(6):543-548.
[4] McCulley R L,Jobbágy E G,Pockman W T,Jackson R B.Nutrient uptake as a contributing explanation for deep rooting in arid and semi-arid ecosystems,Oecologia,2004,141:620-628.
[5] Li X C,Hu Sj,Li Y T,Li X M.Study on the root distribution and soil water dynamics under Phragmites arid area.Acta Prataculturae Sinica,2008,17(2),97-101.
[6] Chambers R M,Mcyerson L A,Saltonatall K.Expansion of Phragmites australis into tidal wetlands of north America.Aquatic Botany,1999,64(3/4):261-273.
[7] Zeng F J,Guo H F,Liu B,Zeng J,Zhang X L.Response of Ecological Properties of Roots of Alhagi sparsifolia SHAP.Seedlings to Different Irrigation Treatments.Arid Zone Research,2009,26(6),853-857.
[8] Zhang D Y.Plant Reproductive Ecology and Life History Evolution.Beijing:SciencePress,2004
[9] Liu Z L,Zhu Z Y,Hao D Y.The Study of Oasis Ecosystem Damage and Conservation in the lower Reaches of Black River(Erginar River).Journal of Arid Land Resources and Environment,2001,15(3):1-8.
[10] Wang SJ,Chen B H,Li H Q.Populus euphratica forest.Beijing:ChinaEnvironmental SciencePress,1995.
[11] Gao RH,Dong Z,Zhang H,Li J Q.Study on regeneration process and biodiversity characteristic of Populus euphratica community in the Ejina Natural Reserve,Inner Mongolia of China.Acta Ecologica Sinica,2005,25(5):1019-1025.
[12] Wu F P,Li JQ,Li JW,Cheng C L,Wang X H.The charactertics of root suckers of Populus euphratica Oliv.in three habitats of Ejina oasis,2008,28(10):4704-4708.
[13] HAO P,ZHANGN,LIU Q W,L IJW.The Effects of Water and Soil Types on the Seed Germination and Seedling Survival of Populuseuphratica in Arid Region in China.Eurasian J.For.Res,2012,15(1):9-17.
[14] Cao D C,LI J W,HUANG ZH Y,Baskin CC,Baskin JM,HAO P,ZHOU WL,Li JQ.Reproductive Cha racteristics of a Populus euphratica Population and Prospects for Its Restoration in China.Plos one,2012,7(7),e39121.
[15] Zhang Y B,Li J W,Zhang H,Li J Q,Wu P,Zhao J.Analysis on the Factors Cause the Failure of Populus euphratica Sextual Regeneration in Nature.Science Technology and Engineer,2005,5(8):467-472.
[16] Zhao W Z,Chang X L,Li QY.Artificial water diversion effects of Heihe River on Populus euphratica Oliv.desert riparian forests in Ejina.Acta Ecologica Sinia,2005,25(8):1987-1993.
[17] Stewart B R,Louise P M.Big old cottonwoods.Canadian Journal of Botan,2003,81(7):764-767.
[18] Cao D C,Li JW,Chen WQ.Development and growth of root suckers of Populus euphratica in different forest gaps in Ejina Oasis.Acta Ecologica Sinia,2009,29(4):1954-1961.
[19] Lytle D A,Poff N L.Adaptation to natural flow regimes.Trends in Ecology& Evolution,2004,19(2):94-100.
[20] Lytle D A,Merritt D M.Hydrologic regimes riparian forests:a structured population model for cottonwood.Ecology,2004,85(9):2493-2503.
[21] Rood S B,Bigelow S G,Hall A A.Root architecture of riparian trees:river cut-banks provide natural hydraulic excavation,revealing that cottonwoods are facultative phreatophytes.Trees,2011,25:907-917.
[22] Li J L,Feng Q,Si J H.Distribution of uptake roots of Populus euphratica Oliv in extreme arid region,Arid Land Geography.2008,31(1):98-100.
[23] Sun H X,Yao Y F.Study on Technology of Diversiform-leaved Poplar Forest Regeneration and Restoration of Ejina Oasis.2000,14(5):70-73.
[24] Dusserre J,Audebert A,Radanielson A,Chopart J L.Towards a simple generic model for upland rice root length density estimation from root intersections on soil profile,Plant and Soil,2009,25:277-288.
[25] Vogt K A,Grier C C,Meier G E,Keyes M R.Organic matter and nutrient dynamics in forest floors of young and mature Abies amabils stands in Western Washington,as affected by fine-root input.Ecological Monographys,1983,53(2):139-157.
[26] Van Praag H J,Sougnez-Remy S,Weissen F,et al.Root turnover in a beech and a spruce stand of the Belgian Ardennes.Plant and Soil,1988,105:87-103
[27] Pregitzer K S,Deforest J L,Burton A J,Allen M F,Ruess R W,Hendrick R L.Fine root architecture of nine North American trees.Ecological Monographs,2002,72:293-309.
[28] Hao X P,Chen Y N,Li W H,Guo B,Zhao R F.Evidence and ecological effects of hydrAaulic lift in Populus euphratica.Chinese Journal of Plant Ecology,2009,33(6):1125-1131.
[29] Douglas G B,McIvor I R,Potter JF,Foote L G.Root distribution of poplar at varying densities on pastoral hill country.Plant and Soil,2010,333:147-161.
[30] Ye M,Xu,H L,Wang X F,Shen R X.Spatial Distribution Characteristics of Root System of Populus euphratica in the Algan Transection of the Lower Tarim River.Acta Botanica Boreali-Occidentalia Sinica,2011,31(4):0801-0807.
[31] Yang L,Zhang QL,Chang JB.Spatial dictribution characteristics of roots of populus euphratica.Journal of Inner Mongolia Agricultural University(Natural Science Edition),2006,27(1):15-17.
[32] Bakker M R,Augusto L,Achat D L.Fine root distribution of trees and understory in mature stands of maritime pine(Pinus pinaster)on dry and humid sites.Plant and Soil,2006,286:37-51.
[33] Wang SW,Pan CD,Root system spatial distribution of different aged Armeniaca vulgaris cv.Luntaibaixing in arid oasis under irrigation.Chinese Journal of Applied Ecology,2012,23(9):2353-2360.
[34] Wang Y B,Nurbay Abdusalih,Niels Thevs.Chinese Journal of Ecology,2007,26(12):1937-1941.
[35] Mc Steen P,Leyser O.Shoot branching.Annu.Rev.Plant Biol,2005,56:353-374.
[36] Palme K,Gälweiler L.PIN-pointing the molecular basis of auxin transport.Current Opinion in Plant Biology,1999,2(5):339-425.
[37] Chen JS,Dong M,Yu Dan,Liu Q.Intraclonal spatial division of labour in two stoloniferous plants with different branching type in response to reciprocal patchiness of resources.Acta Ecologica Sinica,2004,24(5):920-924.
[38] Dong M.Clonal growth in plants in relation to resource heterogeneity:foraging behavior.Acta Botanica Sinica,1996,38(10):828-835.
[39] Cronan C S.Belowground biomass,production,and carbon cycling in mature Norway spruce,Maine,U.S.A.Canadian Journal of Forest Research,2003,33(2):339-350.
[40] Bakker M R,George E,Turpault M P,Zhang JL,Zeller B.Impact of Douglas-fir and Scots pine seedlings on plagioclase weathering under acidic conditions.Plant and Soil,2004,266:247-259.
[41] SimthW H.Character and significance of forest tree root exduates.Ecology,1976,57:324-331.
参考文献:
[1] 张小全,吴可红,Dieter Murach.树木细根生产与周转研究方法评述.生态学报,2000,20(5):875-883.
[3] 董鸣.异质性生境中的植物克隆生长:风险分摊.植物生态学报,1996,20(6):543-548.
[5] 李修仓,胡顺军,李岳坦,李雪梅.干旱区旱生芦苇根系分布及土壤水分动态.草业学报,2008,17(2):97-101.
[7] 曾凡江,郭海峰,刘波,曾杰,张晓蕾.疏叶骆驼刺幼苗根系生态学特性对水分处理的响应.干旱区研究,2009,26(6):853-857.
[8] 张大勇.植物生活史进化与繁殖生态学.北京:科学出版社,2004.
[9] 王世绩,陈炳浩,李护群.胡杨林.北京:中国环境科学出版社,1995.
[10] 刘钟龄,朱宗元,郝敦元.黑河(额济纳河)下游绿洲生态系统受损与生态保育对策的思考.干旱区资源与环境,2001,15(3):1-8.
[11] 高润宏,董智,张昊,李俊清.额济纳绿洲胡杨林更新及群落生物多样性动态.生态学报,2005,25(5):1019-1025.
[12] 武逢平,李俊清,李景文,程春龙,王旭航 胡杨(Populus euphratica)在额济纳绿洲三种生境内的根蘖繁殖特性.生态学报,2008,28(10):4703-4709.
[15] 张玉波,李景文,张昊,李俊清,乌平,赵健.额济纳胡杨有性繁殖失败因素分析.科学技术与工程,2005,5(8):467-472.
[16] 赵文智,常学礼,李秋艳.人工调水对额济纳胡杨荒漠河岸林繁殖的影响.生态学报,2005,25(8):1987-1993.
[18] 曹德昌,李景文,陈维强,彭程,李俊清.额济纳绿洲不同林隙胡杨根蘖的发生特征.生态学报,2009,29(4):1954-1961.
[22] 李建林,冯起,司建华.极端干旱区胡杨吸水根系的分布与模拟研究.干旱区研究,2008,31(1):98-100.
[23] 孙洪祥,姚云峰.额济纳绿洲胡杨林更新复壮技术研究.干旱区资源与环境,2000,(Z1):70-73.
[28] 郝兴明,陈亚宁,李卫红,郭斌,赵锐锋.胡杨根系水力提升作用的证据及其生态学意义.植物生态学报,2009,33(6):1125-1131.
[30] 叶茂,徐海量,王晓峰,申瑞新.塔里木河下游阿拉干断面胡杨根系空间分布规律研究.西北植物学报,2011,31(4):0801-0807.
[31] 杨丽,张秋良,常金宝.胡杨树根系空间分布特性.内蒙古农业大学学报(自然科学版),2006,27(1):15-17.
[33] 王世伟,潘存德.干旱区绿洲灌溉条件下不同树龄轮台白杏根系空间分布.应用生态学报,2012,23(9):2353-2360.
[34] 王永斌,努尔巴依·阿布都沙力克,Niels Thevs.胡杨(Populus euphratica Oliv.)根繁殖特征.生态学杂志,2007,26(12):1937-1941
[37] 陈劲松,董鸣,于丹,刘庆.资源交互斑块性生境中两种不同分枝型匍匐茎植物的克隆内分工.生态学报,2004,24(5):920-924.
[38] 董鸣.资源异质性环境中的植物克隆生长:觅食行为.植物学报,1996,38(10):828-835.
