液相色谱串联质谱法测定猪尿中9种β-受体激动剂残留
2013-09-07黄艳梅黄卓焕冯荣华李东霞赖卫华
黄艳梅 黄卓焕 冯荣华 李东霞 赖卫华
(1.南昌大学食品科学与技术国家重点实验室,江西 南昌 330047;2.江西省农产品质量安全检测中心,江西 南昌 330077)
β-受体激动剂俗称“瘦肉精”,属于苯乙胺类药物(PEAs)[1],因能与动物机体内绝大多数组织细胞膜上的β受体结合而得名,因能够调节交感神经系统兴奋、松弛气管平滑肌及促使体内营养素重新分配,有一定的药用价值,常作为治疗哮喘的药物[2]。另外,因β-受体激动剂具有使能量再分配、减少脂肪沉积、增加酮体瘦肉率、以及促进动物生长的作用,使得近年来β-受体激动剂滥用于畜产品养殖中。若人类摄入量过大,会出现毒副作用,如肌肉振颤、心慌、战栗、头疼、恶心、呕吐等不良反应症状,特别是对高血压、心脏病、甲亢和前列腺肥大等疾病患者危害更大,严重的可导致死亡[3]。为了防止β-受体激动进入人类的食物链,欧盟颁布规定禁止在畜牧生产中使用该类药物作为生长促进剂[4]。中国农业部、卫生部、国家药品监督管理局联合于2002年发布《禁止在饲料和动物饮用水中使用的药物品种目录》,将部分β-受体激动剂列入其中[5]。
目前检测β-受体激动剂的方法主要有两种:① 快速筛查技术:主要有酶联免疫技术[6-8]和免疫层析技术[9],前者检验特异性强、试验结果较为准确、试验重复性强;后者操作简单且可现场快速检测。快速筛查法一般只用于β-受体激动剂半定量或定性检测,且多残留定量分析受限,检测结果可能会出现假阳性。因此,必须通过仪器确证后方能作为监管部门的执法依据。② 确证分析技术,包括气相色谱-串联 质谱法[10]和 液 相 色 谱 - 串 联 质 谱 法[1,11,12]。色 谱 - 串 联质谱法,可同时对多种β-受体激动剂定性,检测结果精确、灵敏度高,结果可靠且为国际所公认的执法依据[4]。
检测动物组织或代谢物中β-受体激动剂的多残留,对食品安全的评价及监控具有重要的意义。β-受体激动剂经动物体内代谢后主要以原尿及其代谢物形式排出,检测动物尿液中β-受体激动剂多残留的含量显得更直接、方便、全面,可实现宰前检测。中国农业部1025号公告-11-2008[13]规定了猪尿中西马特罗、沙丁胺醇、克伦特罗、莱克多巴胺4种β-受体激动剂单个或混合物残留量的液质检测方法,但β-受体激动剂的种类繁多、性质差异较大,若只以检测少数几种兴奋剂作为尿检的指标,不能全面地分析该原料是否受到β-受体激动剂的污染或有违法添加。
本试验参照中国农业部1025号公告-11-2008前处理方法,液相色谱-串联质谱,在正离子多反应监测模式下,测定经盐酸葡萄糖醛苷酶/芳基硫酸酯酶酶解,异丙醇-乙酸乙酯液液萃取,MCX柱子固相萃取后试样中的9种β-受体激动剂(包括特布他林、沙丁胺醇、西马特罗、非诺特罗、氯丙那林、莱克多巴胺、克伦特罗、妥布特罗、喷布特罗)。制备一系列β-受体激动剂浓度的猪尿样本,通过其平均回收率、相对标准偏差、相关系数等参数初步评估“公告”前处理方法结合选取的液相和质谱测定条件,增加检测项目的可行性。
1 材料与方法
1.1 材料与仪器
1.1.1 试剂
特布他林、沙丁胺醇、西马特罗、非诺特罗、氯丙那林、莱克多巴胺、克伦特罗、妥布特罗、喷布特罗标准品:美国Sigma公司;
β-盐酸葡萄糖醛苷酶/芳基硫酸酯酶、沙丁胺醇D3、莱克多巴胺D3、克伦特罗D9内标物:美国Sigma公司;
甲醇、甲酸:色谱纯,美国Tedia公司;
乙酸铵、氢氧化钠、氨水:分析纯,天津大茂试剂厂;
异丙醇、乙酸乙酯:分析纯,国药集团化学试剂有限公司。
1.1.2 设备
液相色谱-串联质谱仪:Agilent1260/6410A型,美国安捷伦公司;
恒温水浴振荡器:SHA-C型,常州国华电器有限公司;
涡旋振荡器:Vortex genie2型,美国Scientific Industries公司;
高速离心机:H-2050R型,湖南长沙湘仪离心机仪器有限公司;
pH计:PHS-3B型,上海虹益仪器仪表有限公司;
旋转蒸发仪:RE52-98型,上海亚荣生化仪器厂;
固相萃取柱:MCX型,美国Waters公司;
氮吹仪:TTL-DCⅡ型,上海深瑞仪器有限公司;
滤膜:4.5μm,美国 Millipore公司。
1.2 前处理方法
1.2.1 酶解 准确量取5mL猪尿试样,于50mL离心管中,依次加入5mL 0.2mol/mL的乙酸铵缓液、40μLβ-盐酸葡萄糖醛苷酶/芳基硫酸酯酶,混匀,37℃,避光振荡16h。
1.2.2 提取 样本酶解16h后,添加100μL 100ng/mL的同位素内标,涡旋混匀,高速离心(10 000r/min,10min),转移上清液于另一50mL离心管中,用5mol/mL的氢氧化钠溶液调节上清液的pH至9.8±0.2。调节完pH值后,依次加入10mL异丙醇-乙酸乙酯和2mL的饱和氯化钠溶液,涡旋振荡5min,5 000r/min离心10min。转移上清液至另一50mL离心管后,样品进行添加异丙醇-乙酸乙酯、饱和氯化钠溶液的2次提取。将两次得到的上清液合并在同一个离心管中,50℃下旋转蒸发至残留少许液体时,添加1mL乙醇,再旋转至干。最后用5mL的乙酸铵缓冲液溶解残渣,备用。
1.2.3 净化 依次用3mL甲醇、3mL水活化 MCX柱,备用液过柱,用3mL水、3mL 2%的甲酸水溶液、3mL甲醇依次淋洗MCX柱。再用5mL 5%的氨水甲醇溶液洗脱MCX柱于15mL的离心管中。洗脱液在50℃条件下,氮气吹干。残渣用0.5mL的甲醇-0.1%甲酸/水溶解,滤膜过滤,定容于1mL的进样瓶中。液相色谱-串联质谱仪备用。
1.2.4 绘制校正曲线 准确量取适量特布他林、沙丁胺醇、西马特罗、非诺特罗、氯丙那林、莱克多巴胺、克伦特罗、妥布特罗、喷布特罗混合标准液,制备1,2,4,10,20ng/mL的一系列溶液(内标物均为10ng)。峰面积与对应浓度进行线性回归,并绘制校准曲线。
1.3 仪器测定条件
1.3.1 液相色谱条件 色谱柱:ZORBAX Eclipse plus C18(2.1mm×150mm 3.5μm);流动相:A 相:0.1%甲酸甲醇溶液;B相:0.1%甲酸/0.5%甲醇水溶液;梯度洗脱:0~5min,5%A线性变化至60%;5~10min,60%A线性变化至95%A;10.00~10.01min,95%A变化至5%A;10.01~18.00min,保持5%A;流速:0.3mL/min;进样量:5μL;柱温:35℃。
1.3.2 质谱条件 离子源:ESI;扫描方式:正离子扫描;检测方式:多反应检测;电喷雾电压:4.0kV;离子源温度:300℃;干燥气流速:7L/min;雾化气压力:310.3kPa;其它参数:见表1。
1.4 结果判定
以保留时间,阳性样品定性离子与定量离子相对丰度比值和标准品的离子相对丰度比值的比值在80%~120%为定性依据。由于缺少适合非诺特罗和喷布特罗的内标物,二者皆以外标法定量。西马特罗、特布他林、沙丁胺醇以沙丁胺醇D3为内标物,莱克多巴胺以莱克多巴胺D3为内标物,氯丙那林、克伦特罗、妥布特罗以克伦特罗D9为内标物,采用内标法定量。
2 结果与分析
2.1 标准品离子色谱图
在选定的测定条件下,添加量为1ng/mL的混标溶液的总离子流色谱图见图1。
在MRM模式,分别对9种β-受体激动剂特征离子对进行监控,得到其添加量为1ng/mL时相应的出峰时间和响应值,见表2。
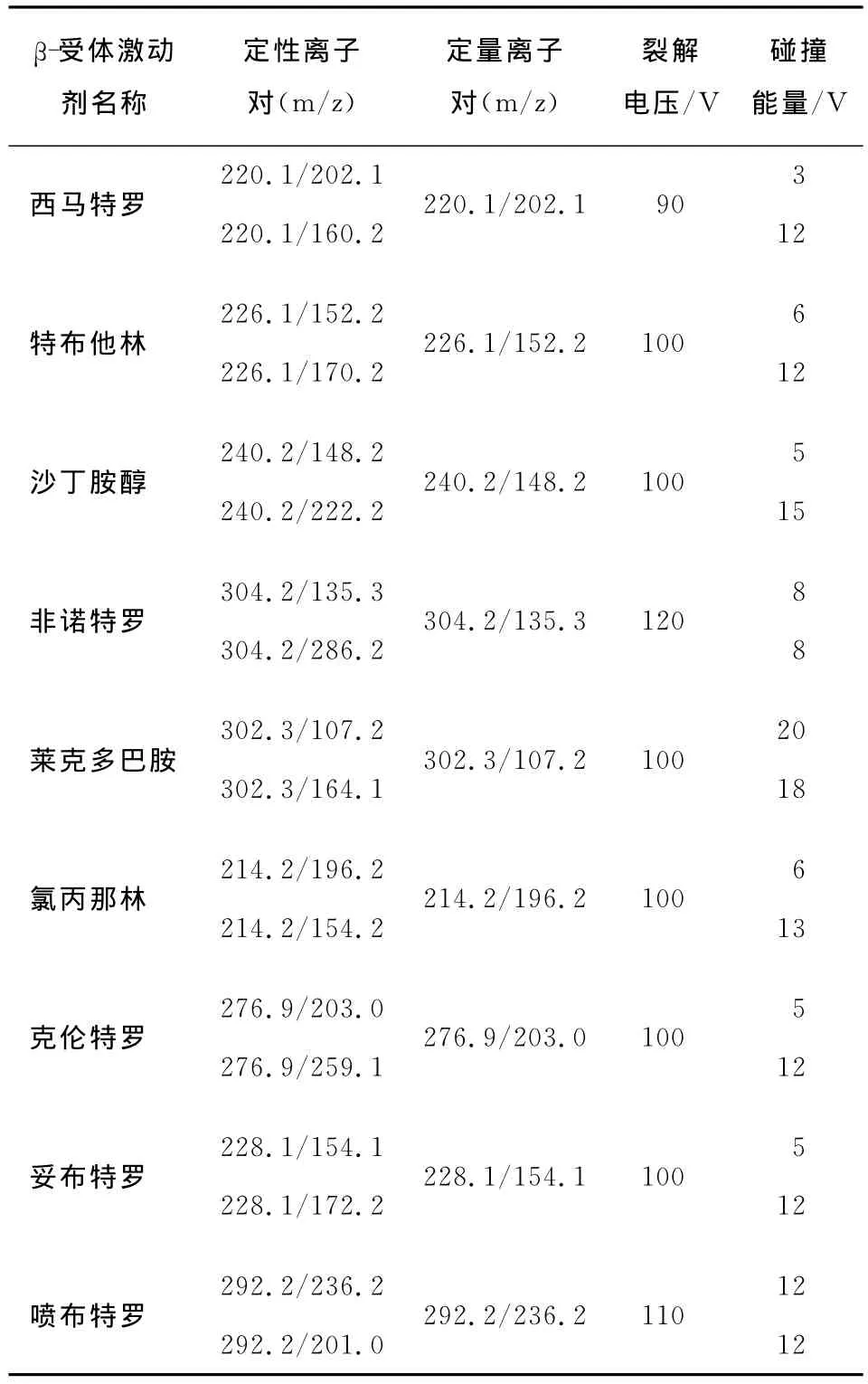
表1 9种β-受体激动剂的监测离子对、裂解电压和碰撞能量Table 1 Monitoring ion pairs,cracking voltage and collision energy of 9β-agonists
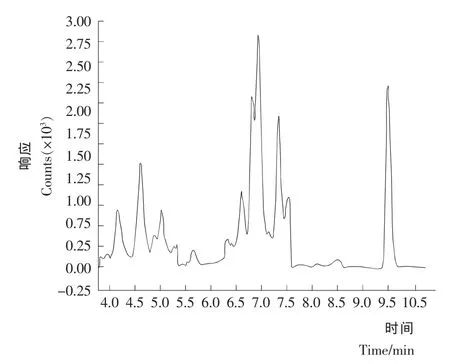
图1 总离子流色谱图(1ng/mL)Figure 1 Total ion chromatogram of sample(1ng/mL)
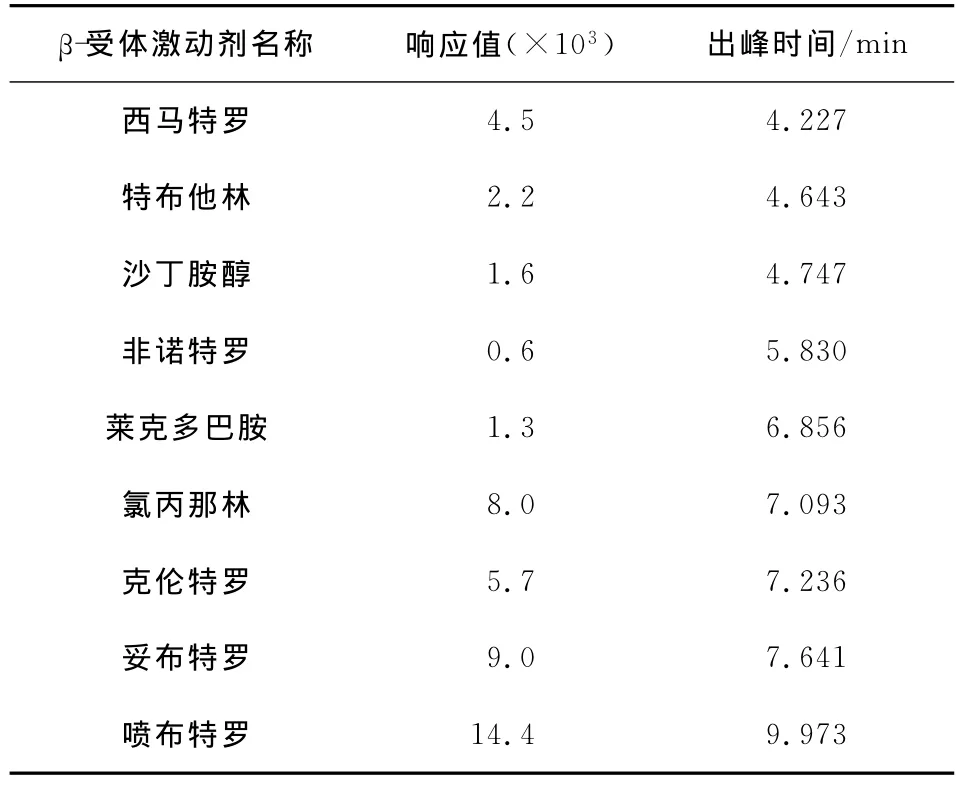
表2 9种β-受体激动剂的出峰时间和响应值Table 2 Appearance times and response values of nineβ-agonists
2.2 回归方程、相关系数与检测限
9种β-受体激动剂线性回归方程、相关系数与检测限见表3。

表3 9种β-受体激动剂线性回归方程、相关系数与检测限Table 3 Regression equations,correlation coefficients and LODs for nineβ-agonists
在选定的液相色谱、质谱测定条件下,检测添加量范围为1~20ng/mL的西马特罗、特布他林、沙丁胺醇、莱克多巴胺、氯丙那林、克伦特罗、妥布特罗,以目标化合物与内标物的峰面积比值为纵坐标,目标化合物与内标物的浓度比之为横坐标,进行线性回归。在相同的条件下,检测相同浓度范围的非诺特罗和喷布特罗,其浓度与峰面积进行线性回归。采用该方法获得的标准曲线线性良好,在1~20ng/mL的浓度范围内,9种β-受体激动剂的标准曲线的线性相关系数均大于0.997。因此,该方法具有较大的线性范围和良好的线性相关性。选择9种β-受体激动剂添加量为1ng/mL,待测化合物的响应值的信噪比折算为3倍信噪比时,样品中9种β-受体激动剂的检测限在之间,结果表明,该方法检测灵敏度高,可保证试验结果的准确性。
2.3 平均回收率与RSD
选取空白试样,添加水平为1,2,4,10,20ng/mL时,9种β-受体激动剂的平均回收率 (n =4)在82.12%~118.61%,相对标准偏为0.97%~11.53%,具体结果见表4。该方法准确度和精密度可满足9种β-受体激动剂的检测要求。

表4 9种β-受体激动剂平均回收率Table 4 Recoveries of nineβ-agonists(n =4)

续表4
3 结论
本试验参照常规的前处理方法,采用新的检测条件,以液相色谱串联质谱法对猪尿样本中9种β-受体激动剂实行了同时检测。结果显示,在添加量为1~20ng/mL范围内,回收率为88.31%~118.61%,相对标准偏差为0.97%~11.53%,仪器检测限在0.01~0.12ng/mL。该方法具有线性范围广,回收率高,精度好,灵敏度高的特点,较之中国农业部1025号公告,其可增加β-受体激动剂可检项目。该法能满足现有检测要求,为兴奋剂的市场监控提供了有效的检测手段。
1 聂建荣,连槿,潘云山,等.高效液相色谱-串联质谱法检测动物尿液中15种β-受体激动剂[J].色谱,2010,28(8):759~764.
2 Graeme P Currie,Daniel K C Lee,Andrew M Wilson.Effects of dual therapy with corticosteroids plus long actingβ2-agonists in asthma[J].Respiratory Medicine,2005,99(6):683~694.
3 沈建忠,江海洋.畜产品中β-受体激动剂残留及其危害[J].中国动物检疫,2011,28(6):27~28.
4 G Van Vyncht,S Preece,P Gaspar,et al.Gas and liquid chromatography coupled to tandem mass spectrometry for the multiresidue analysis ofβ-agonists in biological matrices[J].Journal of Chromatography A,1996,750(1~2):43~49.
5 刘道峰,邓省亮,赖卫华,等.莱克多巴胺荧光微球免疫层析检测方法的建立[J].食品与机械,2012,28(1):73~77.
6 李峰,金池国.酶联免疫法在克伦特罗等β兴奋剂检测中的应用[J].中国卫生检验杂志,2003,13(2):208.
7 Fidel Toldrá,Milagro Reig.Methods for rapid detection of chemical and veterinary drug residues in animal foods[J].Trends in Food Science & Technology,2006,17(9):482~489.
8 Guy Degand,Anne Bernes-Duyckaerts.Determination ofβ-agonists in urine by an enzyme immunoassay based on the use of an anti-salbutamol antiserum[J].Analytica Chimica Acta,1993,275(1~2):241~247.
9 Zhang G P,Wang N,Yang J F,et al.Development of an immunochromatographic lateral flow test strip for detection ofβ-adrenergic agonist Clenbuterol residues[J].Journal of Immunological Methods,2006,312(1~2):27~33.
10 Magda Caban,Piotr Stepnowski,Marek Kwiatkowski,et al.Determination ofβ-blockers andβ-agonists using gas chromatography and gas chromatography-mass spectrometry-A comparative study of the derivatization step[J].Journal of Chromatography A,2011,1 218(44):8 110~8 122.
11 Shao Bing,Jia Xiaofei,Zhang Jing,et al.Multi-residual analysis of 16β-agonists in pig liver,kidney and muscle by ultra performance liquid chromatography tandem mass spectrometry[J].Food Chemistry,2009,114(3):1 115~1 121.
12 Juan C,Igualada C,Moragues F,et al.Development and validation of a liquid chromatography tandem mass spectrometry method for the analysis ofβ-agonists in animal feed and drinking water[J].Journal of Chromatography A,2010,1 217(39):6 061~6 068.
13 中国人民共和国农业部.农业部1025号公告-11-2008 猪尿中β-受体激动剂多残留检测液相色谱-串联质谱法[S].北京:中国农业出版社,2008.
