榆树脐腹小蠹坑道真菌研究
2013-09-06朱晓梅刘雪峰
徐 阳 ,朱晓梅,刘雪峰,2*
(1.东北林业大学林学院,哈尔滨 150040;2.新疆农业大学林业与园艺学院,乌鲁木齐 830052)
榆树(Ulmus spp.)是新疆重要的绿化树种,发挥着巨大的生态作用。尤其是白榆(Ulmus pumila)材质优良,抗病性强,特别是对全世界毁灭性植物病害——荷兰榆病(Dutch Elm Disease)具有高度抗病性。但近年来,在我国新疆地区,白榆人工林大面积受小蠹虫危害,并出现零星或成片死亡,危害造成了极大的经济损失和生态损失。危害白榆树的小蠹虫主要是脐腹小蠹(Scolytus schevyrewi),它分布在新疆的伊宁、霍城、查布查尔、克拉玛依、奎屯和阿勒泰地区等地[1]。脐腹小蠹还分布在中国北方各省,是韩国、蒙古、俄罗斯、哈萨克斯坦、乌兹别克斯坦、吉尔吉斯斯坦、土库曼斯坦和塔吉克斯坦的本土害虫。2003年4月首次在北美地区干旱的白榆上采集到了该害虫。到2005年春季,在美国的亚利桑那州、加利福尼亚州等22个州都发现了脐腹小蠹。在美国从4种榆树上采集到脐腹小蠹,分别为:U.americana,U.procera,U.pumila和U.thomasii[2]。脐腹小蠹不断地重复侵害树势衰弱的植株,加快衰弱的速度,导致被害株迅速死亡。死亡不久砍伐的原木,最适于脐腹小蠹定居繁殖,是主要的虫源地。在新疆脐腹小蠹虫危害致死率3~5%,严重地段达到50%以上。该害虫1 a发生2~3代,以老熟幼虫在树皮内越冬。保证林木健康生长和消除虫源地是脐腹小蠹综合防治的基本环节[3]。目前,对该害虫的生物学习性、发生规律和防治技术等都进行了较全面的研究。
Brasier C M(1987)在我国东北部辽宁省的大连、丹东、沈阳、中部陕西省的西安、新疆省的乌鲁木齐、吐鲁番、玛纳斯和伊宁采集了受到小蠹虫危害的榆树详细的样本。从小蠹虫危害的样本上分离到了担子菌和茄腐镰刀菌[4]。刘慧珍在新疆乌鲁木齐、玛纳斯、石河子、伊犁地区、河南武险县、内蒙镶黄旗和山西文水县等地,设置50多块标准地,对榆树次生林、人工林、防护林、行道树和“四旁”树进行多次死亡情况调查,并以病榆木质部变色部位和危害榆树的小蠹虫为材料,进行了真菌分离培养,从小蠹虫、坑道和病榆树组织中分离到Graphium putredinis、G.penicillioides及镰刀菌(Fusarium spp.)、青霉(Penicillium sp.)和茅菌属(Doratomyces)等多种真菌[5]。
小蠹虫和真菌的共生是一种广义上的共生,包括互惠共生、拮抗共生和其他形式的共生[6]。Graham研究认为小蠹虫与真菌共生是小蠹虫与真菌充分利用森林生态系统内寄主树木高纤维素、半纤维素和木质素等营养物质适应性的进化结果[7]。在植物—小蠹虫—共生真菌系统中,共生真菌在削弱寄主树木抗性、协助小蠹虫侵害树木中起重要作用,对某些小蠹虫或寄主树木而言,共生真菌甚至是小蠹虫成功侵害的必要条件[8-9]。目前为止,对脐腹小蠹虫坑道真菌研究还不够深入。为此,本文报道了脐腹小蠹虫坑道真菌的分离培养结果,确定了小蠹虫坑道真菌群落组成和优势种群,为研究新疆榆脐腹小蠹虫与伴生菌关系提供基础资料。
1 材料和方法
1.1 标本采集
在每一个调查样地选取合适的受害榆树,将有明显危害痕迹的木段锯下带回实验室备用。2009年7月从库尔勒市、和静县、和硕县和2010年4月从克拉玛依市总计采集6段受脐腹小蠹危害的榆木段,见表1。

表1 脐腹小蠹虫危害木标本采集Tab.1 The bark beetle harmed of wood specimen collection
1.2 培养基
(1)PDA培养基:马铃薯20 g,琼脂17 g,葡萄糖20 g,蒸馏水1 000 mL。
(2)CSMA培养基:麦芽汁20 g,放线菌酮0.05 g,链霉素0.04 g,琼脂17 g,蒸馏水1 000 mL。
(3)MEA培养基:麦芽浸提物20 g,蛋白胨1.0 g,葡萄糖20 g,琼脂17 g,蒸馏水1 000 mL。
(4)CMA培养基:玉米粉20 g,琼脂17 g,蒸馏水1 000 mL。
(5)WA培养基:琼脂17 g,蒸馏水1 000 mL。
1.3 坑道真菌分离培养和鉴定
取脐腹小蠹的幼虫坑道、成虫羽化后坑道标本为分离材料,将其切成大约0.5×0.5 cm小块,用漂白粉(1∶14)进行表面消毒后接种到培养基中,培养基采用PDA、MEA、MA CMA和CSMA 5种培养基,每个培养皿内放5块分离材料,设3个重复,分离伴生菌,25℃培养箱避光培养。另外做一组,分离材料表面不消毒,直接接种在培养基上。
当接种材料周围长出菌落时,从中挑取菌丝分离纯化菌种。定期观察菌落生长情况,同时进行菌种统计,并统计分离频率(检出率)。
分离频率=分离到该菌材料数/该处理材料总数×100%
将分离纯化已产孢的真菌菌落采用直接挑取标本,制作成水载片;产生子实体的真菌采用徒手切片方法,制成水载片,在显微镜下进行形态特征并测量、描述,依据形态特征参考一些相关分类学资料进行分类鉴定[10-13],确定所分离到的真菌的属(种)。
1.4菌种保存
接种3~4 d以后,待菌落长出,在解剖镜下用针尖挑取不同的菌落,接种到PDA培养基中,25℃培养,相对湿度为50%,光照为0级。待菌种长出,保存到试管斜面中。
2 结果分析
2.1 幼虫坑道木质部真菌分离结果
从库尔勒、和静及和硕3个地区采集了4棵样树,接种了600块脐腹小蠹幼虫木质部坑道的小样,共120皿,分离结果见表2和表3。从幼虫坑道木质部共分离到真菌12属,其中库尔勒、和静及和硕3个样地分离到的真菌共有属7个:Fusarium、Graphium、Paecilomyces、Phoma、Alternaria、Penicillium和待定种1。其中,Chaetomium和Cladosporium只从和静标本中分离到的,Candida和Dictyoarthrinium只从和硕标本中分离到的。库尔勒分离到的真菌种类相对较少,标本B和标本C间真菌种类差异较大,共有种类3属。
幼虫木质部坑道真菌优势种为Fusarium,灭菌和不灭菌条件下,平均分离率分别为98.33%和100%,其次是待定种1,灭菌和不灭菌条件下,平均分离率分别为15%和39.15%,Graphium灭菌和不灭菌条件下,平均分离率分别为17.09%和22.47%。
从灭菌与不灭菌分离材料上分离真菌的结果略有差异,灭菌的分离到10属,不灭菌的分离到11属,共有属9个。其中,Chaetoumium在灭菌的条件下分离出来,Dendrodochium和Dictyoarthrinium在不灭菌条件下分离到的,但是分离率都很低。
应用5种培养基分离幼虫木质部坑道真菌分离结果:PDA培养基上分离到的种类最少,有6属;其次是CSMA和WA,分别有8属;MEA和MA培养基上分离到的种类略多,分别为9属和10属。其中Fusarium、Graphium、Paecilomyces、Phoma和待定种1是5种培养基上所共有的。
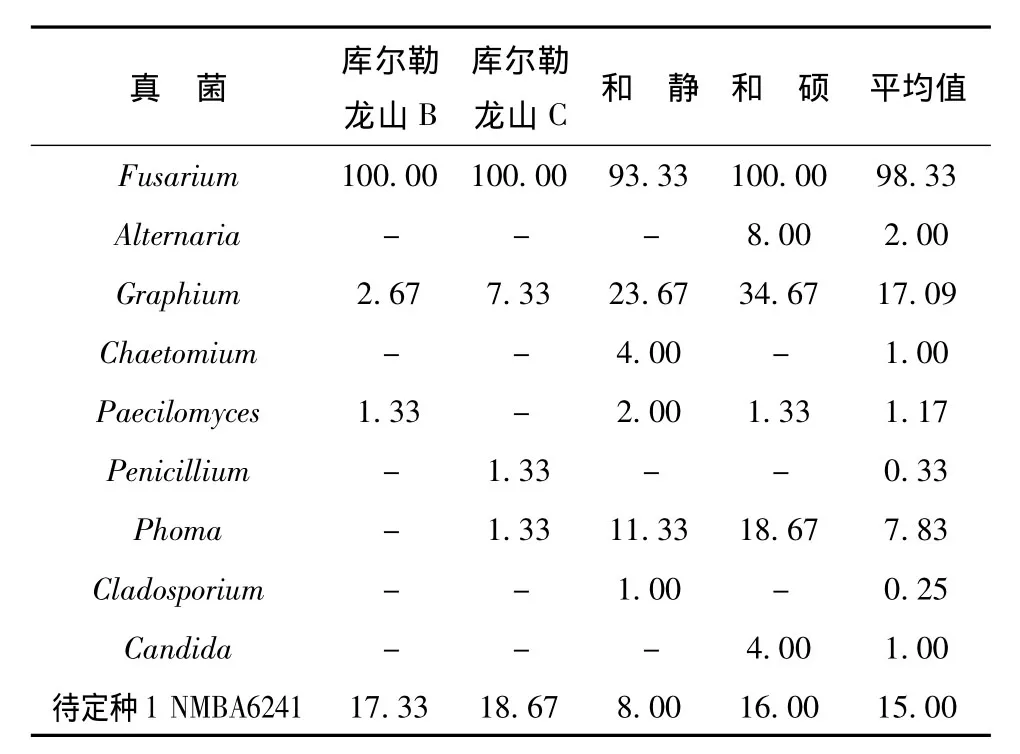
表2 表面灭菌的幼虫木质部坑道真菌Tab.2 The larvae gallery fungi surface sterilized in xylem
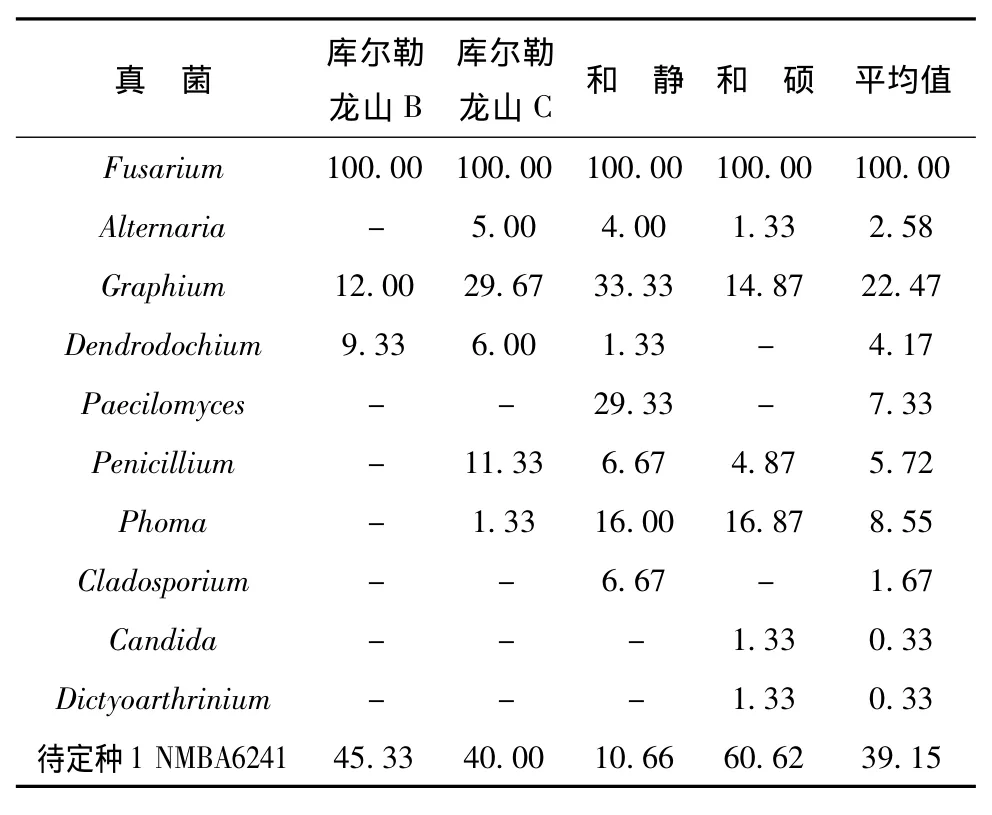
表3 表面不灭菌木质部坑道真菌Tab.3 The larvae gallery fungi of without surface sterilized in xylem
2.2 幼虫坑道树皮真菌分离结果
在库尔勒、和静及和硕3个地区采集了4棵样树,接种了600块脐腹小蠹虫树皮坑道的小样,共120皿,分离结果见表4和表5。从和硕、和静标本中分离到的真菌较库尔勒的多。3个地区的共有种类有 6属:Fusarium、Alternaria、Graphium、Phoma、Penicillium和待定种1。只从和静标本中分离到了Cladosporium和Stilbum,Candida和Dictyoarthrinium只从和硕标本中分离到。
幼虫木质坑道与树皮坑道真菌组成基本相似,只从木质坑道分离到Chaetoumium,只从树皮坑道中分离到Stilbum。说明在小蠹虫危害的情况下,在小蠹虫坑道各个部位的真菌组成上没有显著差异,优势种上也基本相同。
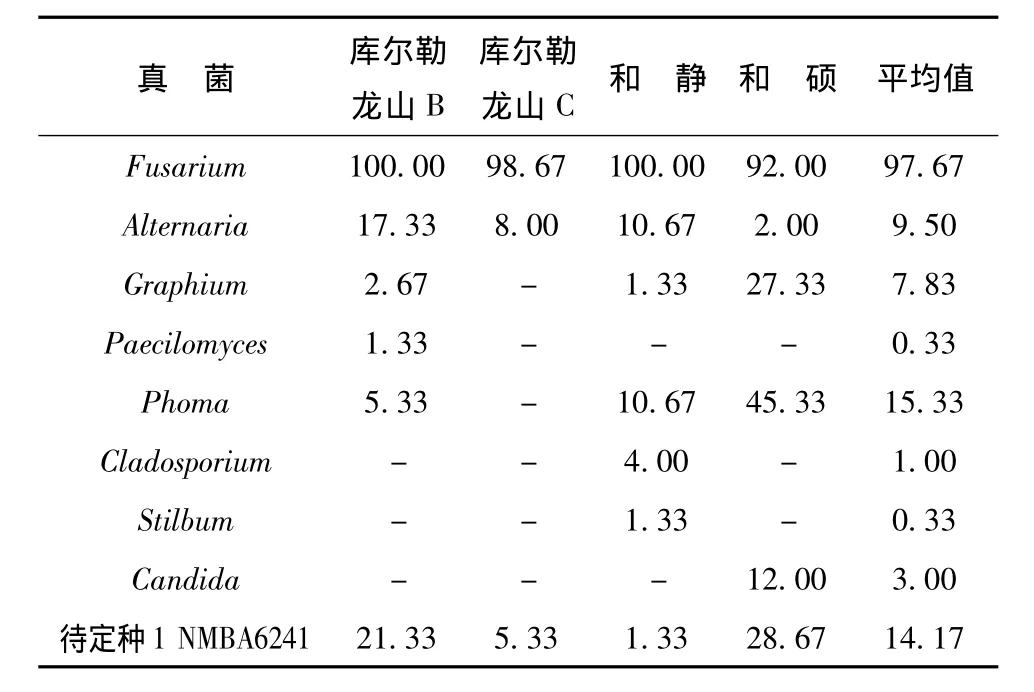
表4 表面灭菌的树皮坑道真菌Tab.4 The larvae gallery fungi surface sterilized in tree bark
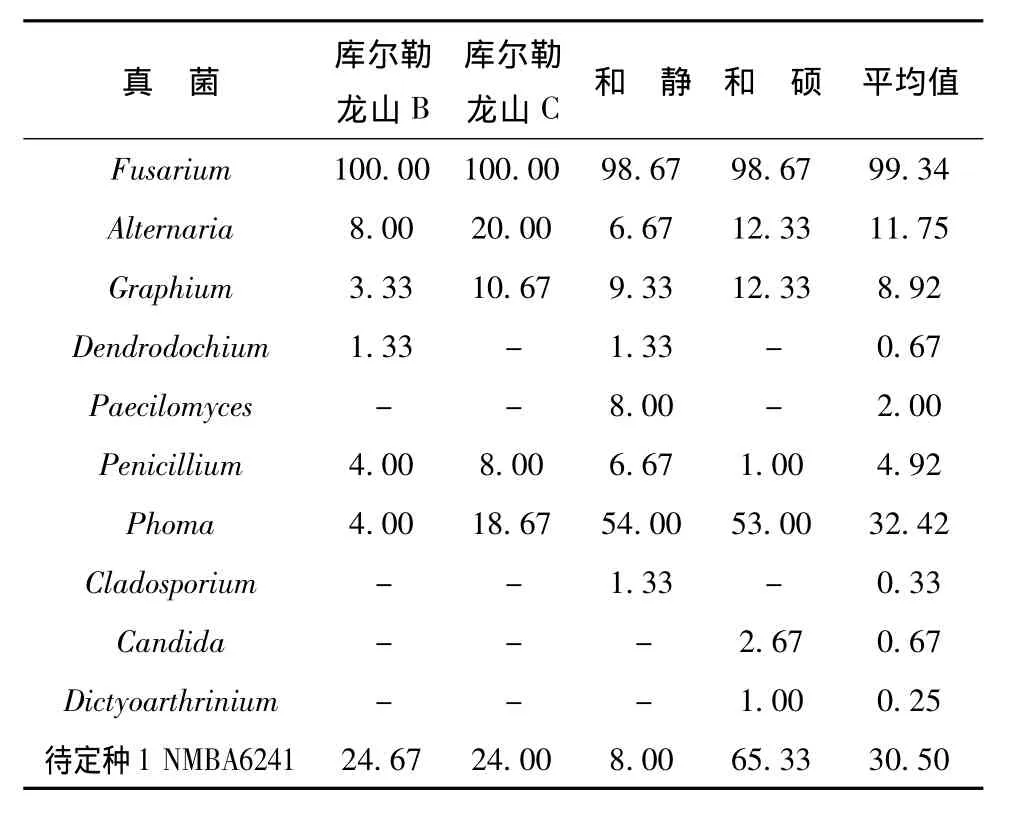
表5 不灭菌树皮坑道真菌Tab.5 The larvae gallery fungi without surface sterilization in tree bark
2.3 成虫羽化后的坑道真菌分离结果
在克拉玛依地区采集了2棵样树,接种了240块成虫羽化后坑道的小样,共48皿,分离结果见表6。从中分离到真菌10属,待定种1个。灭菌和不灭菌条件下均为10属,但略有差异,Chalara只在不灭菌的条件下分离到。Fusarium被普遍分离到,为优势真菌,灭菌和不灭菌条件下,平均分离率分别为为72.5%和67.5%,其它较占优势的是Monilia、Peyronellaea和Penicillium。
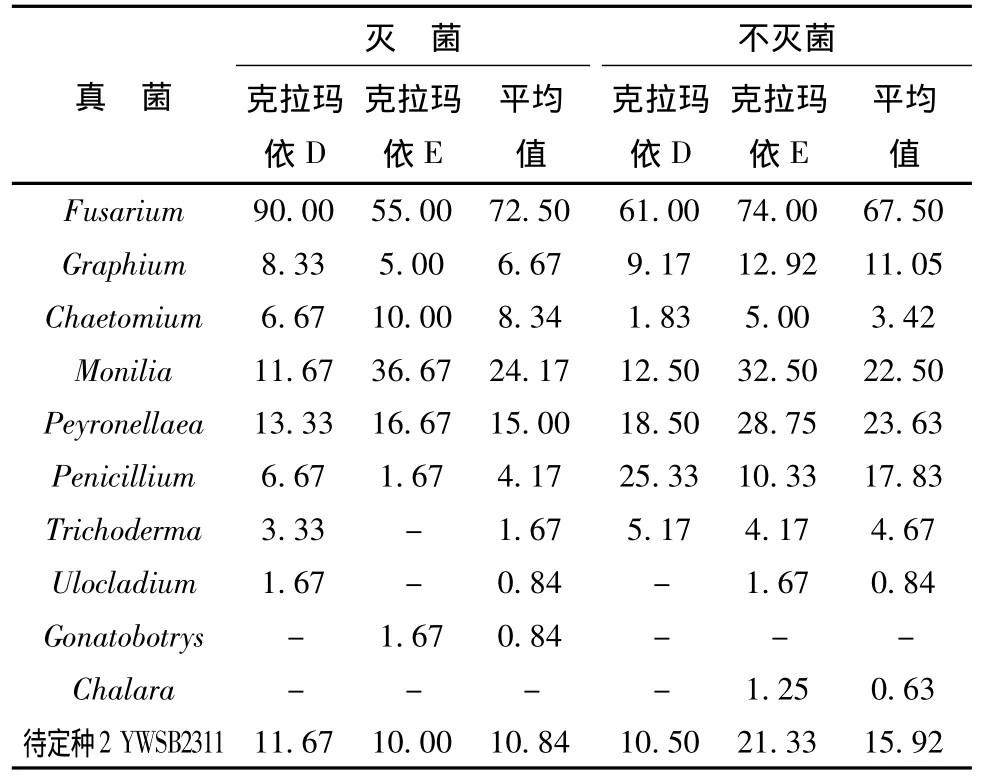
表6 成虫羽化后坑道真菌Tab.6 The adults gallery fungi after adult emergence
3 结论与讨论
利用5种培养基对脐腹小蠹幼虫坑道和成虫羽化后坑道标本进行分离培养,共分离到真菌18属,待鉴定的种类有2种。幼虫坑道中分离到12属真菌,从木质部坑道和树皮坑道中种类组成较接近。从成虫羽化后遗留坑道中分离到真菌10属。
脐腹小蠹幼虫坑道、成虫羽化后坑道优势真菌都为镰刀菌,经形态学和分子鉴定为茄腐镰刀菌(Fsarium solani),在灭菌和不灭菌条件下,从寄主木质坑道和树皮坑道上以及各种培养基上都能分离到,而且均占优势。茄腐镰刀菌在幼虫坑道、成虫羽化后坑道中的平均分离率分别是:98.84%、67.50%。与Brasier C M(1987)和刘慧珍(1988)从小蠹虫危害的榆树标本的分离结果类似。镰刀菌属的真菌代谢产生的对人畜及植物致病的毒素,同时也会对其他真菌产生抑制作用,这也是从脐腹小蠹坑道中所分离到的真菌种类贫乏的原因。镰刀菌属的真菌是重要的植物病原真菌,可以引起多种植物产生枯萎病。从小蠹虫坑道中分离到的茄腐镰刀菌参与了脐腹小蠹虫对榆树的危害过程。
成虫羽化后的坑道真菌与幼虫坑道真菌共有的属为:Chaetomium、Fusarium、Graphium和Penicillium;幼虫坑道的真菌主要有:Alternaria、Candi-da、Cladosporium、Dendrodochium、Dictyoarthrinium、Paecilomyces、Phoma、Stilbum和1个待定种(NMBA6241);在成虫道内特有的真菌为:Chalara、Gonatobotrys、Monilia、Peyronellaea、Trichoderma、Ulocladium和1个待定种(YWSB2311)。说明从幼虫坑道和成虫坑道所分离到的真菌种类组成有所不同,但是它们的优势种均为茄腐镰刀菌。可能是幼虫坑道内树皮和木质部被小蠹虫取食和真菌的分解作用及寄主组织坏死后,坑道内的化学成分和组织结构发生变化而引起了真菌群落的改变。
另外,在分离脐腹小蠹坑道真菌时,建议使用多种培养基,这样可以增加分离真菌到多更种真菌的机会。对分离材料灭菌和不灭菌对分离结果略有影响,在不灭菌条件下分离到的真菌种类普遍较灭菌条件下分离到的种类要丰富。
】
[1]李清西,蒋新民,刘芳政.榆树脐腹小蠹生物学习性初步研究[J].八一农学院学报,1987,33(3):12-18.
[2]Negron J F,Witcosky J J,Cain R J,et al.The banded elm bark beetle:A new threat to elms in North America[J].Am.Entomol,2005,51:84-94.
[3]王占亭,陈满英.脐腹小蠹发生规律的研究[J].新疆农业科学,2000(S1):146-149.
[4]Brasier C M.China and the origins of Dntch elm disease:an appraisal[J].Plant Pathology,1990,39:5-16.
[5]刘慧珍.我国榆树死亡原因探讨—兼析是否发生荷兰榆病[J].林业科学研究,1988,1(4):405-412.
[6]Paine T D,Raffa K F,Harrington T C.Interactions among scolytid bark beetles,their associated fungi,and live hostconifer[J].Annu Rev Entomol,1997,42:179-206.
[7]Graham K.Fungal-insect mutualism in trees and timber[J].Annu Rev Entomol,1967,12:105-126.
[8]Berryman A A.Resistance of conifers to invasion by bark beetle fungus associations[J].Bioscience,1972,22(10):598-602.
[9]Christiansen E.Induced response in phenolic metabolism in two Norway spruce clones after wounding and inoculations with Ophiostoma polonicum,a bark beetle-associated fungus[J].Plant Physiology,1995,109:821-827.
[10]巴尼特.半知菌分类图解[M].北京:科学出版社,1978.
[11]Kiffer E,Morelet M.The Deuteromycetes Mitosporic Fungi Classification and Generic Keys[M].New Hampshire:Science Publishers Inc,2001.
[12]Sutton B C.The Coelomycetes:Fungi Imperfecti with Pycnidia Acervuli and Stromata[M].England:Comm.Mycol.Inst.,1980.
[13]Booth C.The Genus Fusarium[M].England:Comm.Mycol.Inst.,1971.
