竹叶多糖的组分及抗氧化活性分析
2013-09-06毛建卫
殷 军,葛 青,毛建卫,*,方 晟
(1.浙江理工大学理学院,浙江杭州 310018;2.浙江科技学院生物与化学工程学院,浙江杭州310023;3.浙江省农产品化学与生物加工技术重点实验室,浙江杭州310023;4.绍兴文理学院元培学院,生命科学系,浙江绍兴 312000)
近年来,人们围绕竹类主要化学成分的分析及其开发利用开展了大量的研究工作。研究表明,竹叶中含有黄酮及其苷类、活性多糖类、特种氨基酸及其衍生物、叶绿素及一些具有挥发性成分的化合物。竹叶提取物不仅具有良好的防腐性能和抗氧化性能,而且还具有医疗、生理保健功能,是一种十分理想的天然绿色食品及化妆品添加剂[1]。竹叶中的多糖是除黄酮之外的另一种重要的生理活性物质[2],国内对竹叶多糖的提取优化研究比较多,但对竹叶多糖的组分及抗氧化活性研究比较少。研究对竹叶多糖的组分及抗氧化活性进行了研究,旨为竹叶多糖的进一步研究利用奠定基础,同时为竹叶资源的开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
毛竹叶 采自浙江科技学院后山,60℃烘干,粉碎备用;试剂 二苯基苦基苯肼(DPPH)、氮蓝四唑(NBT)、烟酰胺腺嘌呤二核苷酸(NADH)、吩嗪硫酸甲酯(PMS)、铁氰化钾、三氟乙酸;透析袋;单糖标准品 鼠李糖、木糖、岩藻糖、甘露糖、阿拉伯糖、半乳糖、葡萄糖、D-葡萄糖醛酸 均为Sigma公司产品;其余试剂 均为国产分析纯。
精密电子天平 上海第二分析仪器厂;FD-1冷冻干燥机 北京德天佑科技发展有限公司;100B数显定时蠕动泵 上海荀甫沪西仪器厂;紫外可见分光光度计 日本日立公司;800B台式离心机 上海安亭科学仪器厂制;DEAE Sepharose FF、Sephcryl S-100 GE healthcare Bio-Sciences AB。
1.2 实验方法
1.2.1 竹叶多糖的提取及纯化[3]将预处理好的竹叶置于大烧杯中,加入1∶30的蒸馏水煮沸2h,然后减压浓缩。提取液中加入3倍体积的无水乙醇,摇匀后放置冰箱24h,在4000r/min下离心10min,取沉淀。沉淀溶于水,用Sevag法脱蛋白后,加入无水乙醇至浓度30%,摇匀后放置冰箱24h,离心取沉淀,冷冻干燥得粗多糖BLP30。
取粗多糖BLP30溶于蒸馏水中,配制成20mg/mL的溶液,5000r/min离心15min,取上清液用DEAESepharose Fast Flow离子柱层析(2.6cm×40cm)进行初步分离,上样量为20mL。首先以蒸馏水洗脱,再用0.1、0.2、0.4、0.6、2mol/L的NaCl进行梯度洗脱,自动部分收集仪分步收集流分,洗脱液每10mL收集一管,苯酚-硫酸法检测,根据糖显色反应结果合并相同流分。将0.1mol/L NaCl洗脱液,浓缩、反复透析,冷冻干燥得BLP30。
采用AKTA explorer层析系统,Sephacryl S-100凝胶柱层析对样品进行纯化。洗脱条件:凝胶柱Sephacryl S-100(2cm×55cm);洗脱液:蒸馏水;流速:1mL/min;样品浓度:10mg/mL,上样体积1mL;洗脱液以5mL/管收集,苯酚-硫酸法检测,以吸光度对洗脱体积作图。
1.2.2 分子量的测定 分子量的测定采用尺寸排除色谱和激光光散射联用仪(SEC-LLS)。泵的型号为:Waters-1515(Waters China.Ltd.,USA),柱子型号为:ultrahydrogel250(7.8mm×300mm)和ultrahydrogel 1000(7.8mm×300mm),柱温45℃,检测器为八角度激光光散射仪(λ=658nm;HELEOS 8,Wyatt Technology Co.,USA)和示差检测器(RI-2414),流动相为PBS(0.01mol/L,pH7.4),流量为1.0mL/min。检测样品浓度为3.0mg/mL。样品检测前经孔径为0.2μm过滤器(Whatman,England)过滤。数据处理软件为ASTRA(Wyatt Technologies)。
1.2.3 单糖组成测定
1.2.3.1 标准单糖的乙酰化[4-5]精密称取等摩尔(2mmol/L)的岩藻糖、半乳糖、木糖、鼠李糖、葡萄糖、甘露糖,分别溶于3mL蒸馏水中,加入20~30mg硼氢化钠,于室温下,间歇振荡,还原3h,然后用冰醋酸中和过量的硼氢化钠,至溶液不再产生气泡为止,pH应在4~5之间,加入3mL甲醇,减压浓缩蒸干,重复3~4次,以除去反应副产物硼酸及水分,然后置于真空干燥器中过夜。次日,110℃烘箱中加热20min,充分除去残留的水分后,加入4mL醋酐,100℃反应1.5h,冷却,然后加入3mL甲苯,减压浓缩蒸干,重复3~4次,以除去多余的醋酐。将乙酰化后的产物用4mL氯仿溶解后转移至分液漏斗,加入少量蒸馏水充分振荡后,除去上层水溶液,如此重复4次。氯仿层以适量的无水硫酸钠干燥,定容至10mL待GC分析。
1.2.3.2 样品的乙酰化处理 取2mg多糖样品,放入旋转蒸发瓶中,加入2mol/L的三氟乙酸(TFA)4mL,在110℃封管水解2h。将水解液低于40℃减压蒸干,然后加入3mL甲醇蒸干,重复上述操作4~5次,以完全除去TFA。然后按照1.2.3.1的方法进行还原、乙酰化,用氯仿定容至5mL,待GC分析。
1.2.3.3 气相条件 气相色谱仪配备HP-5石英毛细管柱(30m×0.32mm×0.25μm,5%phenyl methylsiloxane),氢火焰离子化检测器(FID),高纯氮作载气,柱流量1mL/min。程序升温:柱初温120℃,以10℃/min升至240℃,保持6.5min。进样量为0.1μL,分流比1∶30,进样口和检测器温度均为250℃。氢气35mL/min,空气350mL/min,尾吹气30mL/min。
1.2.4 抗氧化活性
1.2.4.1 DPPH自由基清除活性测定 根据Espin等[6]的方法进行改进,测试了样品对DPPH自由基清除活性。
改进后方法如下:在4mL浓度为100μmol/L的DPPH甲醇溶液中,加入2mL不同浓度的样品,彻底摇匀后于室温下暗处放置1h之后,采用可见光分光光度计于517nm下测定吸光度。以蒸馏水作为空白对照组,维生素C为阳性对照组。样品的DPPH自由基清除活性(%)的计算公式为:

1.2.4.2 羟基自由基的清除活性测定 根据Cumbes and Smironoff[7]的方法改进,在1mL不同浓度的样品中,分别加入1mL硫酸亚铁(1.5mmol/L),0.7mL过氧化氢,0.3mL水杨酸钠(20mmol/L)。混匀后,在37℃水浴1h,采用可见分光光度在562nm下测定吸光度。以蒸馏水作为空白对照组,维生素C为阳性对照组。样品的羟基自由基的清除活性计算公式为:

1.2.4.3 超氧自由基的清除活性测定 根据Liu and Ng等[8]的方法,进行了改进。将1mL不同浓度的样品溶液中按顺序加入1mL的氮蓝四唑(NBT,300μmol/L),1mL的烟酰胺腺嘌呤二核苷酸(NADH,936μmol/L),最后加入1mL吩嗪硫酸甲酯(PBS,120mmol/L)启动反应。以上溶液均用磷酸缓冲液(100mmol/L,pH7.40)配制。将该混合液混合均匀于室温下放置5min后,采用可见光分光光度计于560nm下测定吸光度。以蒸馏水作为空白对照组,维生素C为阳性对照组。样品的超氧阴离子自由基清除活性(%)的计算公式为:

2 结果与讨论
2.1 竹叶多糖的洗脱曲线及分子量大小
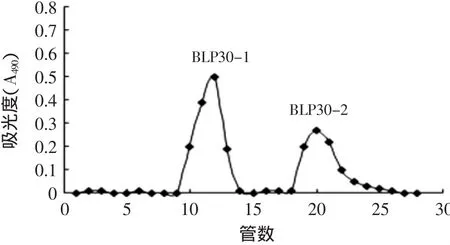
图1 竹叶多糖的Sephcryl S-100洗脱曲线Fig.1 Bamboo-Leaf polysaccharide Sephcry S-100 elution curve
竹叶多糖BLP30经Sephcryl S-100纯化,共收集到2个主要多糖组分BLP30-1和BLP30-2。如图1所示,通过SEC-LLS测定了BLP30-1和BLP30-2分子量(Mw)分别为2.9×104、2.1×104u。
2.2 单糖组成
经GC测定,由图2~图4可知,BLP30-1和BLP30-2都是由岩藻糖、木糖、甘露糖、葡萄糖、半乳糖五种糖组成的。面积归一化,BLP30-1的各单糖峰面积百分比分别为18.00%、25.65%、13.45%、25.99%、16.91%,其中木糖和葡萄糖含量最高。BLP30-2的各单峰面积百分比分别为25.40%、20.63%、17.25%、11.32%、25.40%,岩藻糖和半乳糖含量最高。

图2 标准糖样中单糖的气相色谱Fig.2 Gas chromatogram of the monosaccharides in standard sample
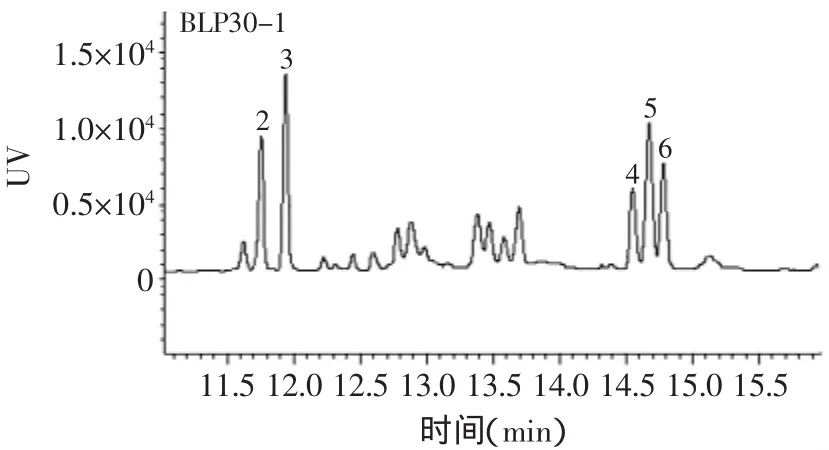
图3 样品BLP30-1的气相色谱图Fig.3 Gas chromatogram of the monosaccharides in BLP30-1

图4 样品BLP30-2的气相色谱图Fig.4 Gas chromatogram of the monosaccharides in BLP30-2
2.3 抗氧化活性
2.3.1 DPPH自由基清除活性 研究表明,自由基与机体的许多功能障碍和疾病的发生有关。因此,研究自由基的检测方法并探讨物质对自由基的清除作用具有重要意义。DPPH(二苯代苦味酰自由基)分析法被广泛用于清除自由基物质性质的研究,DPPH在有机溶剂中是一种稳定的自由基,其在517nm附近有强吸收(呈深紫色)。当自由基清除剂存在时,DPPH的孤对电子被配对,其517nm吸收消失或减弱,通过测定吸收减弱的程度,可评价自由基清除剂的活性[9]。由图5可以看出,随着竹叶多糖浓度的增加,对DPPH清除的清除率呈上升趋势。比较而言,BLP30-1具有更强的清除DPPH能力,但都弱于VC。BLP30-1、BLP30-2的IC50值分别为0.14、0.32mg/mL。

图5 DPPH的清除活性Fig.5 Scavenging effects of the samples on DPPH radical
2.3.2 羟基自由基清除活性 羟基自由基是最活跃的自由基,可以轻易穿透细胞膜。羟基自由基会与重要的生物分子反应包括碳水化合物、蛋白质、脂质、DNA,导致组织损伤或细胞死,因此清除羟基自由基对保护生物系统是非常重要的[10-11]。由图6可以看出,两种多糖对羟基都有较好的清除活性,而且最终清除率都高于70%。当浓度在1.6mg/mL时,BLP30-1清除率达到80%以上。维生素C浓度在0.8~1.6mg/mL时,清除活性均在90%以上。对羟基自由基而讲,目前普遍有两个机理:a.抑制羟基自由基的产生;b.清除羟基自由,本实验具体是哪种机理需要深入研究[12]。
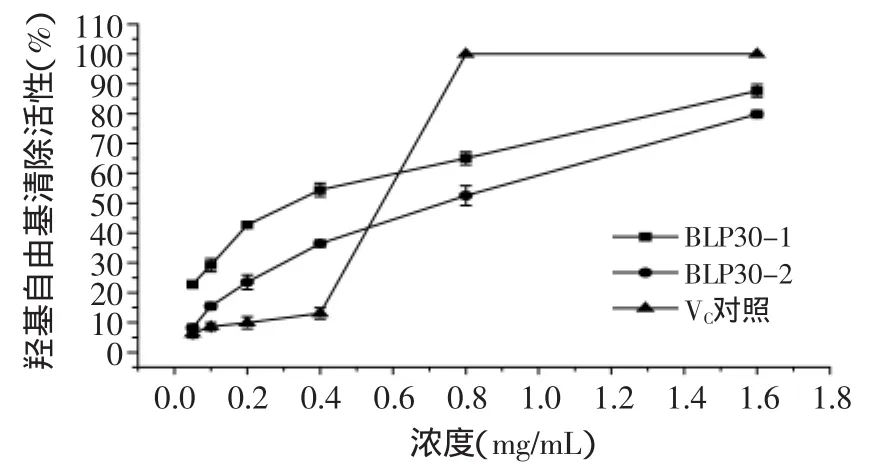
图6 羟基自由基的清除活性Fig.6 Scavenging effects of the samples hydroxyl radical
2.3.3 超氧自由基清除活性 超氧自由基是活性氧的一种,在体内由过氧化物歧化酶清除,如果体内过氧化物歧化酶活力下降或超氧产生过量都会对机体造成危害[13]。本实验结果显示,竹叶多糖对羟基自由基的清除作用与多糖的剂量呈一定的量效关系,当多糖的浓度为1.0mg/mL时,可以显著抑制超氧自由基的产生(见图7)。由图7可知,维生素C抑制超氧自由基的效果并不理想。
3 结论
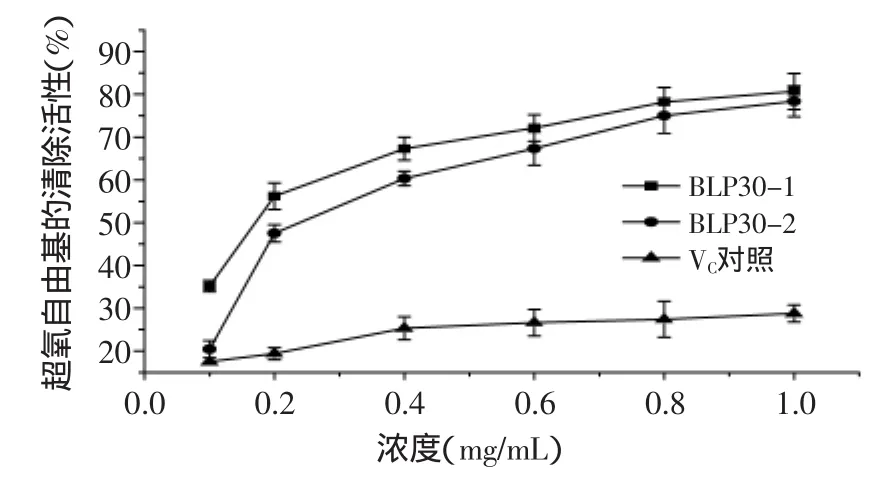
图7 超氧自由基的清除活性Fig.7 Scavenging effects of the samples on superoxide radical
竹叶多糖经DEAE Sepharose F F和Sephcryl S-100纯化后得到两个主要多糖组分BLP30-1和BLP30-2。对二者的单糖组成、分子质量(Mw)测定表明,二者都有岩藻糖、木糖、甘露糖、葡萄糖、半乳糖五种糖组成,且分子量分别为分别为2.9×104、2.1×104u。对竹叶多糖进行抗氧化活性研究表明,其在清除DPPH、羟基自由基、超氧自由基有较高的功效。因此,竹叶多糖用于保健食品或药品开发具有一定的价值,是一种优良的天然活性物质。
[1]李飞跃,喻国光,陈金珠,等.竹叶主要化学成分分析及其生物活性研究现状[J].江西林业科技,2006(4):34-36.
[3]Liang D,Zhou Q,Gong W,et al.Studies on the antioxidant and hepatoprotective activities of polysaccharides from Talinum triangulare[J].Journal of Ethnopharmacology,2011,136:316-321.
[4]Grigorij K, Dusan U, Jean RB, et al.Structural and immunochemicalcharacterization ofthetype IIIgroup B Streptococcus capsular polysaccharide[J].J Biochem,1996,271(16):8786-8790.
[5]徐桂云,陈汝贤,常理文.用毛细管气相色谱法测定多糖中单糖的组成[J].分析测试学报,2000,19(3):71-73.
[6]Espin JC, Wichers HJ, Viguera CG.Anthocyanin-Based Natural Colorants:A New Source of Antiradical Activity for Foodstuff[J].Journal of Agricultural and Food Chemistry,2000,48:1588-1592.
[7]Cumbes QJ,Smironoff N.Hydroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28:1057-1060.
[8]Liu F,Ng TB.Antioxidative and free radical scavenging activities of selected medicinal herbs[J].Life Sciences,1999,66:725-735.
[9]陈晓静,于江傲,赵瑞香.显齿蛇葡萄叶中二氢杨梅素的制备及其抗氧化活性研究[J].食品工程,2012(18):137-139.
[10]Yuan JF,Zhang ZQ,Fan ZC,et al.Antioxidant effects and cytotoxicity of three purified polysaccharides from Ligusticum chuanxiong Hort[J].Carbohydrate Polymer,2008,74:822-827.
[11]Boligon AA,Pereira RP,Feltrin AC,et al.Antioxidant activities of flavonol derivatives from the leaves and stem bark of Scutia buxifolia Reiss[J].Bioresource Technology,2009,100:6592-6598.
[12]Ueda J,Saito N,Shimazu Y,et al.A comparison of scavenging abilities of antioxidant against hydroxyl radicals[J].Archives of Biochemistry and Biophysics,1996,333:377-384.
[13]Chen Y,Xie MY,Nie,et al.Purification,composition analysis and antioxidant activity of a polysaccharide from the fruiting bodiesofGanoderma atrum[J].FoodChemistry,2008,107:231-241.
