异基因造血干细胞移植后合并感染性心内膜炎的临床特点分析
2013-09-06杜峻峰
李 昌,张 明,郭 智,杜峻峰
感染性心内膜炎 (IE)系由细菌、真菌等微生物直接感染而产生心瓣膜或心室壁内膜的炎症,一般易发生在先天性心脏病或者心脏瓣膜病患者[1]。近年来异基因造血干细胞移植(allo-HSCT)在临床广泛开展,allo-HSCT可提高恶性血液病患者的无病生存率[2-3],但移植前大剂量放化疗的应用、粒细胞缺乏、免疫功能低下及广谱抗生素的应用等因素导致allo-HSCT后出现各类感染,部分患者会合并IE,其临床表现多样,给治疗带来较大的困难。为提高对allo-HSCT后发生IE的认识,本研究回顾性分析了湖北省中山医院和北京军区总医院2007年1月—2012年7月收治的15例allo-HSCT后合并IE患者的临床资料,为临床医生提高对其认识提供依据。
1 资料与方法
1.1 一般资料 15例患者中男9例,女6例;年龄16~53岁,平均31.5岁。恶性血液病按FAB分型为急性髓系白血病(AML)10例,其中M1型2例、M2型4例、M4型1例、M5型2例、M6型1例;急性淋巴细胞白血病 (ALL)5例,其中B细胞型3例、T细胞型2例。无明确心脏基础疾病11例,有心脏基础疾病4例,分别为风湿性心脏瓣膜病3例、高血压心脏病1例,纽约心脏病学会心功能分级 (NYHA):Ⅰ级3例、Ⅱ级1例。
1.2 allo-HSCT过程 干细胞采集及预处理时供者接受粒细胞集落刺激因子动员,剂量为5~10 μg·kg-1·d-1,用法为连续皮下注射4~5 d。移植预处理方案采用改良BUCY方案(阿糖胞苷4 g·m-2·d-1, -9~-8 d;白消安4 mg·kg-1·d-1, -7~-5 d;环磷酰胺1.8 g·m-2·d-1, -7~-6 d;甲基环己亚硝脲250 mg/m2,-3 d)。allo-HSCT前全面查体,清除呼吸道、口腔、肛周等部位潜在感染灶,经过氯己定药浴后入住百级层流洁净室,口服肠道消毒剂,采用大剂量输液、碱化尿液预防出血性膀胱炎,应用更昔洛韦预防巨细胞病毒感染及间质性肺炎,静脉滴注肝素钠预防肝静脉闭塞,每周静脉滴注免疫球蛋白,密切监测血象、肝肾功能、电解质等指标,加强成分输血等支持治疗,血制品均经照射后输给患者,发热者经验性给予敏感抗生素治疗。移植方法采用骨髓加外周血干细胞联合移植,第4天在硬膜外麻醉下从髂后上棘采集骨髓,第5天采集外周血干细胞,采集总单个核细胞数在5×108/kg以上。
1.3 血培养 确诊的IE患者均因移植后出现发热,考虑感染反复进行血培养,采集患者血标本进行培养,按照全国临床检验操作规程进行常规操作,同时给予亚胺培南等抗生素经验性抗感染治疗,积极查找感染灶及微生物证据,一旦血培养阳性根据药敏试验选用抗生素。
1.4 IE评定标准 诊断IE主要临床标准包括:两次血培养阳性,且为同一病原菌、超声心动图发现心内膜受累依据。次要标准:存在易患因素、发热、外周血管有渗出表现、免疫指标增高、致IE的细菌感染的血清学证据。按修订的DUKE的诊断标准[4],符合以下条件之一即可确诊IE:(1)经病理学证实赘生物、栓子等。(2)临床确诊:符合2项主要标准或1项主要标准+3项次要标准或5项次要标准。
1.5 方法 记录15例患者的移植效果、一般资料、抗生素药物敏感性、治疗及转归。所有患者在allo-HSCT后即开始随访,随访结束时间为2012年10月,统计患者的总生存率。
2 结果
2.1 移植效果 15例患者移植后均获重建造血,中性粒细胞计数≥0.5×109/L的时间为15~26 d,平均18.5 d;血小板计数≥20×109/L的时间为16~31 d,平均21.4 d。所有患者移植后30 d植入分析证实为完全供者造血。发生IE的时间为14~45 d,平均31.8 d。
2.2 一般资料 15例患者的IE症状:发热15例 (100%),出现心脏听诊杂音9例 (60%),心功能不全9例 (60%),心前区疼痛8例 (53%),合并肺栓塞2例 (13%)。15例患者中血培养检出革兰阳性球菌13例 (87%),主要为金黄色葡萄球菌5例、链球菌属4例、溶血葡萄球菌2例、表皮葡萄球菌1例、凝血酶阴性葡萄球菌1例。真菌感染2例,均为假丝酵母菌。15例患者超声心动图检查均发现赘生物,右心赘生物8例,其中肺动脉瓣3例、右房室瓣3例、右心房2例;左心赘生物7例,其中主动脉瓣3例、左房室瓣2例、左心房2例。
2.3 抗生素药物敏感性 13例革兰阳性球菌药敏试验中万古霉素、青霉素敏感性均为100%,利奈唑胺、左氧氟沙星敏感性分别为85%(11/13)、69%(9/13),红霉素、克林霉素敏感性均为15%(2/13);2例真菌药敏试验伏立康唑、两性霉素B敏感性均为100%。
2.4 治疗及转归 15例患者因allo-HSCT的特殊性,造血恢复慢,免疫功能差,一般情况差等因素未能行手术治疗,均采用内科保守治疗。根据药敏试验选用敏感抗生素治疗,10例患者症状未缓解,其中5例出现心功能衰竭死亡,4例合并呼吸衰竭、循环衰竭、肝脏衰竭等,最后死于多器官功能衰竭,1例出现肺栓塞死亡;5例症状缓解患者随访至2012年10月,其中2例发生移植物抗宿主病 (GVHD,死亡1例),2例合并肺部感染 (死亡1例),因复发死亡1例 (见图1、2)。
3 讨论
血液肿瘤患者allo-HSCT后容易合并各种感染,尤其移植前反复化疗、移植期间强烈的预处理方案,移植后出现GVHD等,再加上多种强效免疫抑制剂联合应用导致患者免疫功能进一步下降[5],均会导致感染的迅速进展。其中一部分会合并IE,IE一旦发生,若不及时治疗,病情会迅速恶化,从而导致患者死亡。IE的典型病灶是伴有赘生物的形成,致病微生物以细菌最为常见,也有一部分患者出现真菌感染[6]。非allo-HSCT患者发生IE多见于有心脏基础疾病如心瓣膜病、先天性心脏病,主要累及主动脉瓣和左房室瓣,但本组患者心脏基础疾病较少,但由于合并恶性血液病,行allo-HSCT后也容易发生IE,加上移植后免疫功能缺陷[7],合并心脏基础疾病者更易发生IE,病死率极高[8]。IE临床表现多样,常因化脓性细菌侵入心内膜引起,多由毒力较强的病原菌感染所致,也可由毒力较弱的条件致病菌如草绿色链球菌所引起。同一细菌在不同患者中可以有不同临床表现[9],本组患者移植期间均使用过广谱抗生素,包括碳青霉烯类、头孢菌素类等,多接受了如锁骨下静脉置管等侵入性诊疗操作,致病菌种会发生一定的变化,出现真菌感染的病例也增加。但本组患者仍以金黄色葡萄球菌为主,假丝酵母菌的检出可能与患者免疫功能低下或者合并其他部位感染导致IE的发生有关。药敏试验结果表明革兰阳性球菌对万古霉素、青霉素敏感性均为100%,真菌对伏立康唑、两性霉素B敏感性均为100%[10]。
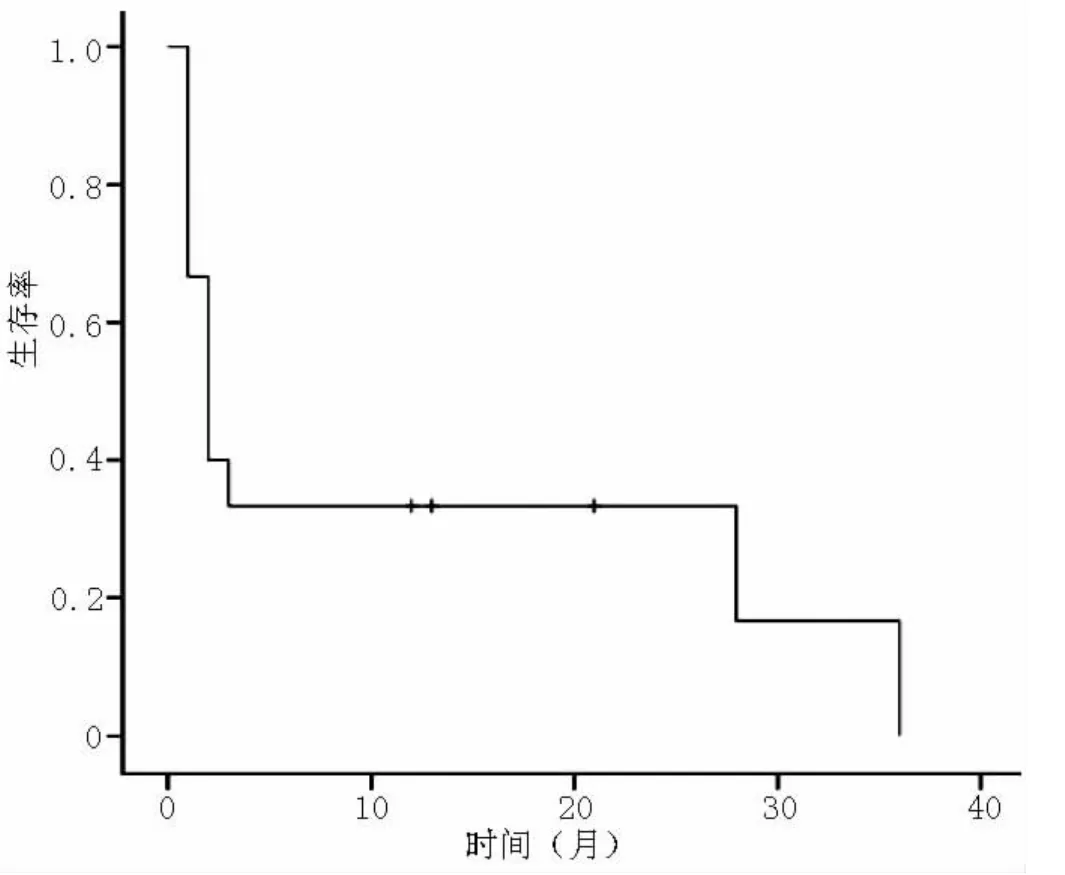
图1 15例allo-HSCT后合并IE患者生存曲线Figure1 Survival curve of the IE patients after allo-HSCT

图2 有无心脏基础疾病allo-HSCT后合并IE患者生存曲线Figure2 Comparison of survival curves of the IE patients after allo-HSCT between heart disease group and non-heart disease group
IE的临床表现多样,发热仍是其主要表现[11],本组资料显示患者均有不同程度的发热,一部分患者出现心前区疼痛、心功能不全,少部分患者合并肺栓塞或者出现典型皮疹改变,但心脏杂音的检出率很高,需要对移植后患者认真询问病情并查体,以便及早发现IE的重要线索。血培养阳性是诊断IE的主要标准之一,发现赘生物更是IE的有力验证。本组患者全部经超声心动图检查见到赘生物。超声心动图检查是早期诊断IE的有效辅助检查手段,不仅可确定赘生物存在部位、大小及活动性,还可评估患者心脏情况,确定手术治疗时机,有利于指导临床治疗,但由于移植患者的造血功能、凝血功能、全身状况等特殊性,未能行外科手术治疗[12]。对发热原因不明尤其伴有心脏情况改变的患者,提高血培养送检率至关重要,反复多次进行血培养,血培养阳性不仅可以早期诊断IE,更能指导临床医生选择抗生素,从而提高IE的治愈率[13]。影响IE预后的因素众多,研究发现高龄、急性肾衰竭、瓣环周围脓肿形成、多个瓣膜受累、耐药菌感染、伴有心力衰竭、伴有神经系统并发症等均为影响患者预后的危险因素[14]。恶性血液病移植后患者由于存在贫血、低清蛋白血症,发热引起C反应蛋白 (CRP)升高等均与IE患者的预后不良相关。贫血本身为IE较常见的症状之一,主要原因为感染所致轻中度贫血,但血液病患者可表现为重度贫血。此外移植后合并其他感染更会加重贫血,贫血导致患者循环血量不足,出现能量代谢障碍,从而心功能恶化,进而影响患者预后[15]。
综上所述,IE是一种威胁生命的严重感染,病死率相对其他疾病较高,尤其行allo-HSCT后合并IE的患者病情更凶险,因此针对临床上allo-HSCT后持续发热患者,尤其有心脏基础疾病的患者,要想到IE的可能,及时进行血培养及超声心动图检查,以便早期发现 IE,早期治疗,提高患者生存率。
1 Kiefer TL,Bashore TM.Infective endocarditis:a comprehensive overview[J].Rev Cardiovasc Med,2012,13(2/3):e105-e120.
2 朱玲,薛梅,阎洪敏,等.异基因造血干细胞移植联合间质干细胞输注治疗骨髓纤维化转化的急性髓系白血病一例并文献复习[J].中国全科医学,2011,14(5):1613.
3 朱玲,薛梅,王志东,等.异基因造血干细胞移植治疗重型再生障碍性贫血的疗效研究[J].中国全科医学,2011,14(6):1925.
4 Mylonakis E,Caldcrwood SB.Infective endocarditis in adults[J].Nengl J Med,2001,345(18):1318-1330.
5 朱玲,薛梅,王志东,等.异基因造血干细胞移植治疗重型再生障碍性贫血的疗效研究[J].中国全科医学,2011,14(6):1925-1927.
6 Lehrnbecher T,Frank C,Engels K,et al.Trends in the postmortem epidemiology of invasive fungal infections at a university hospital[J].J Infect JT,2010,61(3):259-265.
7 陈琬玲,侯开宇,李真.白血病化疗及造血干细胞移植对卵巢功能的影响[J].中国全科医学,2005,8(18):1492-1494.
8 朱平,张镜芳,吴若彬,等.内外科综合治疗感染性心内膜炎[J].南方医科大学学报,2007,27(11):1786-1788.
9 Mastrobuoni S,Chan V,Ruel M.Early surgery for infective endocarditis[J].N Engl J Med,2012,367(14):1365-1366.
10 胡志,金晓东,康焰.利奈唑胺治疗神经系统重症合并革兰阳性菌感染患者10例临床分析[J].疑难病杂志,2010,9(9):657.
11 Attias D,Bouleti C,Vahanian A.Persistent fever in a multicomplicated infective endocarditis[J].Arch Cardiovasc Dis,2012,105(10):535-536.
12 蔡开灿,王文林,王振康,等.感染性心内膜炎的外科治疗[J].南方医科大学学报,2006,26(10):1536-1537.
13 Selton-Suty C,Célard M,Le Moing V,et al.Preeminence of Staphylococcus aureus in infective endocarditis:a 1-year populationbased survey[J].Clin Infect Dis,2012,54(9):1230-1239.
14 Heiro M,Helenius H,Hurme S,et al.Short-term and one-year outcome of infective endocarditis in adult patients treated in a Finnish teaching hospital during 1980-2004[J].BMC Infect Dis,2007,7(1):78.
15 Wang A.Recent progress in the understanding of infective endocarditis[J].Curr Treat Options Cardiovasc Med,2011,13(6):586 -594.
