夏枯草中多糖的提取与含量的测定
2013-09-05张霞聂少平李景恩李卷梅林慧霞李昌谢明勇
张霞,聂少平,李景恩,李卷梅,林慧霞,李昌,谢明勇
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
夏枯草(Prunella vugarisL.)为唇形科(Labiatae)夏枯草属(prunella)植物,多年生草本,全球约15种,广泛分布于欧亚温带地区及热带山区,非洲北部及北美洲也有分布,我国产4种3变种,其中1种为引种栽培,主要产于湖南、安徽、浙江、江苏等地[1-2]。它具有几千年的药用历史,其果穗和全草均可入药,《神农本草经》记载其“主寒热、瘰疬、鼠瘘、头疮,破癥,散瘿结气,脚肿湿痹”,具有清火、明目、清肝、散结及消肿之功效。
近年来国内外学者对夏枯草进行了广泛的研究,尤其在其化学成分和药理研究方面作了较深入的探讨[3-7],研究表明,夏枯草含有多种活性化学成分,具有抗菌、降压、抗炎、抗肿瘤、降血糖等作用[8-12],其中多糖作为夏枯草的重要活性成分也受到广泛关注,为了进一步研究夏枯草多糖的理化性质及活性,为其后续研究提供实验理论依据,本实验对经过前处理去杂质后的夏枯草样品进行热水浸提,得样品溶液,采用苯酚-硫酸比色法[13-15]测定其多糖含量,实验中为减少误差采用精制夏枯草多糖测得夏枯草多糖对葡萄糖的换算因子。
1 材料与方法
1.1 材料与试剂
夏枯草,粉碎,贮于干燥器中备用。无水乙醇、丙酮、乙醚、氯仿、正丁醇、浓硫酸、苯酚、葡萄糖等试剂除注明外均为分析纯。
1.2 仪器与设备
FA1104电子天平:上海精天电子仪器厂;HH-4数显恒温水浴锅:国华电器有限公司;SHZ-IIIB循环水真空泵:上海亚荣生化有限公司;TGL-5-A离心沉淀机:上海安亭分析仪器有限责任公司;EYELAN-1001旋转蒸发仪:厦门精艺兴业科技有限公司;DZG-6050型真空干燥箱:上海森信实验仪器有限公司;DGG-9140A型电热恒温鼓风干燥箱:上海森信实验仪器有限公司;CQ超声微清洗器:上海超声波仪器厂;透析袋(规格为 8 000~10 000 Da):Sigma公司;TU-1900双光束紫可见分光光度计:北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 夏枯草多糖的提取与精制
称取经干燥粉碎后过20目筛的夏枯草粉末200g,用1 600 mL 80%乙醇浸泡24 h。用双层滤布过滤,滤渣阴干后,按料水比1∶20 g/mL在90℃热水中浸提2 h,间歇搅拌,双层滤布过滤,滤渣重复提取两次,合并三次滤液,在4 800 r/min条件下离心分离10 min,在旋转蒸发仪上进行真空浓缩(55℃、50 r/min、真空度0.095 MPa),使浓缩液约为原体积的1/5,然后向浓缩液中加入无水乙醇使乙醇浓度达70%,于4℃冰箱中醇沉 24 h,再离心分离(4 800 r/min,10 min),弃去上清液,将所得沉淀依次用无水乙醇、丙酮、无水乙醚各洗涤两次,在55℃条件下真空干燥,得夏枯草粗多糖。将干燥的粗多糖用蒸馏水溶解,采用Sevag法脱蛋白,加入约为样液体积1/3量的氯仿、正丁醇混合液(氯仿∶正丁醇为4∶1)剧烈振摇10 min,离心分离(4 800 r/min,10 min),分去水层和有机溶液层交界处的变性蛋白质。对得到的上清液反复脱蛋白至几乎无蛋白层,然后将所得溶液先用自来水透析48 h,再用蒸馏水透析24 h,透析完成后,将透析液进行真空浓缩(55℃,50 r/min,真空度0.095 MPa),向浓缩液中加入无水乙醇使乙醇浓度达70%,于4℃冰箱中过夜醇沉,再离心分离(4 800 r/min,10 min),所得沉淀依次用无水乙醇、丙酮、无水乙醚各洗涤两次,得精制夏枯草多糖,在55℃下真空干燥,所得样品置干燥器中备用。
1.3.2 测定波长的确定
配制一定浓度的精制夏枯草多糖溶液和葡萄糖标准溶液,精密量取2 mL于具塞试管中,按照1.3.3中所述方法显色,以等量的蒸馏水作空白,在TU-1900双光束紫外可见分光光度计上从400 nm~700 nm进行扫描,确定精制夏枯草多糖和葡萄糖的最大吸收波长。
1.3.3 标准曲线的绘制
标准溶液的配制:精密称取105℃干燥至恒重的葡萄糖标准品0.250 2 g,置于250 mL容量瓶中,加蒸馏水溶解并稀释至刻度,然后再取出10mL置于100mL容量瓶中,加蒸馏水至刻度、摇匀,配成100 μg/mL的葡萄糖标准溶液,备用。
5%苯酚溶液的配制:称取苯酚100 g,加铝片0.1 g和碳酸氢钠0.05 g,常压蒸馏、收集(180±2)℃馏分。精密称取该馏分约5 g置于100 mL容量瓶中,加水溶解至刻度,摇匀后转置于棕色试剂瓶中,即得5%苯酚溶液,置于冰箱中备用(现用现配)。
分别移取 0.2、0.4、0.6、0.8、1.0、1.2 mL 100 μg/mL的葡萄糖标准溶液于具塞试管中,加蒸馏水补至2 mL,配置成系列梯度的葡萄糖溶液,以2 mL蒸馏水作空白,每管加入5%苯酚溶液1 mL,摇匀,沿管壁缓慢加入浓硫酸各5 mL,迅速摇匀,在室温下显色35 min后,于490 nm波长处测定吸光度,以吸光度对葡萄糖浓度作回归方程。
1.3.4 换算因子的测定[16]
精密称取干燥至恒重的精制夏枯草多糖100.8 mg,置于100 mL容量瓶中,加蒸馏水溶解并稀释至刻度,摇匀配成精制多糖贮备液;再吸取2 mL上述储备液于100 mL容量瓶中,加蒸馏水溶解并稀释至刻度,摇匀,制得精制夏枯草多糖供试液。采用苯酚-硫酸比色法测定其吸光度,由回归方程求出此精制夏枯草多糖供试液中葡萄糖浓度,测得其葡萄糖含量,按(1)式计算换算因子。因夏枯草多糖干燥后溶解性较差,为减少测定误差,故将按1.3.1中的方法制得多糖透析液真空浓缩后取等量20 mL浓缩液两份,经醇沉洗涤后,一份直接加蒸馏水溶解、定容、比色、测定多糖含量;另一份真空干燥至恒重,称得精制夏枯草多糖的干重,由二者计算平均换算因子。

式中:W为称取多糖的重量,mg;C为精制夏枯草多糖贮备液中葡萄糖浓度,(mg/mL);D为多糖的稀释因素,mL。
1.3.5 样品中夏枯草多糖含量测定
称取3份约5g干燥过的夏枯草粉末样品,按1.3.1中多糖的提取方法反复提取,并分别将提取液加蒸馏水定容至100 mL容量瓶中,准确吸取2 mL,按照1.3.3中的方法测定吸光度,吸光度连续三次变化不大时,说明样品中多糖不再溶出,停止提取。合并滤液,在4 800 r/min的条件下离心分离10 min,将上清液在旋转蒸发仪上进行真空浓缩(55℃、50 r/min、真空度0.095 MPa),将浓缩液转移至250 mL容量瓶中,以蒸馏水定容至刻度,摇匀备用;再准确移取上述溶液5 mL置于100 mL容量瓶中,定容至刻度摇匀制成待测溶液备用。
精密吸取上述待测液各2 mL于各具塞试管中,按照1.3.3中的方法测定吸光度,由回归方程计算样液中葡萄糖浓度,按(2)式计算样品中夏枯草多糖含量。
多糖含量/%=CDf/W×100 (2)
式中:C为供试液中葡萄糖浓度,(mg/mL);D为多糖的稀释因素,mL;f为换算因子;W为供试夏枯草样品的重量,mg。
1.3.6 稳定性试验
配置某一浓度的多糖溶液,确保其吸光度在葡萄糖标准曲线的线性范围内,精密吸取该多糖溶液2 mL于具塞试管中,按照1.3.3下的方法测定吸光度,每隔0.5小时测定1次,连续2 h考察其稳定性。
1.3.7 精密度试验
在照1.3.3的方法测定样品中多糖含量时,将其中某一供试样品溶液连续测定6次吸光度,考察试验的精密度。
1.3.8 重现性试验
精密称取5份同一批夏枯草粉末各5 g,按照1.3.5中方法同时制取5份样品溶液。精密移取此样品溶液各2 mL,分别置于具塞试管中,按照1.3.3下的方法测定吸光度,由回归方程计算样液中葡萄糖浓度,按(1)式和(2)式计算夏枯草多糖含量,考察试验的重现性。
1.3.9 加标回收率测定
精密称取5份夏枯草粉末各1 g,按照1.3.5中方法反复提取浓缩得到浸提液,称取5份精制夏枯草多糖各约50 mg,用蒸馏水溶解后分别加入前面所得的5份浸提液中,再以蒸馏水定容于250 mL容量瓶中,摇匀,备用。然后分别精密移取10 mL于100 mL容量瓶中,以蒸馏水定容至刻度,摇匀,备用。按照1.3.3的方法测定吸光度,以其平均值作为回收率的计算结果。
2 结果与讨论
2.1 最大吸收波长
TU-1900双光束紫外可见分光光度计扫描结果显示夏枯草样品溶液在481 nm处有最大吸收,葡萄糖标准溶液在490 nm处有最大吸收。因为是以葡萄糖含量为标准测定夏枯草中的多糖含量,所以选择490 nm作为测定波长,结果如图2。
2.2 换算因子
将真空干燥的精制多糖溶解于水,测得换算因子f为2.122。利用等体积的多糖透析液,醇沉洗涤后,一份直接加蒸馏水溶解,转移至250 mL容量瓶中,加蒸馏水定容,摇匀。再吸取10 mL用蒸馏水定容于100 mL容量瓶中,摇匀后取2 mL于具塞试管中,测其吸光度为0.153。另一份真空干燥至恒重,称其重量为0.0652g。用这种方法测得换算因子f为2.010,取平均值f为2.066。
2.3 方法学实验结果
葡萄糖溶液标准曲线,见图1。
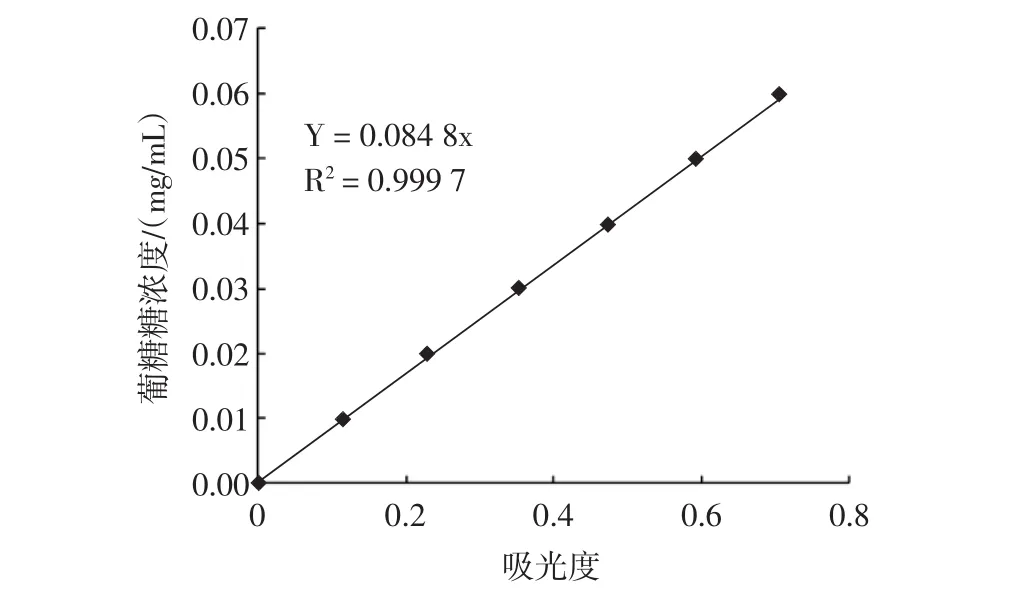
图1 葡萄糖溶液标准曲线图Fig.1 Standard curve of glucose solution
回归方程为y=0.084 8x,R2=0.999 7。由图1可见,葡萄糖标准品在10 μg/mL~60 μg/mL范围内呈良好线性关系。
夏枯草样品和葡萄糖光谱扫描图,见图2。
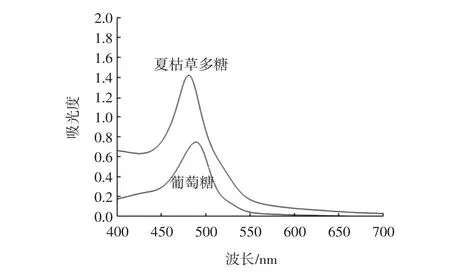
图2 夏枯草样品和葡萄糖光谱扫描图Fig.2 UV spectra of sample and glucose
为检验测定方法的正确性、精确度和稳定性,本试验进行了稳定性、精密度、重现性和加样回收率实验,其结果分别列于表1~表4。
从表1~表4可以看出,供试液在2 h内显色稳定,精密度(RSD=0.312%),测定结果重现性好(RSD=1.84%),回收率高(平均回收率为101.9%,RSD=2.01%)。

表1 稳定性试验结果Table 1 Results of stability experiments
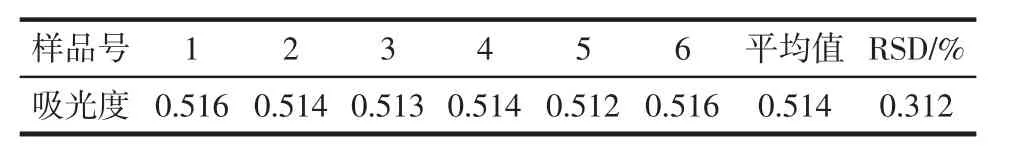
表2 精密度试验结果(n=6)Table 2 Results of precision experiments(n=6)
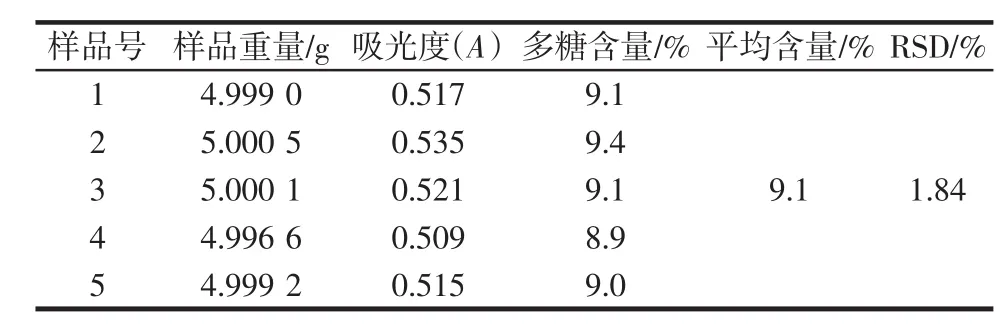
表3 重现性试验结果(n=5)Table 3 Results of reproducibility experiments(n=5)
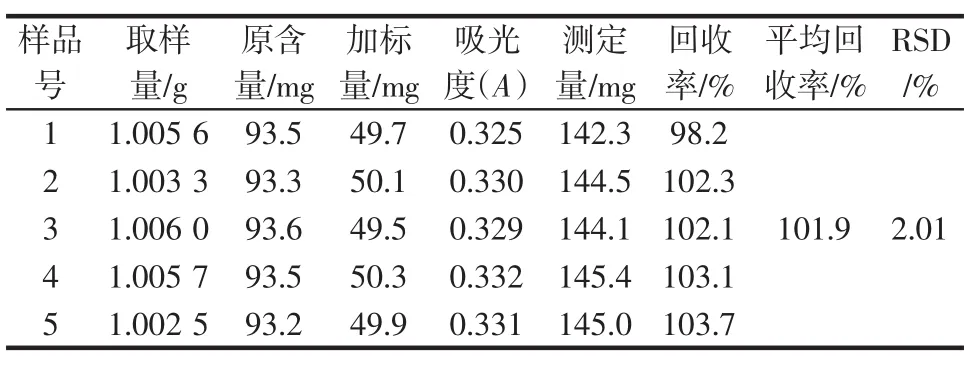
表4 加标回收率试验结果(n=5)Table 4 Results of recovery experiments(n=5)
2.4 夏枯草中多糖含量的测定
实际样品含量测定结果见表5,夏枯草中多糖平均含量为9.3%。
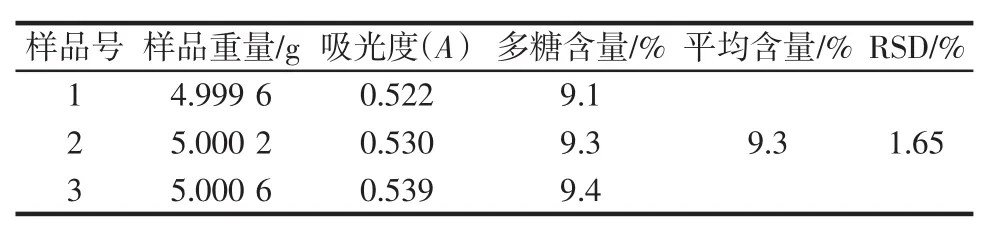
表5 夏枯草中多糖含量测定结果(n=3)Table 5 Determination results of polysaccharides in Prunella Vulgaris Linn(n=3)
3 结论
本实验采用苯酚-硫酸法测定夏枯草多糖中的糖含量,该方法的依据是多糖在浓硫酸作用下水解生成单糖,并迅速脱水生成糖醛衍生物,然后与苯酚浓缩合成橙黄色化合物,反应过程中颜色稳定,在波长490 nm处和一定浓度范围内,其吸光度与样品中多糖含量成正比,符合朗伯-比尔定律,从而可以采用分光光度计测定其吸光度,并利用标准曲线定量测定样品中的多糖含量。并且本实验还通过精密度、稳定性、重现性和加样回收率等试验来验证了苯酚-硫酸比色法测定夏枯草中多糖糖含量的准确可靠性及简便快捷性,确定了一种简便可行的测定夏枯草多糖含量的方法。
实验过程中发现夏枯草多糖水提液应尽可能当天浸提当天测定,因为水提液放置时间过长会被外界环境中微生物分解,从而含量降低,影响测定结果。此外因为植物多糖的单糖组成比较复杂,不同单糖的标准曲线斜率不同,所以用葡萄糖作标准曲线会引起系统误差,故实验过程中采用精制夏枯草多糖计算换算因子,以避免这种系统误差,所测结果明显高于不使用校正因子所得的结果。
夏枯草分布广泛,资源丰富,化学成分复杂,药理作用广泛,有重要的临床应用价值和开发利用价值,是一种有潜力的药物资源。夏枯草多糖具有良好的抗氧化性能,根据自由基理论,应具有开发为功能性食品的潜在价值[17]。相信随着研究的不断深入,夏枯草将在药理学、饮品及保健品行业发挥越来越重要的作用。
:
[1]中科院中国植物志编委会.中国植物志[M].第1版.北京:科学出版社,1977:386
[2]国家药典委员会.中华人民共和国药典[M].2000年版.北京:化学工业出版社,2000:232
[3]徐仲仙,周菁齐,徐声林,等.近年夏枯草化学成分和生物活性研究概况[J].中成药,1996,18(11):42-42
[4]谭慧子,聂少平.夏枯草研究概述[J].江西食品工业,2008(2):38-41
[5]WANG Zhuju,ZHAO Yuying,WANG Bin,et al.Depsides from Prunella vulgaris[J].Chinese chemical lettes,2000,11(11):997-1000
[6]WANG Zhuju,ZHAO Yuying,WANG Bin,et al.A New Phenylpropanoid from Prunella vulgaris[J].Journal of Chinese pharmaceutical sciences,2000,9(3):128-130
[7]HISASHI K,HIDEO T,SHIGEKI S,et al.Two novel hexacyclic triterpenoids from Prunella vulgaris[J].Phytochemistry,1988,27(9):2921-2925
[8]张瑞.夏枯草多糖对H IV-1感染者PBMC细胞因子水平及细胞凋亡影响的实验研究[J].河南中医学院学报,2005,20(1):9-10
[9]陈鼎祺.夏枯草治疗高血压及防治动粥样硬化[J].中医杂志,1999,40(8):453
[10]Sun Hongxiang,Qin Feng,Pan Yuanjiang.In vitro and in vivo mmunosupp ressive activity of Spica Prunellae ethanol extract on the immune responses in mice[J].Journal of ethnopharmacology,2005,101(10):31-36
[11]XU Hongxi,Lee S H,Lee S F,et a1.Isolation and characterization of an anti-HSV polysaccharide from Prunella vulgaris[J].Antiviral-Res,1999,44(1):43
[12]RYU S Y,OAK M H,YOON S K,et al.Anti-allergic and anti-inflammatory triterpenes from the herb of Prunella vulgaris[J].Planta Med,2000,66(4):358-360
[13]王华付.黄芪中黄芪多糖含量的测定 [J].安徽农业科学,2007,35(34):10948-11021
[14]李佳凤,易春艳,余爱农,等.南瓜水溶性多糖的含量测定[J].食品研究与开发,2006,27(4):132-133
[15]张彦民,李宝才,朱利平,等.多糖化学及其生物活性研究进展[J].昆明理工大学学报:理工版,2003,28(3):140-145
[16]傅博强,谢明勇,聂少平,等.茶叶中多糖含量的测定[J].食品科学,2001,22(11):69-72
[17]张德华.夏枯草多糖的分离纯化与抗氧化活性研究[J].云南植物研究,2006,28(4):410-414
