残胃癌患者预后影响因素分析
2013-09-05李成林
李成林
(江苏省金坛市中医院,江苏金坛 213200)
残胃癌(GSC)是指在胃部良性疾病(胃溃疡、息肉)行胃切除手术5年后残胃发生的癌症。据文献报道GSC的发生率占所有胃癌的3%~10%[1]。与GSC发生相关的危险因素包括胃切除后引起的胃十二指肠反流、残余胃失神经支配后发生的功能紊乱以及手术缝线刺激与瘢痕形成等引起的肠上皮化生[2]。与普通胃癌相比,GSC确诊时多为晚期,出现相邻器官浸润以及腹膜转移,是一种预后差、治愈率低的实体肿瘤,国外统计其可切除率只有38%~40%,5年存活率仅为7%~20%[3]。GSC起病的胃内环境与普通胃癌有较大不同,其临床病理特征与预后影响因素也有差异,目前国内对残胃癌的治疗和手术方法是否与普通胃癌相同还有争议[4]。现分析我院2006年1月~2009年8月收治的100例的GSC患者的临床资料,探讨其预后相关影响因素。
1 基本资料
本组男85例,女15例。年龄54~65岁,中位年龄61岁。79例(79%)因胃溃疡接受胃大部切除术,21例(21%)因十二指肠溃疡而接受部分胃切除术。首次胃切除和发生GSC的时间间隔10~28年,平均14年。肿瘤位于胃空肠吻合处 43例(43%)、残留胃体27例(27%)、肿瘤弥漫整个残胃30例(30%)。首次手术方式:BillrothⅡ式结肠前胃空肠吻合术95例(95%),BillrothⅠ式胃空肠吻合术5例。排除标准:①发生在胃远端或中1/3以下的肿瘤(远端胃癌);②有严重的心脑血管病变,影响患者生存;③年龄>65岁。该研究获得我院伦理委员会批准,患者家属均已签署知情同意书。均行残胃全切除(含胃空肠吻合空肠和临近空肠系膜全切除,包含Ⅰ、Ⅱ站淋巴结清扫)。14例同时行邻近器官切除(肝脏1例,胰腺2例,结肠1例,脾1例),术后所有患者进行辅助性化疗(50例应用依托泊苷/亚叶酸钙/5氟尿嘧啶,32例应用紫杉醇/顺铂,18例应用吉西他滨)。
2 预后相关因素分析
采用SPSS12.0统计软件行统计学处理。随访36个月,观察终点为患者死亡或者失访,采用Kaplan-Meier法计算患者生存期。单因素分析采用Log-Rank检验,多因素分析采用COX分步回归分析。P<0.05为差异有统计学意义。
2.1 单因素分析 本组整体3年生存率为43.1%,平均存活时间为25.6个月。对GSC患者性别、肿瘤位置、肿瘤最大径、T分期、N分期、侵犯邻近空肠、术后淋巴结阳性率、侵犯神经束膜、R0切除、组织学类型与3年生存率和中位生存期的关系进行单因素分析,结果GSC患者生存率与肿瘤是否浸犯空肠、T分期、组织学类型、N分期、淋巴结阳性率、神经周围浸润、肿瘤位置、是否R0切除有关(P均<0.05)。详见表 1。
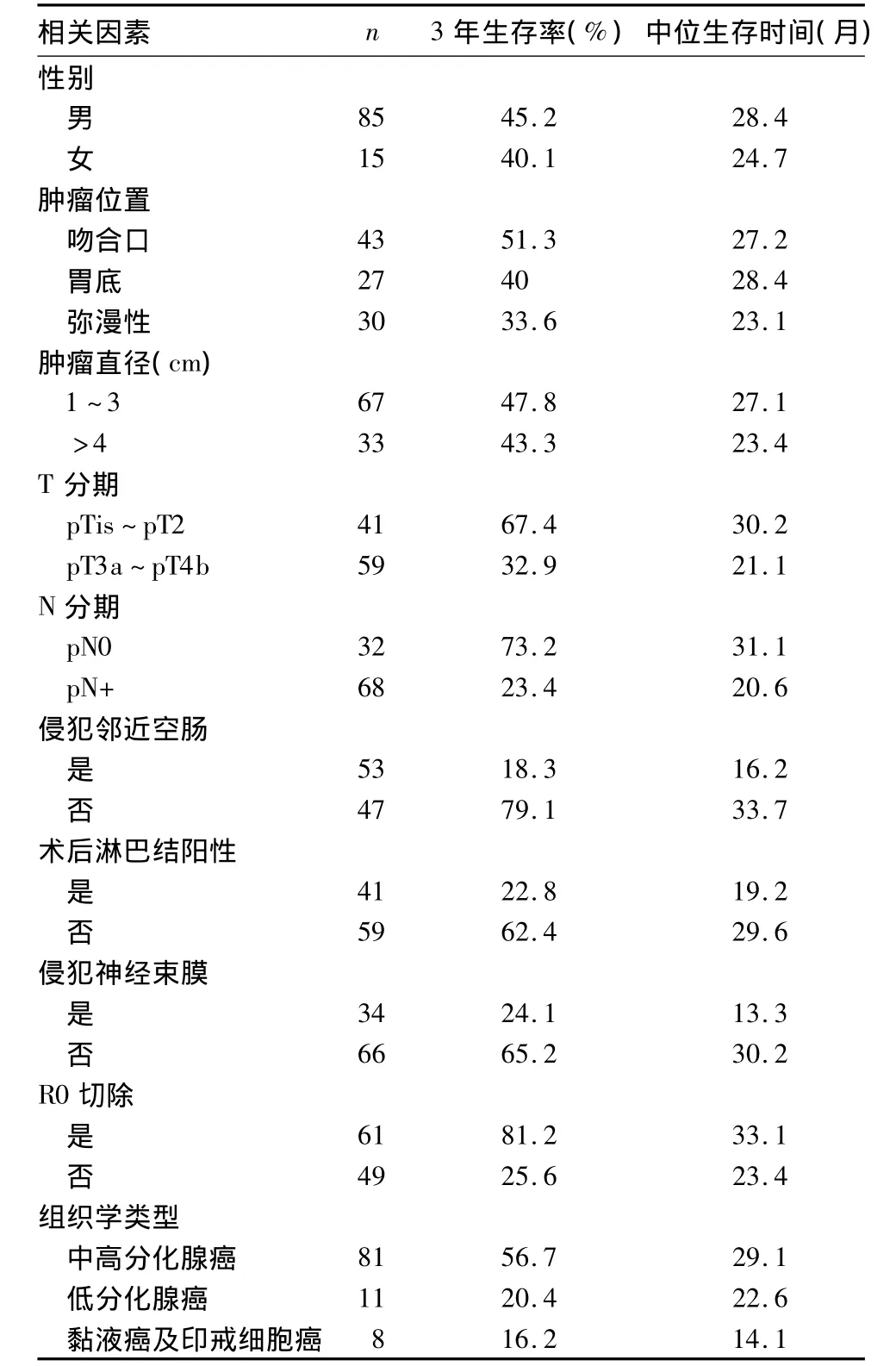
表1 影响GCS患者生存率的单因素分析结果
2.2 多因素分析 COX回归分析显示,是否浸犯空肠、T 分期(P=0.006)、组织学类型(P=0.023)、N 分期(P=0.023)、淋巴结阳性率(P=0.041)、神经周围浸润(P=0.046)是影响GSC患者生存率的影响因素。
3 讨论
GSC与近段胃癌的临床特点有相似之处,但是其病情更晚,且外科治疗效果不满意。目前国内对GSC的病理特征及预后因素的研究较少。国外普便认为GSC的发生与首次手术有关[5],接受BillrothⅡ手术者比BillrothⅠ手术者发生GSC的风险更高,前者是后者的 4 倍[6,7];提示术后胆汁、胰液、肠液等碱性液体反流造成的胃黏膜破坏可逐渐形成慢性萎缩性胃炎、肠上皮化生和不典型增生,最终可能导致GSC。GSC的潜伏期较长(20~30年),而我国在上世纪90年代常采用手术治疗胃溃疡,因此近20年内GSC病例数可能会进一步上升。多数GSC病例为男性,与男性胃十二指肠溃疡的发病率高于女性有关。GSC确诊时患者往往超过60岁,多为67~71岁。GSC的治疗原则为以手术切除为主,辅以化疗、放疗等综合治疗,与原发性胃癌基本一致。GSC的5年生存率为7%~40%。GSC与普通胃癌在术后病理和预后影响因素上有很多不同点。①由于首次手术操作造成残胃的淋巴引流及解剖学改变,使GSC的淋巴转移具有与普通胃癌不同的途径,表现在胃周围淋巴结转移率很高(这与普通胃癌相似),同时淋巴液还可以流向空肠系膜、下隔膜引起远处转移。文献报道空肠系膜中淋巴结转移的发生率为17%~52%[8]。本研究中我们观察到了同样的现象,33例有空肠系膜淋巴结转移。由于GSC有新的淋巴结转移途径,因此术者对残胃切除术后异常淋巴引流要有清醒的认识,不能完全依照胃癌的方式进行常规D2手术,而应在合理范围(包括肠系膜、纵隔的淋巴结)进行清扫及手术切除。淋巴结阳性率是指阳性淋巴结占切除淋巴结的比例,是影响GSC预后的重要预测因素。一般来说术后淋巴结阳性率小于20%才认为是充分彻底清扫了淋巴结,这需要在手术中切除肿瘤周围至少15个淋巴结以上。本组GSC患者3年存活率为43.1%,当淋巴结阳性率大于20%时,5年存活率均为下降到22.8%。以上结果显示需大范围切除淋巴结(包括胃周、空肠系膜、脾动脉和脾门)方能降低这些区域的转移。②GSC的一个重要特征是肿瘤会浸犯邻近的空肠。Tanigawa等[9]和 Oheama等[10]报道的GSC空肠浸犯率达到了53%与31%,而普通胃癌一般不会侵犯空肠。肿瘤对空肠浸犯会使GSC病例预后更差。因此在手术过程中切除吻合附近的空肠系膜及淋巴结,会改善肿瘤分期,提高患者的生存率。
研究发现,GSC患者的预后还会受到T分期的影响,这是因为GSC患者胃壁或邻近器官浸润程度更高。本组T1或T2期的GSC患者3年存活率为67%,但 T3、T4 期患者仅为 32%。Hoteva等[11]报道早期GSC病例3年存活率为69%。因此对于部分胃切除患者在切除后第15年需接受常规内镜筛查,且每3年进行一次随访评估。
本研究结果显示,胃壁内和胃壁周围神经束膜浸润是GSC预后的影响因素。Lee等[12]认为神经束膜侵犯的发生率随胃壁肿瘤浸润程度逐渐提高,Katsios等[13]认为,胃癌伴随神经周围浸润者预后差且神经周围浸润是胃癌的预后的影响因素,神经周围浸润者(特别是组织学检验确诊的病例)局部肿瘤复发率提高。本研究有神经周围浸润者3年存活率为24%(平均存活时间为13个月),而没有神经周围浸润者3年存活率为65%。肿瘤切除后没有大体或微观残余肿瘤(R0)是所有胃癌的治疗目标。如果达到R0切除,GSC病例3年存活率为81%。在未完全肿瘤切除(R1或R2)GSC病例中,3年存活率仅为25%,鉴于此,我们认为R0切除应该是残胃完全切除,这是因为残胃在体内出现反复炎症、增生,最终有可能再次转化为肿瘤。
综上所述,残胃癌在手术后由于改变了正常的解剖学特点,因此与胃癌具有不同的转移规律,术者应考虑胃切除术后上述异常淋巴引流及恶性行为的特殊性(空肠侵犯),进行合理范围的淋巴结清除及手术切除。除此之外,临床上还应充分认识胃切除术后发生残胃癌的可能性,对胃手术后患者进行长期随访,提高残胃癌的早期诊断率。
[1]Ferretti S,Gafa L.Upper gastrointestinal tract cancers:oesophagus,stomach,liver,gallbladder and biliary ducts,pancreas[J].Epidemiol Prev,2009,28(4):34-42.
[2]Coney DA,Kubo A.Influence of site classification on cancer incidence rates:an analysis of gastric cardia carcinomas[J].J Natl Cancer Inst,2004,96(3):1383-1387.
[3]Marchet A,Mocellin S,Ambrosi A,et al.The ratio between metastatic and examined lymph nodes(N ratio)is an independent prognostic factor on gastric cancer regardless of the type of lymphadenectomy[J].Ann Surg,2012,245(23):543-552.
[4]Han SL,Hua YW,Wang CH,et al.Metastatic pattern of lymph nodeand surgery for gastric stump cancer[J].J Surg Oncol,2008,82(4):241-246.
[5]Moue K,Nakane Y,Iiyama H,et al.The superiority of ratiobased lymph node staging in gastric carcinoma[J].Ann Surg Oncol,2002,9(4):27-34.
[6]Talamonti MS,Kim SP,Yao KA,et al.Surgical outcomes of patients with gastric carcinoma:the importance of primary tumor location and microvessel invasion[J].Surgery,2011,134(13):720-727.
[7]Yokota T,Ishiyama S,Saito T,et al.Lymph node metastasis as a significant prognostic factor in gastric cancer:a multiple logistic regression analysis[J].Scand J Gastroenterol,2004,39(4):380-384.
[8]Ohashi M,Katai H.Fukagawa T,et al.Cancer of the gastric stmnp following distal gastrectomy for cancer[J].Br J Surg,2007,94(1):92-95.
[9]Tanigawa N,Nomura E,Lee SW,et al.Current state of gastric stump carcinoma in Japan:based on the results of a nationwide survey[J].World J Surg,2010,34(7):1540-1547.
[10]Oheama S,Tokunaga M,Hiki N,et al.A clinicopathological stude of gastric stump carcinoma following proximal gastrectomy[J].Gastric Cancer,2009,12(2):88-94.
[11]Hoteva S,Iizuka T,Kikuchi D,et al.Clinical advantages of endoscopic submucosal dissection for gastric cancers in remnant stomach surpass conventional endoscopic mucosal resection[J].Dig Endosc,2010,22(1):17-20.
[12]Lee JY,Choi IJ,Cho SJ,et al.Endoscopic submucosal dissection for metachronous tumor in the remnant stomach after distal gastrectomy[J].Surg Endosc,2010,24(6):1360-1366.
[13]Katsios CS.Metachronous cancer in the stomach remnant[J].World J Surg,2011,35(2):465-466.
