牦牛血粉制备氯化血红素工艺优化研究
2013-09-04高子涵张卫兵高维东李晓鹏刘兴龙
高子涵,张卫兵,* ,梁 琪,杨 敏,张 炎,高维东,李晓鹏,刘兴龙
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.甘肃省功能乳品工程实验室,甘肃兰州730070;3.甘肃农业大学理学院,甘肃兰州730070)
牦牛是青藏高原特有的优势畜种,具有极强的抗逆性、抗病性、耐受性和适应性。全世界现有牦牛约1500万头,中国是牦牛的主产国,占世界总数的92%左右,主要分布于西藏、四川、青海、甘肃、新疆等省区[1-2]。目前,对于牦牛肉、乳的利用较为充分,而牦牛血液由于腥味较重、适口性差,因而利用率不高。牦牛血液中血红蛋白(Hb)含量很高,达到(86.41±13.07)g/L,全血铁的含量为(28.95±4.37)mmol/L,高于猪血液中的含量[3],因而牦牛血是制取血红素类产品的天然优质资源,加以利用后能够产生巨大的经济效益和社会效益[4-5]。血红素(heme)是血红蛋白分子的辅基,在干燥的固体状态下较稳定,但在光照或有氧化剂存在下极不稳定,会很快被氧化[6-7]。当血红素与珠蛋白脱离后亚铁自动氧化成三价铁,所以从动物血液中得到的血红素产品一般是氯化高铁血红素(简称氯化血红素,Hemin)。氯化血红素是吸收率最高的生物态铁剂,具有无体内铁蓄积中毒、不受膳食因素的影响、不会产生消化道刺激症状等特点,已经成为比较理想的抗贫血药[8-9],并且其药理已被临床证实。美国FDA 于1983年7月正式批准氯化血红素作为药品使用。同时,氯化血红素在医药行业中已被广泛应用于血卟啉及其衍生物的制备[10]。目前已有的报道大多都是以动物血液为原料制备氯化血红素,其方法主要有酸性丙酮法、羧甲基纤维素法和冰醋酸法等。但由于新鲜血液不易运输和贮藏,以其为原料制备氯化血红素会使生产成本提高。本实验旨在研究以牦牛血粉为原料制备氯化血红素的工艺条件,为牦牛血粉的综合利用和氯化血红素的工业化生产提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
牦牛血粉 兰州天和生物催化技术有限公司;氯化血红素标准品 Sigma公司;其他试剂 市售,国产分析纯或化学纯。
LabTech紫外可见分光光度计 北京莱伯泰科仪器有限公司;TDD5M低速离心机 长沙平凡仪器仪表有限公司;PHS-3C型数显酸度计 上海精密科学仪器有限公司;AL204电子天平 梅特勒-托利多仪器有限公司;电热鼓风干燥器 上海一恒科学仪器有限公司;超声波清洗器 江苏昆山超声仪器有限公司。
1.2 实验方法
1.2.1 以牦牛血粉为原料制备氯化血红素的工艺 准确称取2g牦牛血粉,加入30mL 6mol/L的脲溶液中,超声处理30min后3000r/min离心10min;向上清液中加入3%酸性丙酮150mL,搅拌抽提30min,再加入3%乙酸钠11mL搅拌均匀,然后用1mol/L NaOH调节pH为7.0,3000r/min离心10min,沉淀用蒸馏水和无水乙醇洗涤后烘干,得到氯化血红素。
1.2.2 氯化血红素标准曲线制作及样品中氯化血红素的测定
1.2.2.1 标准曲线制作 氯化血红素标准品经105℃干燥至恒重,配制成不同浓度的氯化血红素溶液,在最大吸收波长390nm处测定氯化血红素标准溶液的吸光度,以氯化血红素质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
1.2.2.2 样品中氯化血红素的测定[11]取经过105℃干燥至恒重的氯化血红素样品,研成粉末;精密称取适量样品,置于100mL烧杯中,加0.1mol/L的氢氧化钠溶液溶解,将溶液转移到100mL容量瓶中,加0.1mol/L的氢氧化钠溶液至刻度,摇匀,过滤。取滤液10mL于100mL容量瓶中,用0.1mol/L氢氧化钠溶液稀释至刻度,摇匀,以0.1mol/L的氢氧化钠溶液为空白,在390nm处测定样品的吸光度。根据血红素标准曲线计算得到样品中氯化血红素的质量,计算样品中血红素的纯度。

1.2.3 单因素实验 分别选取超声处理时间(10、20、30、40、50min)、酸性丙酮加入量(90、120、150、180、210mL)、抽提时间(10、20、30、40、50min)和乙酸钠的加入量(2、5、8、11、14mL)4 个因素进行单因素实验,测定所得氯化血红素的质量并计算含量。
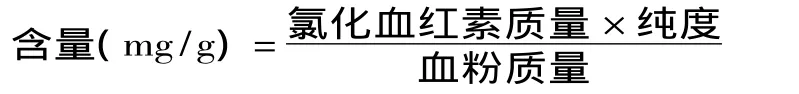
1.2.4 正交实验设计 在单因素实验的基础上,超声处理时间、酸性丙酮加入量、抽提时间和乙酸钠的加入量4个因素各取3个水平,采用L9(34)正交表进行正交实验,以进一步优化以牦牛血粉为原料制备氯化血红素的工艺参数。正交实验因素水平表见表1。
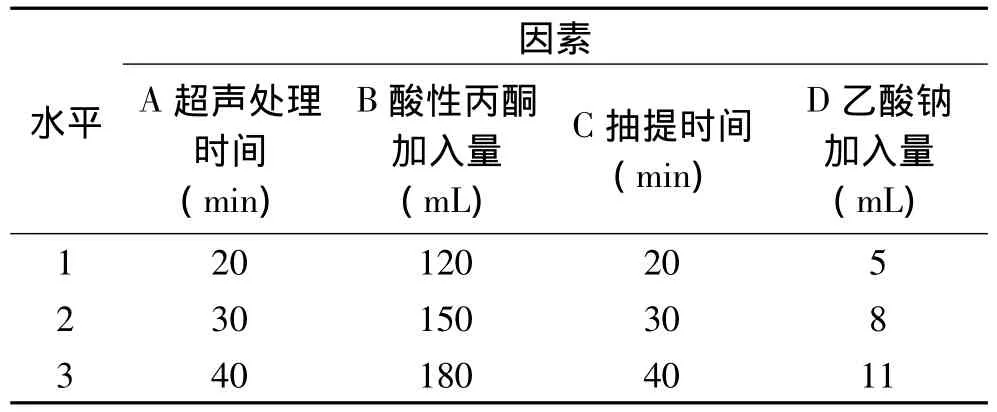
表1 正交实验因素水平表Table 1 Factors and levels of orthogonal test
2 结果与分析
2.1 单因素实验结果
2.1.1 超声处理时间对氯化血红素得率的影响 在氯化血红素的制备过程中,分别调整超声处理时间为 10、20、30、40、50min,其他条件与 1.2.1 相同,以考察不同超声处理时间对氯化血红素含量的影响,结果见图1。
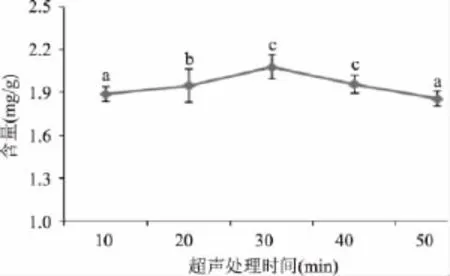
图1 超声处理时间对氯化血红素含量的影响Fig.1 The effect of ultrasonic breaking time on the yield of hemin
由图1可以看出,随着超声处理时间的延长,氯化血红素的含量先上升后下降。当超声处理时间从10min增加到30min时,氯化血红素的含量逐渐增加,当超声处理时间为30min时,含量达到最高,为2.08mg/g。当处理时间超过30min以后,氯化血红素含量逐渐降低,这是因为超声处理时间过长时,释放出大量的声波,温度升高幅度过大,使血粉中的蛋白质变性,其中结合的氯化血红素难以释放,从而影响氯化血红素的产量[11]。
2.1.2 酸性丙酮加入量对氯化血红素得率的影响在氯化血红素的制备过程中,分别调整酸性丙酮加入的量分别为 90、120、150、180、210mL,其他条件与1.2.1相同,以考察不同酸性丙酮加入量对氯化血红素含量的影响,结果见图2。
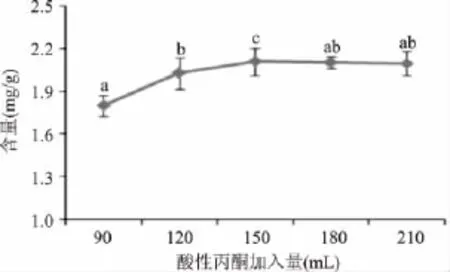
图2 酸性丙酮加入量对氯化血红素含量的影响Fig.2 The effect of the amount of acetone acidified on the yield of hemin
氯化血红素易溶于酸性丙酮液,这是采用酸性丙酮法制备氯化血红素的基本原理,酸性丙酮液的加入量对于氯化血红素从蛋白中的解离影响较大[12]。由图2可以看出,当酸性丙酮加入量由90mL增加到150mL时,氯化血红素的含量逐渐增加,当酸性丙酮加入量为150mL时,氯化血红素含量达到最高(2.11mg/g)。当酸性丙酮加入量超过150mL以后,氯化血红素含量增速减缓,加入量为210mL时,含量反而降为2.10mg/g。由于生产中要节约成本,应该选择的酸性丙酮加入量为150mL。
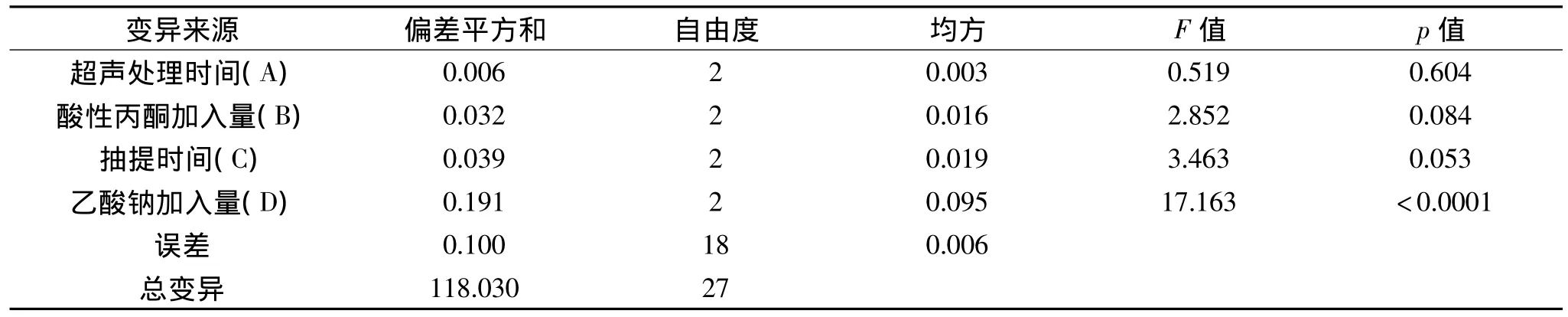
表3 正交实验方差分析表Table 3 The variance analysis of orthogonal test
2.1.3 抽提时间对氯化血红素得率的影响 在氯化血红素的制备过程中,分别调整加入酸性丙酮后抽提时间为 10、20、30、40、50min,其他条件与 1.2.1 相同,以考察不同抽提时间对氯化血红素含量的影响,结果见图3。
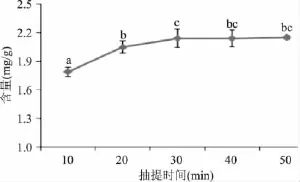
图3 抽提时间对氯化血红素含量的影响Fig.3 The effect of the extraction time on the yield of hemin
由图3可以看出,随着抽提时间的延长,氯化血红素的含量逐渐增加。当抽提时间由10min增加到30min时,氯化血红素的含量逐渐增加。当抽提时间为30min时,氯化血红素的含量最高(2.14mg/g)。而当抽提时间超过30min时,抽提时间对氯化血红素含量的影响逐渐变小,含量增加缓慢,抽提时间为50min时,含量仅增加0.01mg/g。由于生产中要尽量缩短生产周期,所以选用的抽提时间为30min。
2.1.4 乙酸钠加入量对氯化血红素得率的影响 乙酸钠是氯化血红素提取时的沉淀剂,可以使溶液中氯化血红素沉淀下来。在氯化血红素的制备过程中,分别调整乙酸钠的加入量为 2、5、8、11、14mL,其他条件与1.2.1相同,以考察不同乙酸钠加入量对氯化血红素含量的影响,结果见图4。
由图4可以看出,随着乙酸钠加入量的增加,氯化血红素的含量先增加后降低。当乙酸钠加入量由2mL增加到8mL时,氯化血红素的含量增加显著(p<0.05)。当乙酸钠加入量为8mL时,氯化血红素的含量达到2.18mg/g。而当乙酸钠加入量大于8mL时,氯化血红素含量有所下降。因为随着乙酸钠加入量的增加,开始会有更多的氯化血红素沉淀出来,但当乙酸钠的加入过量时,不溶解的乙酸钠会混入氯化血红素,降低产品的纯度[13]。由于生产中要尽量节约成本,所以选用的选用乙酸钠加入量为8mL。
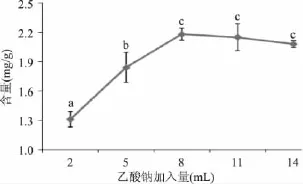
图4 乙酸钠加入量对氯化血红素含量的影响Fig.4 The effect of the amount of sodium acetate on the yield of hemin
2.2 正交实验结果
2.2.1 正交实验结果直观分析 根据单因素实验的结果,以氯化血红素含量为指标,4个因素各取3个水平,采用L9(34)正交表进行正交实验,每组实验重复3次,正交实验结果和方差分析分别见表2和表3。
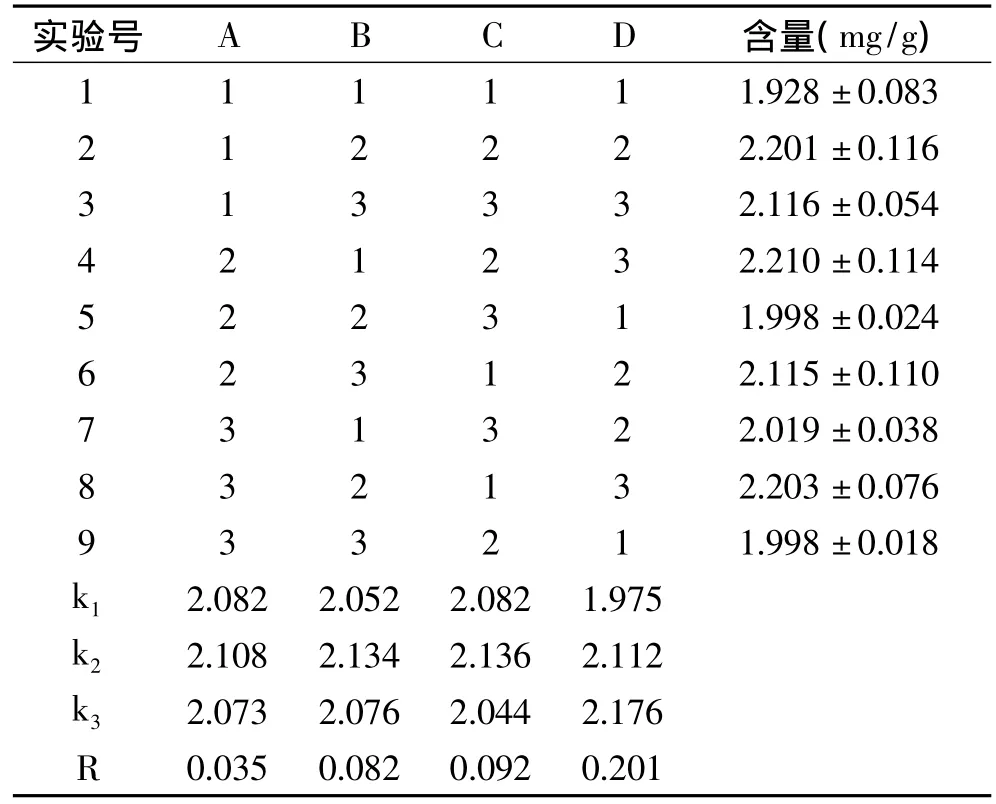
表2 正交实验结果Table 2 The results of orthogonal test
由表2可以看出,四个因素对产量的影响作用由大到小依次为:乙酸钠加入量>抽提时间>酸性丙酮加入量>超声处理时间。同时得到制备氯化血红素的最优参数组合为A2B2C2D3,即超声处理时间30min,酸性丙酮加入150mL,抽提时间30min,乙酸钠加入量为11mL。同时,由表3的方差分析结果可以看出,乙酸钠加入量对氯化血红素含量的影响极显著(p<0.0001),抽提时间对氯化血红素含量的影响较显著(p=0.053),而酸性丙酮加入量和超声处理时间对氯化血红素含量的影响不显著(p>0.05)。
2.2.2 验证实验结果 由于最优组合不包含在正交实验表中,为了进一步验证实验结果,在最优组合A2B2C2D3对应的条件下进行验证实验,重复3次。结果表明,在此条件下,氯化血红素的含量达到2.30mg/g,比正交实验中任何一种组合的含量都高,说明正交实验确定的工艺参数是可靠的。因此,实验最终确定的最佳工艺参数为超声处理时间30min、酸性丙酮加入量150mL、抽提时间30min、乙酸钠加入量11mL。
3 结论
采用单因素实验,对牦牛血粉制备氯化血红素的4个因素(超声波处理时间、酸性丙酮的添加量、提取的时间、乙酸钠的添加量)进行初步研究。在此基础上,采用L9(34)正交实验进一步优化,得到的最优制备工艺参数为:超声处理时间30min,酸性丙酮加入 150mL,抽提时间 30min,乙酸钠加入量为11mL。在此条件下,氯化血红素的含量为2.30mg/g。
[1]何如喜.牦牛血液资源利用技术的可行性研究[J].中国资源综合利用,2006,24(12):11-13.
[2]牛春娥,张利平.我国牦牛资源现状及其产品开发利用前景分析[J].安徽农业大学,2009,37(17):8003-8005.
[3]卢福山,张才俊.高原型牦牛8项血液指标的测定[J].青海畜牧兽医杂志,2006,36(4):3-4.
[4]吴海玥,靳义超,胡勇.牦牛血液中高纯度血红素的提取实验研究[J].青海畜牧兽医杂志,2011,41(5):25-27.
[5]刘振斌,张珍,张盛贵,等.CMC-Na法提取牦牛血红素的工艺研究[J].甘肃农业大学学报,2012,47(4):143-146.
[6]Lebrun F,Bazus A.Solubility of heme in heme-iron enriched bovine hemoglobin hydrolysate[J].Journal of Agricultural and Food Chemistry,1998,46:5017-5025.
[7]刘宝岩,张翼,李法庆.一种从牦牛血中提取血红素的方法[P].中国:CN201110119384.5,2011-5-10.
[8]刘娅,韩新年.天然补铁剂-血红素铁的研究进展[J].中国食品添加剂,2005(4):5-8.
[9]尹兆明,段黎萍,杨勇.从动物血液中提取血红素的方法[P].中国:CN01102839.4,2001-2-7.
[10]王君,陈红亮,张向东,等.氯化血红素提取新工艺[J].当代化工,2001,30(3):126-127.
[11]马永征,宋宏新,李敏康.氯化血红素提取中超声波细胞破碎条件的研究[D].西安:陕西科技大学,2005.
[12]刘任民,范万东,王摇风,等.猪血中高纯度血红素的提取工艺[J].现代医药卫生,2007,23(18):2687-2689.
[13]葛静微,罗均,李小定,等.响应面分析法优化血红素提取工艺[J].食品科学,2010,31(8):60-64.
