响应面法优化热水浸提灰树花多糖的工艺研究
2013-09-04顾华杰李良智王桃云胡翠英袁红霞
顾华杰,孙 燕,李良智,王桃云,胡翠英,袁红霞
(苏州科技学院化学生物与材料工程学院,江苏苏州215009)
灰树花(Grifola frondosa)是一种重要的食药用真菌,其子实体富含氨基酸、多糖、微量元素等多种营养成分。经研究发现,多糖是其中最主要的一类生物活性成分[1]。灰树花多糖(Griflola frondosas polysaccharides,GFP)是一类生物大分子,富含 β-1,6-及 β-1,3-糖苷键[2],具有显著的免疫调节[3-4]、抗肿瘤[5-6]、抗病毒[7-8]及抗糖尿病[9-10]等效果,对防治高血压、高血脂、肥胖症、肝脏疾病也有一定的疗效[4],且无毒副作用[11]。多糖提取的方法很多,如热水浸提法、酸提法、碱提法、酶解法、超声波辅助法、微波法、超临界流体萃取法等[12]。酶、超声波、微波、超临界流体萃取等新技术的运用虽然可以提高多糖的得率,但是成本较高,同时也缺乏大型的可用于工厂化生产的超声或微波设备,因此,这些新技术大都仍处于实验室研究改进阶段,实际应用中仍以水提法、酸提法、碱提法等传统工艺为主。稀酸和稀碱可促进细胞破碎,释放多糖,但也易使多糖的糖苷键断裂,形成较多的单糖而使多糖的提取率降低,并对设备造成腐蚀。热水浸提法不需要特殊的设备,应用最多,但耗时较长,提取率不高[13-14]。因此,在开发新技术将其应用于实际生产的同时,改进传统工艺、提高产率也是一个重要的方面。相对于正交实验法从固定的几组实验条件中选择出最佳工艺[15],响应面法(Response Surface Methodology,RSM)能建立二次多项式模型拟合因素与响应值之间的函数关系,研究各因素之间的相互作用,及各因素对响应值的影响,在整个区域内找到各因素的最佳组合及最优的响应值,可大大降低生产实践过程中的原料和能源浪费[16-17]。RSM 一 般包括三个步骤:首先利用Plackett-Burman设计以较少的实验次数从众多因素中快速地筛选出对响应值影响显著的因素[18],然后采用最陡爬坡实验使各因素快速有效地逼近最佳响应区域[18],最后通过 Box-Behnken设计拟合出因素和响应值的多元二次方程,通过对回归方程分析寻求最优工艺[19]。目前,RSM在食品、医药、生物等领域已有广泛应用,在生物过程优化中主要用于培养条件和提取工艺的优化[20]。柯志等利用响应面法优化了嗜热厌氧代谢工程菌发酵产乙醇的培养基[21]。张花利等利用响应面法优化了乙醇提取黑豆皮中黄铜的工艺[22]。鉴于此,本研究运用RSM对热水浸提灰树花多糖的工艺进行优化,为更好地开发利用灰树花多糖提供支持。
1 材料与方法
1.1 材料与仪器
灰树花子实体干品 福建省古田县江艳霞食用菌经营部,高速万能粉碎机粉碎后,过300μm筛,得子实体干粉,用索氏抽提法脱脂肪[23]。
FW100型高速万能粉碎机 天津市泰斯特仪器有限公司;FA2004型电子分析天平 上海恒平科学仪器有限公司;HH-S21-8-S水浴锅、DFZ-6050型真空干燥箱 上海新苗医疗器械制造有限公司;DL-5-B离心机 上海安亭科学仪器厂;TU-1901双光束紫外可见分光光度计 北京普析通用仪器责任有限公司。
1.2 实验方法
1.2.1 多糖提取
1.2.1.1 提取过程 参考文献[14]。取脱脂肪的子实体干粉→加入蒸馏水→热水浴浸提→离心(5000r/min,10min)取上清液→测定多糖含量,计算多糖得率。
1.2.1.2 提取次数的单因素实验 取子实体干粉,在料液比1∶20、pH6.0、浸提温度50℃、浸提时间 2h的条件下,进行热水浸提,离心得上清液,测定多糖含量,计算多糖得率。然后将离心后的沉淀物在相同条件下再浸提3次,分别测定各次浸提液的多糖含量。
1.2.1.3 Plackett-Burnman设计[18]选择最佳的提取次数,利用Design-Expert 7.0.0软件进行Plackett-Burnman设计,考察浸提温度、浸提时间、料液比、pH对粗多糖得率的影响,通过软件分析找出具有显著影响的主要因素。
1.2.1.4 最陡爬坡实验[18]根据 Plackett-Burnman实验结果设计主要因素最陡爬坡实验的变化方向和步长。其中,有显著正效应的因素,数值应增大;有显著负效应的因素,数值应减小。影响较大的因素,数值变化的步长应较小;影响较小的因素,步长应适当增大。
1.2.1.5 Box-Behnken设计[19]根据最陡爬坡实验结果,确定主要因素的水平,利用Design-Expert 7.0.0软件进行Box-Behnken设计,通过建立二次多项式模型确定最佳条件和最优得率,并进行验证实验。
1.2.2 多糖纯化[14]合并粗多糖提取液→离心(5000r/min,10min)取上清液→真空干燥仪浓缩至原体积的1/5→加入1/2体积 Sevage试剂(V氯仿∶V正丁醇=4∶1)去蛋白3次→50℃水浴脱色4h,其中一半用过氧化氢氧化法脱色,另一半用活性炭吸附法脱色[24]→加入4倍体积的无水乙醇沉淀多糖(4℃静置12h)→离心(5000r/min,10min)取沉淀→无水乙醇洗涤沉淀3次→干燥→得水溶性粗多糖。
分别测定粗多糖提取液、浓缩后、脱蛋白后、脱色后和醇沉后的多糖含量,根据溶液体积换算为多糖质量,计算回收率。其中,由于脱色时分为两份,分别用两种方法进行,所以每种方法得到的多糖质量都乘以2后再计算回收率。
1.2.3 多糖测定 分别用苯酚-硫酸法和3,5-二硝基水杨酸(DNS法)测定多糖溶液中的总糖含量和还原糖含量[25],按以下公式计算多糖得率。
多糖得率(%)=(总糖含量-还原糖含量)×多糖溶液体积/子实体干重×100
1.3 数据处理
每个实验都进行三次重复,实验数据均以平均值±标准差表示。采用Design-Expert 7.0.0软件进行数据分析、统计及作图[26]。
2 结果与分析
2.1 提取次数的单因素实验
将提取次数单独进行单因素实验的原因是:第一、由预实验发现,提取次数对多糖得率的影响远远大于其他因素,但这实际是由测定误差造成的。随着提取次数的增加,浸提液体积成倍增加,特别是对于浸提次数多、料液比大的实验组,其浸提液体积远远大于浸提次数少、料液比小的实验组。这样一方面由于体积增大,使多糖被稀释,造成多糖含量测定的误差,另一方面大体积往往是小体积的几倍甚至十几倍,而其测得的多糖浓度并未成比例减少,因此体积越大计算得到的得率越高,掩盖了其他因素的效应。第二、提取次数是整数,而响应面法得到的结果一般都是非整数,因此用响应面法优化得到的提取次数并无实际操作意义。
图1中,根据前两次多糖得率之和与四次多糖得率总和之比可以看出前两次提取得到的多糖占四次提取多糖总量的90%以上,第3和第4次提取的多糖得率明显降低。虽然随着提取次数的增加,总的多糖得率会相应增大,但是较多的提取次数对于实际生产来说并不经济。因此,随后的实验都选择浸提次数为两次。

图1 提取次数对多糖得率的影响Fig.1 Effect of different times of extraction on the yield of GFP
2.2 Plackett-Burnman 设计
Plackett-Burnman实验的结果和分析见表1~表3。从表2的方差分析中可以看出实验模型的p值=0.0206<0.05,表明该模型具有显著性,拟合很好。浸提温度、浸提时间、料液比的p值都小于0.05,都显著影响多糖得率,而pH的p值大于0.05,对多糖得率无显著影响。从表3的显著性分析中也可以看出浸提温度、浸提时间、料液比的贡献率均超过20%,三个因素的累积贡献率将近75%,为主要影响因素。这与其他研究从单因素实验中选择出的进行正交实验或响应面分析的因素是一致的[27-28]。其中浸提温度的效应值为6.17,表明其为正效应因素,浸提时间和料液比的效应值分别为-5.47和-5.49,都是负效应因素。从p值、贡献率和效应值的大小都可以看出,这三个因素对多糖得率的影响大小为浸提温度>料液比>浸提时间。

表1 Plackett-Burnman设计及实验结果Table 1 Design and results of the Plackett-Burnman experiment
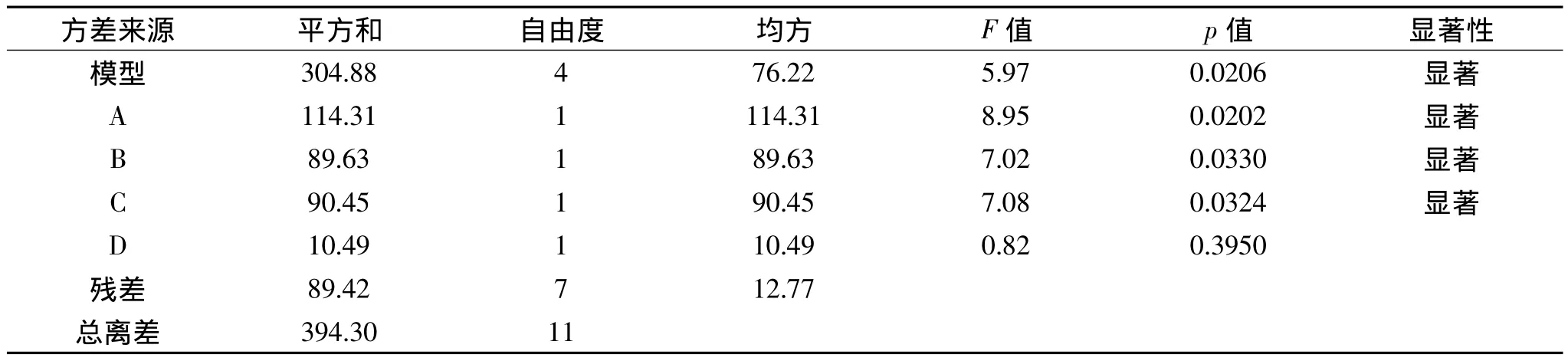
表2 Plackett-Burnman实验模型方差分析Table 2 ANOVA for Plackett-Burnman experiment model
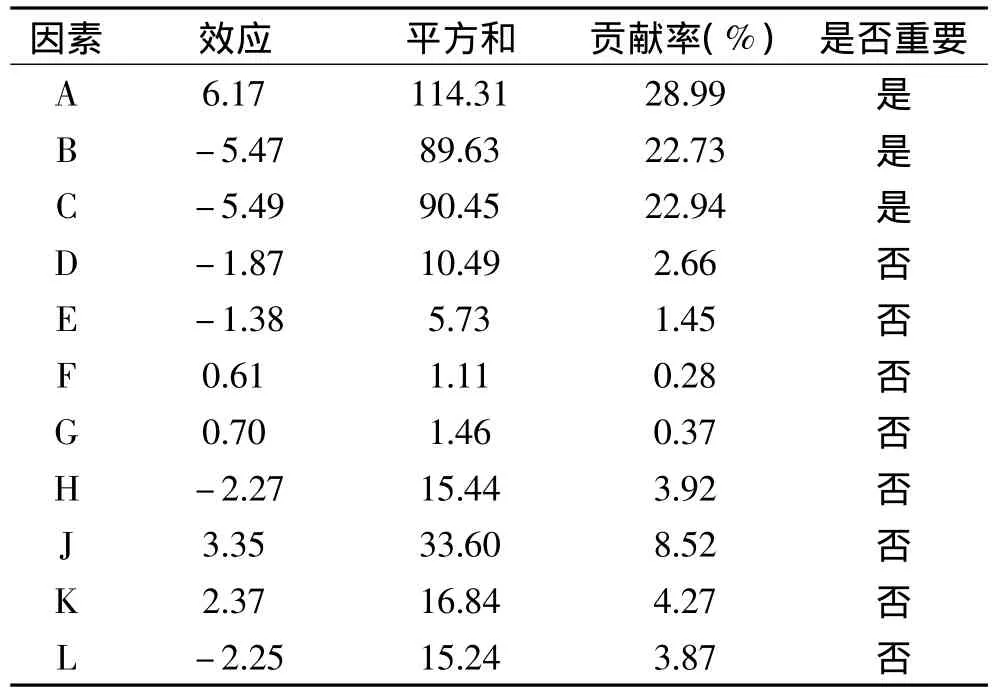
表3 影响因素的显著性分析Table 3 The significance analysis of impact factor
2.3 最陡爬坡实验
根据Plackett-Burnman实验结果,选择浸提温度、浸提时间、料液比这三个主要影响因素进行最陡爬坡实验,pH对结果无显著影响,选用中间值pH6。通过分析预实验结果,调整实验设计,最终方案为:浸提温度逐步升高,步长为5℃,而浸提时间逐步缩短,步长为0.5h,料液比也逐渐降低,步长为5mL。结果如表4所示,发现第4组实验条件下多糖得率最高,说明其比较接近最大响应值区域,因此选择这组条件(85℃,2.5h,1∶25)作为随后的 Box-Behnken 设计的中心点,进一步优化。
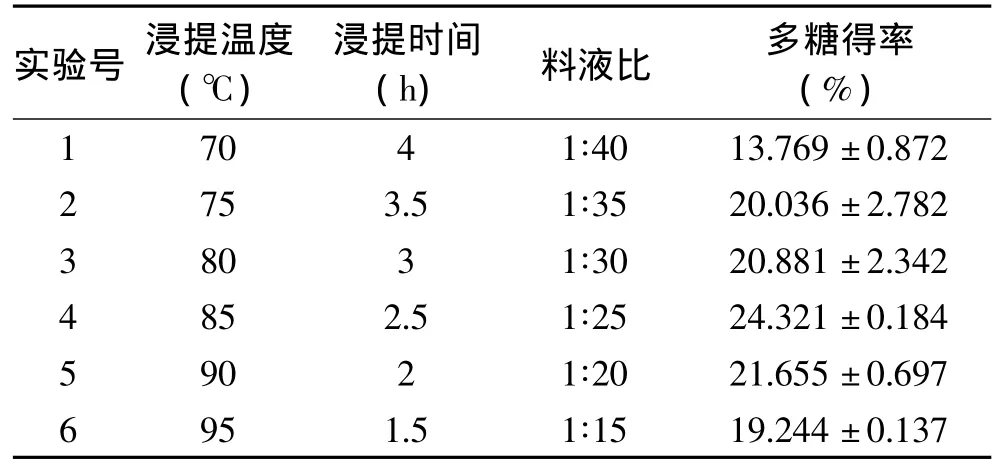
表4 最陡爬坡实验设计及结果Table 4 Design and results of the steepest ascent experiment
2.4 Box-Behnken设计
Box-Behnken实验的结果和分析见表5~表7。可以看出,模型的p值<0.0001,极显著,而失拟项的p值=0.5856>0.1,不显著,模型的 R2=0.9991,且R2校正值与R2预测值非常接近,说明模型拟合程度高,相关性很好,可用于灰树花菌丝体多糖热水浸提法的预测。通常情况下变异系数(C.V.)越低,实验的可信度和精确度越高,本模型的C.V.值为0.36%,表示其可信度和精确度很好。Adeq Precision用于衡量信噪比,该值大于4视为合理,本实验达到62.658,表明模型具有足够的信号来响应该设计。从表6各因素的p值可以看出,二次项(A2,B2,C2)都极显著,但一次项(A,B,C)和交互项(AB,AC,BC)均不显著。图2为软件分析得到的响应面的三维曲面图。
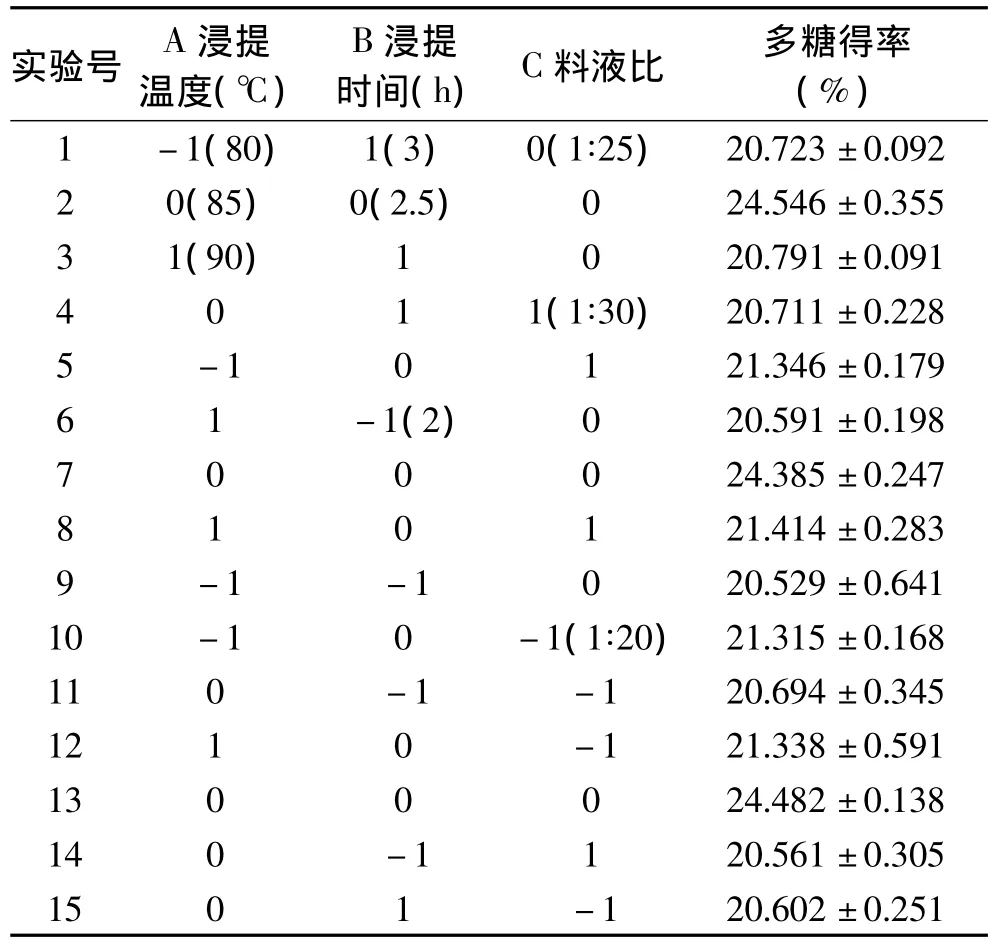
表5 Box-Behnken设计及实验结果Table 5 Design and results of the Box-Behnken experiment
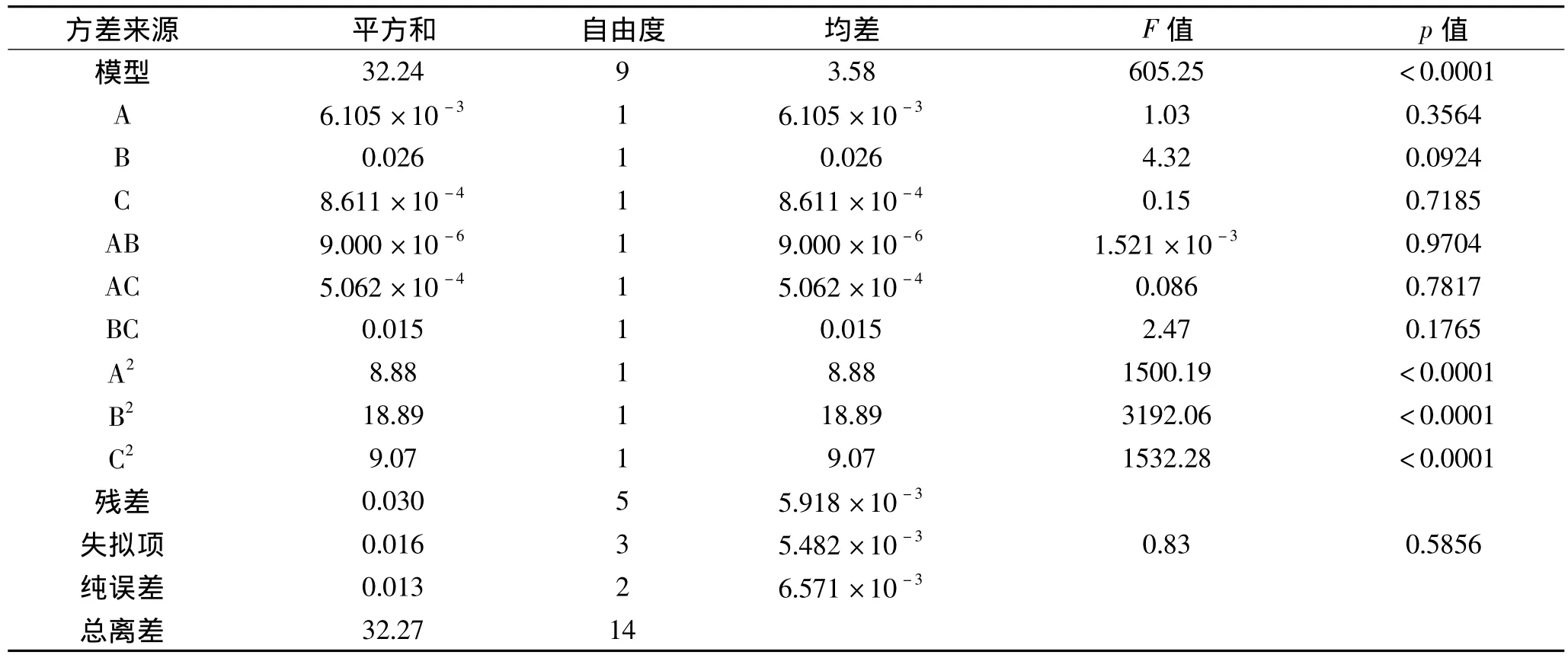
表6 Box-Behnken实验模型方差分析Table 6 ANOVA for Box-Behnken experiment model

表7 Box-Behnken实验模型的统计学分析Table 7 Statistical analysis of Box-Behnken experiment model

表8 灰树花多糖纯化的回收率Table 8 Recovery rate of GFP purification
使用Design-Expert 7.0.0对实验数据进行二次多项式拟合,得到回归方程:多糖得率=-517.592+10.537A+44.695B+3.038C+6.000 ×10-4AB+4.500×10-4AC+0.024BC-0.062A2-9.048B2-0.063C2,其中A、B、C分别代表浸提温度、浸提时间、料液比的数值。由软件求得最优条件为:浸提温度85.05℃、浸提时间2.51h、料液比1∶25.02,此时的多糖得率最高,为24.472%。在浸提温度85℃、浸提时间2.51h、料液比1∶25的条件下进行验证实验,得到多糖得率为24.423% ±0.335%,与预测值仅相差0.05%。从最优条件可以看出,浸提温度、时间和料液比都不是越大越好,这与其他很多研究的结果是一致的[27-31]。一方面,浸提温度过高、时间过长可能引起多糖分解,而料液比过大可能引起后续浓缩过程中多糖损失增大;另一方面,即使这些因素的增大可能使多糖得率略有增加,但同时也增大了提取液、能源和时间的消耗,增加了后续浓缩等工艺的成本,并不经济。
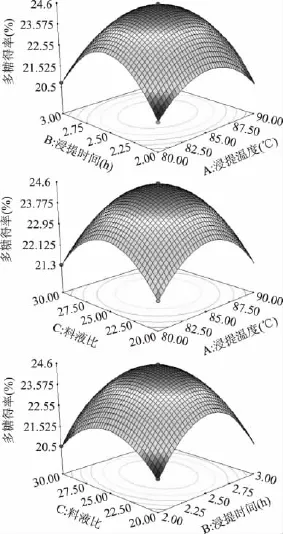
图2 浸提温度、浸提时间和料液比对灰树花多糖得率交互影响的三维曲线图Fig.2 3D surface graphs of mutual-influence for extraction temperature,time and ratio of material to liquid on the yield of GFP
2.5 多糖纯化
由表8可看出,脱蛋白和脱色步骤的多糖损失较多,导致总回收率较低。特别是活性炭吸附脱色后的回收率不到50%,这是由于活性炭对多糖也存在吸附作用[32]。过氧化氢氧化脱色过程中,其强氧化性会使多糖的羟基等活泼基团氧化,使多糖降解,从而降低多糖的回收率[32]。灰树花中的多糖多以蛋白聚糖的形式存在[2],因此脱蛋白的过程也会造成多糖的损失。
3 结论
本实验综合运用单因素实验、Plackett-Burnman设计、最陡爬坡实验和Box-Behnken设计优化了热水浸提法提取灰树花多糖的工艺。单因素实验结果显示浸提2次效果最好;Plackett-Burnman实验结果表明,影响多糖得率的主要因素依次是:浸提温度、料液比、浸提时间;最陡爬坡实验进一步接近了最佳响应区域;通过Box-Behnken设计结果的分析得出最佳提取条件是:浸提温度85℃、浸提时间2.51h、料液比1∶25,经验证实验得到多糖得率为24.423%。
通过实验证明,单因素实验、Plackett-Burnman设计、最陡爬坡实验和Box-Behnken设计相结合,能在较短时间内根据统计学分析快速找到多糖提取的关键参数,并对其进行优化,所得工艺条件比正交实验更精确。
在多糖纯化过程中,总回收率较低,主要是脱蛋白和脱色过程中多糖损失较多。因此,需从纯化效果和多糖回收率等方面对多糖纯化过程作进一步研究。
[1]Ohno N,Adachi Y,Suzuki I,et al.Characterization of the antitumor glucan obtained from liquid-cultured Grifola frondosa[J].Chem Pharm Bull(Tokyo),1986,34(4):1709-1715.
[2]李磊,王卫国,郭彦亮,等.灰树花多糖的制备及其生物活性研究进展[J].食品工业科技,2009,30(11):327-331.
[3]Wu MJ,Cheng TL,Cheng SY,et al.Immunomodulatory properties of Grifola frondosa in submerged culture[J].J Agr Food Chem,2006,54(8):2906-2914.
[4]Mayell M.Maitake extracts and their therapeutic potential-- a review[J].Altern Med Rev,2001,6(1):48-60.
[5]Yuki M,Akihisa M,Toshihiko T,et al.Characterization and antitumor effect of a novel polysaccharide from Grifola frondosa[J].J Agr Food Chem,2009,57(21):10143-10149.
[6]Fang JP,Wang Y,Lv XF,et al.Structure of a β-glucan from Grifola frondosa and its antitumor effect by activating Dectin-1/Syk/NF-κB signaling[J].Glycoconjugate J,2012,29:365-377.
[7]项哨,朱圣禾,朱永平,等.灰树花多糖在小鼠体内抗病毒作用的研究[J].浙江医科大学学报,1995,24(6):203-206.
[8]Gu CQ,Li JW,Chao FH.Inhibition of hepatitis B virus by D-fraction from Grifola frondosa:Synergistic effect of combination with interferon-in HepG2 2.2.15[J].Antivir Res,2006,72(2):162-165.
[9]Kubo K,Aoki H,Nanba H.Anti-diabetic activity present in the fruit body of Grifola frondosa(Maitake).I.[J].Biol Pharm Bull,1994,17(8):1106-1110.
[10]Lei H,Ma X,Wu WT.Anti-diabetic effect of an α-glucan from fruit body of maitake(Grifola frondosa)on KK-Ay mice[J].J Pharm Pharmacol,2007,59(4):575-582.
[11]王宝琴,徐泽平,杨传伦.灰树花菌丝体β-葡聚糖的毒理学实验[J].食品科学,2010,31(17):368-372.
[12]尹艳,高文宏,于淑娟.多糖提取技术的研究进展[J].食品工业科技,2007,28(2):248-250.
[13]徐翠莲,杜林洳,樊素芳,等.多糖的提取、分离纯化及分析鉴定方法研究[J].河南科学,2009,27(12):1524-1529.
[14]王雪冰,赵天瑞,樊建.食用菌多糖提取技术研究概况[J].中国食用菌,2010,29(2):3-6.
[15]顾华杰,沈晨斌,严志舟,等.灰树花多糖的提取及抗氧化性[J].生物加工过程,2012,10(1):19-24.
[16]Job J,Sukumaran RK,Jayachandran K.Production of a highly glucose tolerant β-glucosidase by Paecilomyces variotii MG3:optimization of fermentation conditions using Plackett-Burman and Box- Behnken experimental designs[J].World J Microb Biot,2010,26:1385-1391.
[17]Zhu CP,Liu XL.Optimization of extraction process of crude polysaccharides from Pomegranatepeelbyresponsesurface methodology[J].Carbohyd Polym,2012,92:1197-1202.
[18]Douglas C.Montgomery.实验设计与分析[M].傅珏生,张健,王振羽,等译.第六版.北京:人民邮电出版社,2009:269-272,349-354.
[19]JeffWu CF,Hamada M.实验设计与分析及参数优化[M].张润楚,郑海涛,兰燕,等译.北京:中国统计出版社,2003:366-368.
[20]田泱源,李瑞芳.响应面法在生物过程优化中的应用[J].食品工程,2010(2):8-11,53.
[21]柯志,王红,蔡友华,等.响应面法优化嗜热厌氧代谢工程菌发酵产乙醇的培养基[J].中国酿造,2011(5):59-62.
[22]张花利,冯进,董晓娜,等.黑豆皮中黄酮提取及粗提物抑菌效果研究[J].大豆科学,2011,30(3):497-501.
[23]陈钧辉,李俊,张太平,等.生物化学实验[M].第四版.北京:科学出版社,2008:32-35.
[24]宿玮,王彦超,张翠玉,等.海地瓜多糖脱色工艺研究[J].离子交换与吸附,2011,27(6):521-529.
[25]顾华杰,黄金汇,金琎,等.4种灰树花多糖测定方法的比较[J].江苏农业科学,2011,39(4):400-402.
[26]徐向宏,何明珠 .实验设计与 Design-Expert、SPSS应用[M].北京:科学出版社,2010:146-160,194-203.
[27]高娃,于德水,刘佳宁,等.桦褐孔菌子实体多糖提取研究[J].生物技术,2012,22(2):70-73.
[28]岳金玫,蒲彪,陈安均,等.响应面法优化块菌多糖的提取工艺[J].食品工业科技,2012,33(19):271-274.
[29]冮洁,刘冰.采用响应面法优化杏鲍菇菌丝体多糖提取工艺[J].食品工业科技,2012,33(9):256-259.
[30]贾媛颖,李永裕,陈建烟,等.橄榄多糖提取工艺研究[J].中国农学通报,2012,28(9):276-280.
[31]王晨瑜,张雪松,王站勇,等.血红铆钉菇多糖的优化提取研究[J].北方园艺,2013(3):155-157.
[32]高晶晶,李稳宏,李婉婷,等.款冬花多糖几种脱色工艺的研究与对比[J].中成药,2011,33(6):1073-1075.
