桃果酒酿酒酵母选育及酿造条件研究
2013-09-04蒋锡龙魏彦锋孙玉霞史红梅董兴全李彦奎
蒋锡龙,魏彦锋,孙玉霞,史红梅,董兴全,李彦奎
(山东省酿酒葡萄科学研究所,山东济南250100)
桃原产于我国西部和中亚一带,是我国栽培的主要水果之一。桃子果实味道鲜美,营养丰富,富含果糖、葡萄糖、有机酸、维生素C、钙、铁等营养成分。桃属呼吸跃变型果实,多数品种采收正值高温季节,采后很容易软化腐烂[1]。桃子果实含有丰富的风味物质[2],是酿酒的良好原材料。将桃深加工成桃酒,不仅可以解决桃子储藏、运输难的问题,还可增加产品的附加值。酵母在果酒的酿造中起着至关重要的作用,选择合适的酵母是果酒酿造成败的关键因素之一。但是,现在果酒生产中所采用的酵母大多数为葡萄酒酵母[3],尚无用于桃酒酿造的专用酵母。在桃的栽培环境中,经过长期的自然选择,野生酵母菌群已经适应了桃的品质和特征。本实验从济南郊区多年的桃栽培园区中选育出优良酿酒酵母,经过驯化后,作为桃酒酿造的出发菌株,对桃酒酿造工艺进行了优化,获得了适合桃酒酿造的专用菌株和发酵工艺。
1 材料与方法
1.1 材料与仪器
菌种来源 济南本地桃园种植成熟桃子、土壤,采样时间2009年桃成熟季;成熟桃 采摘于济南近郊桃园;白砂糖 市售;酵母提取物 OXOID;蛋白胨 北京奥博星;葡萄糖 国药集团;无水乙醇 天津广大;氯化钾 国药集团;氢氧化钾 国药集团;硫酸铜 国药集团;亚硫酸 天津科密欧;氯化镁 上海三浦化工;胶回收试剂盒 、DNA连接酶、Taq DNA聚合酶、dNTPs、克隆载体等 TaKaRa生物工程(大连)有限公司;增殖培养基:成熟桃去皮榨汁,90℃水浴20min;分离培养基:麦芽汁琼脂培养基,WL培养基;放大发酵培养基:桃汁加糖至 16°Bx,121℃灭菌15min,用时添加 SO2浓度为 80mg·L-1;YEPD 培养基:酵母提取物10g,蛋白胨20g,葡萄糖20g,加 dd H2O至1000mL,固体加入琼脂15g;酵母氮源基础培养基(YNB)和酵母碳源基础培养基(YCB)美国BD公司,0.2μm抽滤后备用。
YXQG02手提式电热压力蒸汽消毒器 山东新华安得;SW-CJ-ZD超净工作台 苏州净化;JYZB530水果榨汁机 九阳股份有限公司;WYT-32型手持糖量计 泉州光学仪器厂;GSP-9160MBE型隔水式恒温静置培养箱 上海博迅;HZQ-Q全温振荡器 哈尔滨东联;Eppendorf mastercycler gradient PCR仪 德国;DYY-12型电泳仪 北京六一仪器厂;AlphaImager EP通用型凝胶成像系统 美国;Sigma3-30K实验室高速冷冻离心机 德国。

表1 感官评价标准Table 1 Standard of sensory evaluation
1.2 实验方法
1.2.1 野生酵母的分离 1g试样加入100mL无菌生理盐水(NaCl,0.9%)中,震荡30min,取1mL加入增殖培养基,28℃静置培养12h,梯度稀释,涂布于麦芽汁琼脂平板,28℃静置培养3d。随机挑取单菌落在WL平板上划线,28℃静置培养5d,根据单菌落特征分类,选取单克隆,并进行形态与生殖方式观察。
1.2.2 筛选酵母的初级筛选和放大发酵筛选 初级筛选:杜氏管发酵法[4],每株酵母重复3次,筛选产气能力强且香气较好的菌株。
放大发酵实验:采用桃汁发酵法,供试菌株接入放大发酵培养基,22℃静置,发酵完毕测定酒精度、感官品评风味,品评标准见表1,每株酵母重复3次。筛选产酒能力强、产香好的酵母菌株。
1.2.3 筛选酵母的驯化选育 制备乙醇含量分别为8%、10%、12%、14%、16%、18%的6级 YEPD培养基平板,将筛选出的野生酵母自乙醇含量8%平板开始接种,培养后挑取优势单克隆接种到下一级培养基上,依次接种,直到酵母不再生长。
1.2.4 选育酵母菌株的鉴定 生理生化鉴定[5]。
分子生物学鉴定:碱裂解法[6]提取酵母基因组DNA,酵母26S rDNA D1/D2区PCR扩增引物:NL1:5'-GCATATCAATAAGCGGAGGAAAAG-3'和 NL4:5'-GGTCCGTGTTTCAAGACGG-3'[7-8]。
反应体系:Taq DNA Polymerse Buffer(1×),MgCl22.0mmol/L,dNTPs 40μmol/L,Taq 酶 1U,模板DNA 60ng,引 物 各 0.6μmol/L,加 无 菌 超 纯 水至50μL。
反应程序:95℃ 5min;94℃ 45s,54℃ 30s,72℃45s,循环30次;72℃延伸10min。
扩增产物电泳后回收,接入克隆载体,由山东省农业科学院测序中心完成测序。测序结果在GenBank数据库中进行BLAST分析。
1.2.5 选育酵母耐受性实验 将选育酵母等量接种于不同 pH(1.5、2.0、2.5、3.0、3.5、4.0、4.5)、不同 SO2浓度(60、100、150、200、300、400mg·L-1)、不同 KCl浓度(0.7、1.0、1.2、1.4、1.6、1.8、2.0、2.2mol·L-1)的带有杜氏管的YEPD液体培养基中,28℃静置培养,每1h观察一次产气情况;接种选育酵母到有杜氏管的YEPD液体中,不同温度(37、45℃)培养,观察产气情况。
1.2.6 选育酵母最适接种量的测定[9]酵母菌YEPD中培养16h,取1mL稀释,显微镜镜检计数,计算其酵母含量。新鲜桃汁糖度调至23°Bx,添加SO2浓度为80mg·L-1,等量分成六份。每份加入酵母菌为:0.5、1、2、3、4、4.5(×107cfu·mL-1),22℃发酵 9d。酒精蒸馏后用酒精计测定,残还原糖用斐林法测定[11],挥发酸、总酸以指示剂法滴定。
1.2.7 选育酵母发酵性能测定 CO2失重实验[10]:新鲜桃汁加白砂糖到糖度 23°Bx,SO2浓度为 80mg·L-1,选育菌株最适接种量接种,以活性干酵母D21为对照,22℃静置,每24h称量重量变化。
发酵过程中糖度、酒精度变化实验:新鲜桃汁加糖至糖度为 23°Bx,SO2浓度为 80mg·L-1,选育菌株最适接种量接种,D21为对照,22℃发酵9d,每24h取样测定酒精度、糖度。发酵完成后测定挥发酸、总酸。
1.2.8 桃果酒酿制的工艺流程 桃子清洗→去皮、去核→榨汁→80mg·L-1SO2护色→果胶酶低温处理→清汁→调整糖度→接种→发酵→过滤去渣→后发酵→陈酿→下胶处理→灭菌→灌装→成品。
1.2.9 产品质量指标 感官评定指标和理化测定:感官品评标准见表1。酒精蒸馏后用酒精计测定;总酸、挥发酸用指示剂滴定法;残糖用斐林法测定;可溶性物质用密度瓶法测定[11]。微生物检测[12-13]:测定菌落总数 (cfu·mL-1)、大肠杆菌数 (MPN·100mL-1)和致病菌。

表2 初选酵母形态特征鉴定结果Table 2 Morphologic of wild yeast
2 结果与讨论
2.1 野生酵母分离
不同酵母在WL培养基上的菌落颜色及形态不同[14],依据野生酵母的菌落颜色及形态,选取10株具有酿酒酵母特征和2株非酿酒酵母特征的菌株,在显微镜下进行其菌体形态和无性繁殖方式鉴定。12株菌的菌落、菌体形态特征及无性繁殖方式的结果见表2。
2.2 初级筛选及放大发酵实验结果
经杜氏管法发酵,J05和J09产气少且很快停止,J06和J07起酵在48h以后,其他8株均在12h内产气,量大且持续时间长。8株菌株进行了放大发酵实验,发酵完毕后其酒精度和香气特征见表3。J03和J11酒香气浓郁,酒精度也高,但达不到果酒酿造生产的需要,需要进一步培养驯化。

表3 放大发酵实验结果Table 3 Amplification test of 8 strains of yeast
2.3 驯化选育结果
驯化选育结果见表4。J03在乙醇含量为12%及以上的培养基上都不能生长,而J11可以耐受16%的乙醇,但不能耐受18%的乙醇。挑取J11在16%乙醇培养基上长势最优的单菌落保种,用于后续实验。
2.4 选育酵母J11的鉴定
2.4.1 生理生化鉴定结果 J11在电子显微镜下菌体形态见图1,生理生化鉴定结果见表5。J11可以同化葡萄糖、半乳糖、麦芽糖、蔗糖、海藻糖及棉籽糖,铵盐只能同化硫酸铵,在含糖不高于50%的培养基上能够生长,含糖为60%时则不能生长,在放线菌酮两个梯度平板上都不生长,这与酿酒酵母的特征相符。

表4 菌株驯化选育结果Table 4 Taming and breeding of J03 and J11
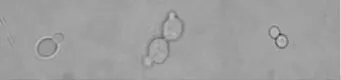
图1 J11在电子显微镜下菌体形态Fig.1 Mycelium morphology of strain J11 under an electron microscope

表5 J11生理生化鉴定结果Table 5 Carbon and nitrogen assimilation of strain J11
2.4.2 分子生物学鉴定 PCR扩增产物经琼脂糖凝胶电泳,产物条带大小为600bp左右(图2)。测序长度为614bp,序列在 GenBank核酸数据库中进行BLAST在线分析,与数据库中模式菌株S.cescerevisiae(U44806)同源片段相似性为100%。经过生理生化鉴定和分子鉴定,确定 J11为酿酒酵母(S.cescerevisiae)。

图2 J11 26S rDNA D1/D2区PCR扩增电泳图谱Fig.2 PCR amplification electrophoresis patterns of 26S rDNA D1/D2 domain from J11
2.5 选育酵母J11耐受性实验
耐受性实验结果见表6。耐酸实验中J11在pH4.5时起酵最快,pH越低起酵越慢;SO2浓度对J11影响很小,只有在400mg·L-1时起酵稍晚;在渗透压实验中,随着KCl浓度的提高,J11起酵时间越长,当 KCl浓度达到 1.8mol·L-1时,J11 不产气。在 37℃和42℃两个温度,J11都生长,表明其能耐受37℃和42℃两个温度。

表6 J11耐受性实验结果Table 6 The stress resistance of low pH、SO2concentration and high osmotic
2.6 J11最适接种量实验
最适接种量实验结果如表7,5种发酵酒的挥发酸、总酸含量差距不大,残还原糖也都符合酿造干酒的要求。酒精度的差距比较明显,在接种量为3.0×107cfu·mL-1时,酒精度最高,对糖的利用率也最高,确定其为酵母菌株J11的发酵接种量。
2.7 发酵性能实验结果
2.7.1 CO2失重实验结果 CO2释放总量和变化曲线和CO2日生成量变化曲线见图3、图4。发酵结束时,J11 总失重 10.637g·100mL-1,对照 D21 总失重10.509g·100mL-1。由图 3、图 4,在发酵前 5d D21 的CO2释放量大于J11,但CO2释放总量J11大于D21,说明J11发酵较D21平缓,但总发酵能力较D21强。

表7 J11最适接种量实验结果Table 7 Optimal inoculation quantity test of J11

图3 CO2释放总量变化曲线Fig.3 Total weight lose of fermentation test

图4 CO2日生成量变化曲线Fig.4 Weight lose of fermentation test each day
2.7.2 发酵过程中糖度、酒精度变化 图5为发酵过程中糖度、酒精度变化曲线,发酵结束后,J11和D21所产酒精度分别为12.8°和12.6°,残还原糖分别为2.8、3.1g·L-1,由此可知 J11 产酒精能力强于 D21,且残还原糖量也比D21少。但发酵的整个过程中,前5天,D21产酒精量要比J11高,剩余的糖比J11少。所以,J11对糖的利用率和酒精转化率都高于D21,J11的发酵比D21平缓,这与CO2失重实验结果相一致。
2.8 产品质量评定
感官评定指标及结果见表8,桃果酒为浅黄色透明液体,均一稳定,具有明显桃果实香气和风味,只是因为原料的成熟度不够,酸度稍高。
桃果酒的理化指标和卫生指标(见表9)均符合或高于国家果酒标准,因而其酿造工艺流程合理。
3 结论
本实验选育出的酵母J11经鉴定为酿酒酵母(S.cescerevisiae),各项性能优越。J11酵母酿造桃果酒,发酵平缓,产酒能力强,所产果酒香气浓郁,风味物质种类、含量都较商品酵母D21要多或高,是一株很好的桃果酒酿造酵母,具有很好的产业应用价值。桃果酒酿造工艺优化后获得的桃酒各项指标都优于或达到国家果酒标准,证明其工艺流程合理。实验证明桃果实,营养丰富,含有丰富的风味物质,适合酿酒。但桃果实的果胶含量比较高,且桃汁在空气中容易氧化变色,所以在桃榨汁后需马上添加一定量的 SO2或者维生素 C,并加入果胶酶在低温(0~4℃)下处理,最后弃去沉淀,获得高质量、高产率的桃汁。另外桃果实的成熟度对桃酒的产品质量影响较大,桃成熟度不够时,生产的桃果酒酸度较高,风味、口感较差,需进行苹果酸-乳酸发酵调整,且调整工艺较为复杂,所以须选择成熟度好的桃进行桃果酒酿造。

表8 感官评定结果Table 8 The organoleptic evaluation of peach fruit wine

表9 桃果酒的理化、卫生指标Table 9 The physicochemical and hygienic standards of peach fruit wine

图5 发酵过程中糖度、酒精度变化曲线Fig.5 The transformations of alcohol and remaining sugar concentration
[1]魏好程.桃果实采后贮藏保鲜及其品质控制的研究[D].儋州:华南热带农业大学,2005.
[2]胡玲,李丽萍,王友升.桃李果实风味物质的研究进展[J].安徽农业科学,2010,38(7):3707-3709,3711.
[3]王燕,金利.峨眉山野生猕猴桃酿酒酵母筛选研究[J].食品工业科技,2012,33(3):178-179,248.
[4]权英,张伟,李长文,等.酿造红枣果酒的酵母菌选种研究[J].食品与发酵工业,2004,30(11):39-41.
[5]巴尼特JA.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:140-174.
[6]Lorenz T C,Anand V C,Payne G S.High-throughput protein extraction and immunoblotting analysis in Saccharomyces cerevisiae[J].Methods Mol Biol,2008,457:13-27.
[7]Kurtzman CP,Robnett CJ.Identification and phylogeny of ascomycetous yeasts from analysis of nuclear large subunit(26S)ribosomal DNA partial sequences[J].Antonie Leeuwenhoek,1998,73(4):331-371.
[8]Nicola F,Mario C,Raffaele R,et al.Indigenous yeast communities in the environment of“Rovello bianco”grape variety and their use in commercial white wine fermentation[J].World J Microbiol Biotechnol,2010,26(2):337-351.
[9]余晓红,汪志君,方维明.麦汁中啤酒酵母的最适接种量研究[J].酿酒科技,2003,118(4):73-74.
[10]李筝,韩北忠,陈晶瑜,等.优良酿酒酵母菌的发酵性能研究[J].中国酿造,2008,196(19):10-12.
[11]NY/T 1508-2007.绿色食品果酒[S].北京:中华人民共和国农业部,2007.
[12]GB/T4789.2—2003.食品卫生微生物学检验菌落总数测定[S].北京:中华人民共和国卫生部,中国国家标准化管理委员会,2003.
[13]GB/T4789.32—2002.食品卫生微生物学检验大肠菌群的快速检测[S].北京:中华人民共和国国家质量监督检验检疫总局,2002.
[14]Cavazza A,Grando M S,Zini C.Rilevazione della flora microbicadi most ievini[J].Vignevini,1992,9:17-20.
