枫香叶挥发油抗炎及其凝血作用以及化学成分的研究
2013-09-03杨朝竣张韻慧姚小青晋兴华
杨朝竣,张韻慧,冯 靖,姚小青,晋兴华,*
(1.天津大学药物科学与技术学院,天津 300072;2.天津红日药业股份有限公司,天津 301700)
枫香(Liquidambarformosana)为金缕梅科(Hamamelidaceae)枫香亚科枫香属植物,别名三角枫、黑饭木等,是我国重要的乡土树种,也是亚热带地区优良速生落叶阔叶树种[1]。枫香树叶气香、性凉,具有化瘀、止血、止咳、化痰、解毒等功效[2-3]。枫香叶作为一种天然药食同源植物资源,越来越受到国内外功能保健及医药等领域的关注,在广西、云南等少数民族地区,枫香叶作为民间食品、清凉茶饮品的应用历史悠久。挥发油成分在我国民间和药用史上应用历史悠久。为了广泛开发我国天然食用、药用资源,本文应用BEAS-2B人肺上皮细胞炎症模型,加入地塞米松+TNF-α诱导细胞阳性对照组(Dex)、枫香叶挥发油+TNF-α诱导细胞实验组,通过检测IL-6蛋白的表达量,来评价挥发油的抗炎效果,采用体外血浆复钙实验研究了枫香叶中经水蒸气蒸馏得到的挥发油成分的抗炎及其促凝血活性,并对在实验条件下所提取得到的具有活性作用的挥发油物质成分应用气相色谱-质谱法进行了结构鉴定,共鉴定出26种化合物,其中10种化合物为首次报导。
1 材料与方法
1.1 材料与仪器
枫香叶 产地:广西省,经天津中医药大学黄世渠教授鉴定为枫香叶Liquidambar formosana的全叶,对照由天津大学药学院保存;冷冻血浆 由天津血液中心提供健康人血浆,-25℃保存;云南白药 购于天津中舟大药房;PBS缓冲液 pH=7.1,NaCl:0.13mmol/L,KCl:2.7mmol/L,Na2HPO4:12mmol/L,KH2PO4:1.5mmol/L,棕色瓶保存;胎牛血清FBS Biological industries公司;青霉素-链霉素(P/S)、DMEM高糖培养基 HyClone公司;地塞米松DEX Sigma公司;人源肿瘤坏死因子-α(TNF-α)Pepro Tech.Inc;人白细胞介素6 ELISA试剂盒 IL-6上海西唐生物科技有限公司。
Agilent6820气相色谱仪 美国安捷伦公司;Finnigan TRACE MS 2000气相色谱-质谱联用仪器美国Thermo Finnigan公司;HU3120B超声波仪 天津市恒奥科技发展有限公司;XS205分析天平 METTLER公司;超纯水仪 Milli-QMILLIPORE,USA;单孔化学发光检测仪 Promega公司。
1.2 实验方法
1.2.1 制备挥发油 取清洁枫香叶10g,加入料液比为(1∶10.35)的蒸馏水浸泡2.4h,搅拌机中打浆后置圆底烧瓶中,加水和少许沸石,缓慢蒸馏2.7h。收集挥发油提取器中得到的油层。加入乙醚稀释并加入无水硫酸钠干燥过夜。吸取过夜后的样品溶液、用有机膜过滤,得到待测液体。该液体为浅黄色,具有明显的枫香叶香气。经计算得挥发油收率为1.654%。为了便于表达,将枫香叶挥发油简写为“FXY”。
1.2.2 细胞培养 BEAS-2B人肺上皮细胞培养于5%CO2-95%O2的细胞培养箱中,37℃。用含10%胎牛血清FBS的DMEM/F12培养基培养,细胞生长至对数生长期时,以1×105/孔接种于96孔板。枫香叶挥发油抗炎实验前换用无血清的DMEM/F12培养基培养过夜,挥发油用无血清培养基溶解,地塞米松浓度为10-6mol/L,挥发油浓度分别为5、50、500μg/mL。
1.2.3 实验分组及IL-6的ELISA检测实验分组 加入与实验组等体积生理盐水的无药无TNF-α诱导细胞培养基空白组(Control)、加入与实验组等体积生理盐水的TNF-α(5ng/mL)诱导细胞无药对照模型组(TNF-α Model)、地塞米松(10-6mol/L)+TNF-α(5ng/mL)诱导细胞阳性对照组(Dex)、枫香叶挥发油(5、50、500μg/mL)+TNF-α(5ng/mL)诱导细胞实验组。
空白(Control)组加入相应体积生理盐水直接培养18h,其余4组的实验方法为:加入不同浓度挥发油、地塞米松预处理1h,再添加5ng/mL TNF-α的培养6h后再加培养基培养12h。收集细胞上清液,用ELISA试剂盒检测IL-6蛋白的表达量。
1.2.4 枫香叶挥发油血浆复钙实验 参照文献[4]方法,取内径为10mm试管,分别依次加入0.1mL血浆、0.1mL不同浓度的挥发油、0.1mL氯化钙溶液,混匀,立即计时。37℃保温40s后,取出试管缓慢倾斜,观察溶液流动情况,如停止流动立即记时。空白对照组为PBS缓冲液(0.1mol/L);阳性对照组为云南白药(50mg/L)。平行实验6次,结果以均值±标准差(x±S)表示。建立药物浓度与血浆复钙时间的药效关系,以凝血时间缩短率作为实验指标:
凝血时间缩短率(%)=(空白组血凝时间-给药组血凝时间)/空白组血凝时间×100。
采用SPSS 13.0软件进行数据统计。组间比较采用单因素方差分析(One-wayANOVA)。以p<0.05为差异有统计学意义。
1.2.5 气质联用技术鉴定挥发油物质结构
1.2.5.1 气相色谱条件 仪器:Agilent GC 6820;色谱柱:Agilent HP-5弹性石英毛细管柱:(5%)-二苯基硅氧烷共聚物色谱柱(30m×0.32mm i.d.,0.25μm);载气:氮气;进样量:0.2μL;进样口温度:300℃;检测器(FID)温度:300℃;程序升温:起始温度40℃,保持3min,以20℃/min升至90℃,保持1min,继续以4℃/min升至280℃,保持2min。记录色谱图。
1.2.5.2 气相-质谱条件 仪器:Finnigan TRACE MS2000气相色谱-质谱联用仪;色谱柱:DB-5MS型弹性毛细管柱,(5%苯基)—甲基聚硅氧烷色谱柱(30m×0.25mm i.d,0.25μm);载气:氦气;流速:1mL/min;升温程序:起始温度40℃保持3min,20℃/min程序升温升至90℃保持1min,以4℃/min升至280℃保持2min;进样口温度:280℃;检测器温度:280℃;进样量:0.2μL;分流比:1∶40。质谱条件:EI电离,离子源温度:280℃;电子能量:70eV;扫描范围:m/z35~450;扫描速度:2000amu/min。
2 结果与讨论
2.1 枫香叶挥发油抗炎作用实验
图1所示与空白对照组(Control)相比,TNF-α模型组TNF-α刺激后BEAS-2B细胞IL-6表达显著升高。图1可见,与空白对照组相比,阳性药组和挥发油高剂量组(50、500μg/mL)显示了显著的抑制效果。
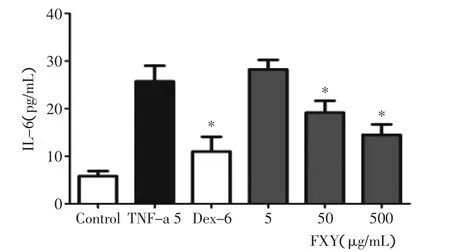
图1 枫香叶挥发油对BEAS-2B细胞IL-6表达的影响Fig.1 Effect of the FXY oil to the expression of IL-6 on BEAS-2B cells
2.2 枫香叶挥发油的血浆复钙实验
枫香叶挥发油FXY,有效浓度在5~100mg/L范围对血浆的凝集作用数据见表1。当枫香叶挥发油浓度为100mg/L时,促凝作用最强,其凝血时间缩短率与阳性对照的缩短率相近。

表1 枫香叶挥发油FXY对凝血时间的影响(n=6)Table 1 The influence on plasma recalcification time of FXY oils(n=6)
2.3 鉴定结果
图2 枫香叶挥发油气相色谱图Fig.2 The gas chromatograph of volatile oil from maple leaves
枫香叶挥发油的气相色谱图见图2。枫香叶挥发油经GC-MS分离鉴定得到的气相色谱-质谱总离子流图见图3。
将各色谱峰对应的质谱图经质谱库(NIST05)自动检索、人工检索和解析,共鉴定出相似度(SI)达85%以上的化合物26个,占挥发油总含量的93.22%,结果见表2。其中包含19种萜烯类物质,占挥发油总含量的91.33%;5种脂肪族物质,占挥发油总含量的0.93%;2种芳香族物质,占挥发油总含量的0.96%。其中挥发油成分中的β-月桂烯、α-水芹烯、邻甲基异丙烯苯、1,5,5,6-四甲基-1,3-环己二烯、α-石竹烯、(+)-表双环倍半水芹烯、(+)-喇叭烯、γ-榄香烯、蓝桉醇、角鲨烯10种成分为首次报道。
图3 枫香叶挥发油气相质谱总离子流图Fig.3 Total ion chromatogram of components of volatile oil from maple leaves
3 结论
3.1 TNF-α是一种由内毒素激活的巨噬细胞和淋巴细胞等分泌的一种多活性的细胞因子,是迄今为止发现的具有促进炎症作用最强的细胞因子,能刺激细胞因子IL-6的释放,介导创伤后细胞炎性反应。而IL-6是一种活化的T细胞和成纤维细胞产生的淋巴因子,能使B细胞前体成为产生抗体的细胞;和集落刺激因子协同,能促进原始骨髓源细胞的生长和分化,它与多种疾病如肿瘤、感染、发热和内毒素性休克等反应发生和发展有关,且创伤越严重,IL-6值越高。IL-6监测对炎症的辅助诊断、分期及预后判断具有重要意义[5]。细胞炎症实验结果表明,枫香叶中的挥发油具有很好的抗炎作用。
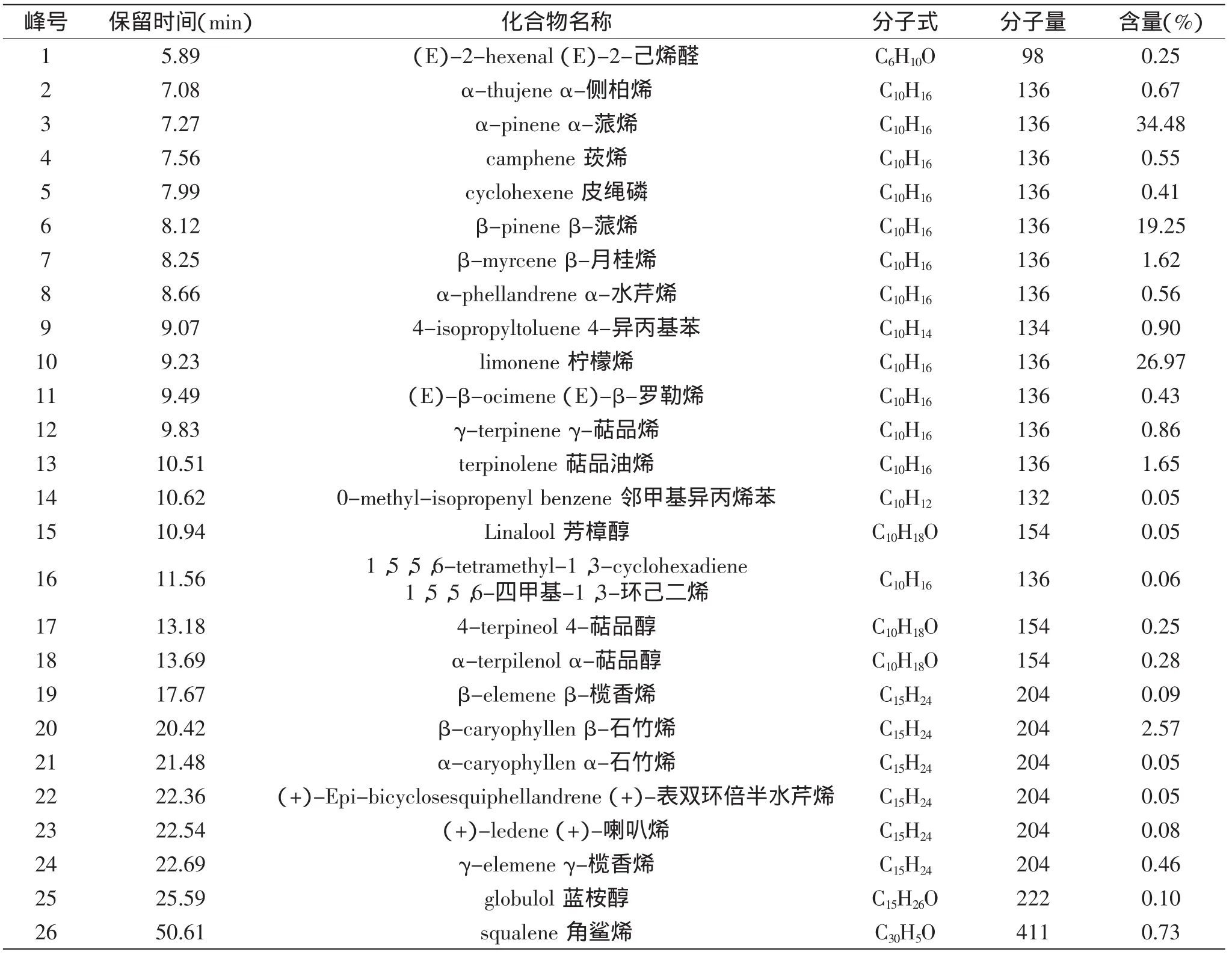
表2 枫香叶挥发油化学成分分析结果Table 2 Analysis results of the volatile oil from leaves of L.formosana
3.2 止血包括血液凝固、血小板聚集和血管收缩3个重要因素。当外伤或疾病出血时可见受损局部血管收缩,血小板在血管破损处凝集,启动内源性及外源性凝血途径完成凝血过程,形成血块而止血[6]。血浆复钙实验表明,枫香叶挥发油很可能对凝血酶具有活化作用,通过增加凝血酶的活性,激活血小板,促进血栓形成,实现止血作用。
3.3 通过气质联用技术对枫香叶中挥发油的化学成分进行鉴定,鉴定出26种化合物,其中10种化合物:β-月桂烯、α-水芹烯、邻甲基异丙烯苯、1,5,5,6-四甲基-1,3-环己二烯、α-石竹烯、(+)-表双环倍半水芹烯、(+)-喇叭烯、γ-榄香烯、蓝桉醇、角鲨烯为首次报道。有文献曾报导其中成分α-蒎烯(34.48%)、β-蒎烯(19.25%)和柠檬烯(26.97%)的作用主要为抑制白色念珠菌的生物合成以及抗炎促凝血作用[7]。而以上本文首次报道的γ-榄香烯、蓝桉醇、角鲨烯成分都具有抗氧化、抗肿瘤效果[8-10]。挥发油成分的结构鉴定进一步佐证了上文抗炎以及促凝血实验的结果。
本实验研究所进行的枫香叶挥发油抗炎及促凝血作用和其中物质结构鉴定具有一定的现实意义和应用价值,扩大了其在药品和食品等方面的应用。本研究为枫香叶药材的进一步开发和应用提供了研究应用的理论基础。
[1]翁玲玲,蒋家谈,张鼎画,等.乡土树种枫香的研究现状与发展前景[J].福建林业科技,2007,34(2):184-185.
[2]广西壮族自治区革命委员会卫生局主编.广西本草选编(上册)[M].南宁:广西人民出版社,1974:1900-1901.
[3]郑毅,张青.江西野生枫香活性成分提取及鞣质含量的研究[J].江西化工,2004:99-102,105-109.
[4]江蔚新,赵玺.龙胆多糖的抗凝血作用研究[J].黑龙江医药,2008,21(5):31-32.
[5]Kang Liu,Tianjiong Luo,Zhongai Zhang,et al.Modified Si-Miao-San extract inhibits inflammatory response and modulates insulin sensitivity in hepatocytes through an IKKβ/IRS-1/Aktdependent pathway[J].Journal of Ethnopharmacology,2011,136:473-479.
[6]赵宝明,张志谦,张书信,等.广痛消泡沫气雾剂止血抗炎作用实验研究[J]. 中华中医药学刊,2011,29(10):2164-2166.
[7]吕小满,胡艳芬.松塔化学成分及生物活性的研究进展[J].医学综述,2010,16(7):35-38.
[8]邹丽娟,李杰.榄香烯抗癌作用与诱发肿瘤细胞凋亡的研究[J].大连医科大学学报,1998,20(2):87-90.
[9]夏文斌,薛震,李帅,等.杜鹃蓝化学成分及肿瘤细胞毒活性研究[J].中国中药杂志,2005,30(23):1827-1829.
[10]李东霞,张双全.鲨鱼软骨活性物质研究进展[J].河北中西医结合杂志,1998,7(11):1694-1696.
