转基因玉米Bt176品系特异性环介导等温扩增检测方法的研究
2013-09-03刘静宇易敏英吴少云李志勇高东微
凌 莉,刘静宇,易敏英,吴少云,刘 津,蔡 颖,李志勇,高东微,*
(1.广东出入境检验检疫局检验检疫技术中心,广东广州510623;2.华南理工大学,广东广州510640;3.汕头出入境检验检疫局,广东汕头515031)
转基因玉米品系Bt176是最早的转基因作物品种之一,1995年由瑞士先正达公司研发,具有抗虫特性。1995~2004年间,美国、加拿大、日本、荷兰、欧盟、阿根廷、澳大利亚、南非、韩国、菲律宾和台湾相继批准了Bt176玉米作为食品或饲料的原料进行加工和销售。我国于2004年批准Bt176玉米作为食品或饲料的原料进行加工和销售。根据国务院《农业转基因生物安全管理条例》[1]、农业部《农业转基因生物进口安全管理办法》[2]和国家质检总局《进出境转基因产品检验检疫管理办法》[3]等的转基因管理政策,我国明确规定了转基因产品申报和符合性检验管理制度,对进口农食产品中转基因成分的品系鉴别检测提出了技术要求。这为建立品系检测方法和开展品系检验监管提供了法规依据。目前,国内现行转基因玉米Bt176的品系特异性检测方法标准有2项,分别是《SN/T 1196-2003玉米中转基因成分定性 PCR 检测方法》[4]和《NYB869HGG-8Y2007 转基因植物及其产品成分检测抗虫和耐除草剂玉米Bt176及其衍生品种定性PCR方法》[5]。这2项标准均采用普通PCR结合琼脂糖凝胶电泳检测PCR产物的技术。国外普遍认可和采用基于TaqMan实时荧光PCR技术的欧盟官方检测方法“Event-specific Method for the Quantification of Maize Bt176 Using Real-time PCR”[6]。我国转基因监管检验的实际工作中,上述标准方法均存在一定的技术局限性,其中普通PCR是初筛检测技术,操作繁琐,容易发生交叉污染,且灵敏度较低;实时荧光PCR则需要依赖大型仪器设备,成本昂贵,难以在基层实验室普及应用。因此,目前急需建立一种成本低廉、快速、简便而且灵敏度高的检测方法,满足我国大宗粮谷和饲料进出口日常检验监管和快速通关的需要。环介导等温扩增[7](LAMP,Loop-mediated Isothermal Amplification)是在PCR基础上发明的一种新型核酸片段扩增技术,具有高特异性、高灵敏度、操作简便、结果判读简单和成本低廉的特点。目前LAMP检测技术已在食品安全、生物安全、临床医学等领域得到广泛的应用[8-12],在转基因领域也开展了对大豆、玉米等转基因作物的快速检测方法[13-16],并已成为出口食品卫生微生物学检验的标准检测方法之一[17]。本文通过优化反应参数和反应条件最终建立的转基因玉米品系Bt176的品系特异性LAMP检测方法灵敏、快速、操作简便,是转基因作物品系特异性检测的一种有益补充手段。
1 材料与方法
1.1 材料与仪器
玉米(M20、M21、M22、W7731、W5599、A155、A103、W7845、W8272)、玉米酒糟粕(YP1、YP10、W5544、W5545)、豆粕(262、118、313) 均来自于进出口商品;玉米 Bt176(5%)、大豆 GTS40-3-2(10%)均为IRMM®标准品;玉米MIR604(100%)、GA21(100%)、MON89034(100%)、大豆MON89788(100%)均为 AOCS®标准品;玉米MON810(10%)、98140(10%)、大 豆 DP356043(10%)、DP305423(10%)均为 ERM®标准品;Promega Wizard®基因组DNA纯化试剂盒 北京盈田卓越科技有限公司;Ex Taq、dNTPs 宝生物工程(大连)有限公司;甜菜碱、Bst DNA聚合酶、10×ThermoPol缓冲液 Sigma公司;1000×SYBR GreenⅠ 厦门百维信生物科技公司。
实时浊度仪LA-320C 日本LOOPAMP;NANODROP 1000核酸蛋白分析仪 美国THERMO SCIENTIFIC;ABI 7900实时荧光定量PCR仪 美国ABI;恒温金属浴 郑州南北仪器设备有限公司。
1.2 实验方法
1.2.1 DNA的提取与质量分析 按GB/T 19495.3-2004[18]规定,实验样品均采用CTAB法提取植物基因组DNA,并用核酸蛋白分析仪测定DNA的纯度和浓度后稀释DNA溶液到100ng/μL,4℃保存备用。
1.2.2 引物设计与合成 根据玉米Bt176品系特异靶序列,采用LAMP专用引物设计软件设计3套LAMP引物,由上海生工生物工程有限公司合成,纯度为色谱级。
1.2.3 LAMP方法的建立 初步确定25μL的LAMP反应体系,其成分包括:1×ThermoPol缓冲液、外引物F3和 B3各 0.2μmol/L、内引物 FIP和 BIP各1.6μmol/L、环 状 引 物 LF 和 LB 各 0.8μmol/L、1.4mmol/L dNTPs、0.8 mol/L 甜菜碱、6mmol/L MgSO4、0.32U/μL Bst DNA 聚合酶、DNA 模板200ng。
参照LAMP浊度仪使用说明书,将混合物置于反应孔中,在反应管中加入1滴石蜡油,管盖内壁加入1μL 0.1%的SYBR GreenⅠ。然后将其置于65℃恒温反应60min,最后80℃灭活5min结束反应。浊度仪实时观察反应管中是否发生扩增,如果发生反应,产生焦磷酸镁沉淀,浊度增加,浊度仪上会出现相应的峰段。反应结束后,将反应管盖内壁的SYBR GreenⅠ离心,观察反应管中液体颜色,进一步验证是否发生扩增反应,如发生扩增,溶液为绿色,否则保持SYBR GreenⅠ橙色不变。
1.2.4 LAMP引物的筛选 用5%的转基因玉米Bt176标准品作为阳性对照,0%的转基因玉米Bt176作为阴性对照,每组对照分别设置4个平行,进行LAMP反应。通过观察实时浊度仪的峰图结果,根据起始扩增时间、浊度变化和浊度曲线的重复性等指标对引物进行筛选。
1.2.5 LAMP反应体系和反应条件的优化 选取反应温度61、63、65、67℃单个变量参数,进行单因素变化实验,对LAMP反应条件进行优化。根据实时浊度仪观察实验结果,选择最佳的反应体系和反应条件。
1.2.6 灵敏度实验 为确定本方法的检测灵敏度,采用不同梯度浓度(0%、0.1%、0.5%、1%、5%)的转基因玉米Bt176标准品进行LAMP扩增,每个浓度设置2个平行,用实时浊度仪进行监测,并加入1000×SYBR Green I观察颜色。
1.2.7 特异性实验 采用转基因玉米Bt176以外其他转基因玉米品系的标准品、转基因大豆标准品、含有Bt176的进口玉米商品和其他植物及其加工产品对本实验设计的引物进行特异性实验,用实时浊度仪监测结果,并加入1000×SYBR Green I观察颜色。
1.2.8 稳定性实验 用5%的转基因玉米Bt176标准品的DNA添加到非转基因玉米DNA中制成模拟样品DNA进行检测,添加量为5%、1%、0.5%、0%,每个模拟样品DNA重复20次。
2 结果与讨论
2.1 LAMP引物的筛选
根据玉米Bt176品系特异靶序列设计3套LAMP引物,用5%的转基因玉米Bt176标准品作为模板进行引物的初步筛选,通过LAMP反应实时浊度仪结果显示,第1、2套引物没有发生扩增反应;第3套引物发生了扩增反应,出峰时间为37min左右,峰高为0.15,出峰时间和峰高值适中,可用于建立LAMP检测方法,并应当进一步优化反应参数。
第3套引物的序列分别为:
外引物1(F3):TTAGGGACGTGGGTTTGGTCC;
外引物2(B3):GCGGAAGATCCGAGAAGAG;
内引物1(FIP):CCAATCAAGGCCATTGACCG AGATCTGATGTTCTCGAAT;
内引物2(BIP):GCCAAATCTCTCTCCCTCTCAT GTGGGAGGGAGCTTCTC;
环状上游引物(LF):GGATTCGTGCATC AATAGG;
环状下游引物(LB):TCCCCCTAAAGTCG ATACGAGGC。
2.2 LAMP反应体系和反应条件的优化
如图2所示,在25μL反应体系中,当反应体系为MgSO4浓度为6mmol/L,甜菜碱 0.8mol/L、dNTPs 1.6mmol/L,反应条件为63℃恒温反应60min,80℃灭活5min结束反应时,实时浊度仪显示扩增结果的出峰时间为30min左右,峰高为0.18,出峰时间和峰高
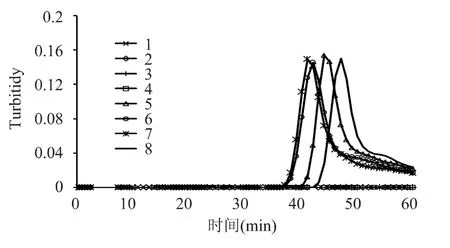
图1 第3套引物的扩增结果Fig.1 The amplification results of No.3 primers
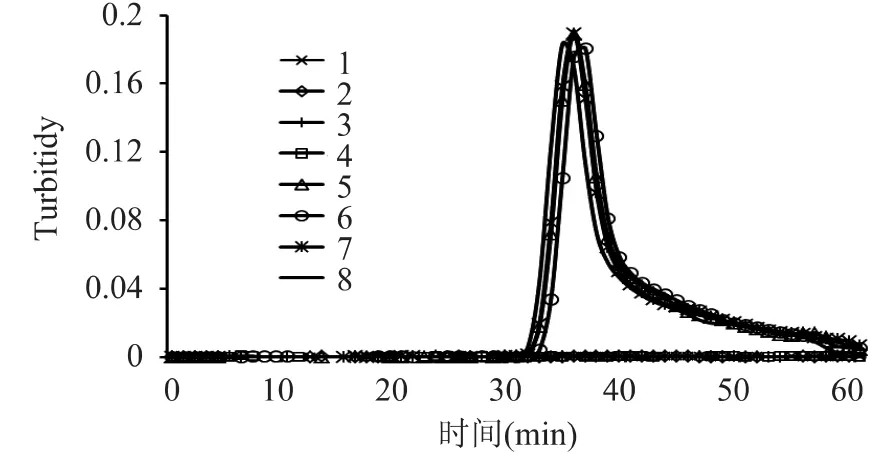
图2 LAMP反应体系和条件优化后的Bt176扩增效果Fig.2 The amplification results of Maize Bt176 after the LAMP reaction system and the parameters were optimized
2.3 灵敏度实验
用0%、0.1%、0.5%、1%、5%的转基因玉米Bt176标准品进行灵敏度实验,显色法结果见图3,实时浊度仪结果见图4。
实验结果显示,第3套的引物能从玉米样品中检出含量为0.5%的转基因玉米品系Bt176,即灵敏度达到0.5%。
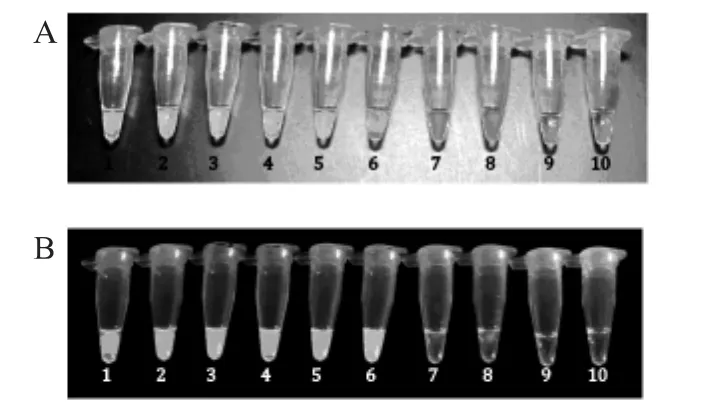
图3 灵敏度实验的LAMP显色法检测结果Fig.3 Specificity test of Bt176 LAMP assay(colour)
2.4 特异性实验
实验结果显示,LAMP方法的引物特异性良好,可准确检测出玉米Bt176的标准品、含有Bt176转基因成分的冷冻玉米,其他样品均没有发生特异性扩增,检测结果与欧盟采用的实时荧光PCR官方检测方法的检测结果一致,符合率达到100%。
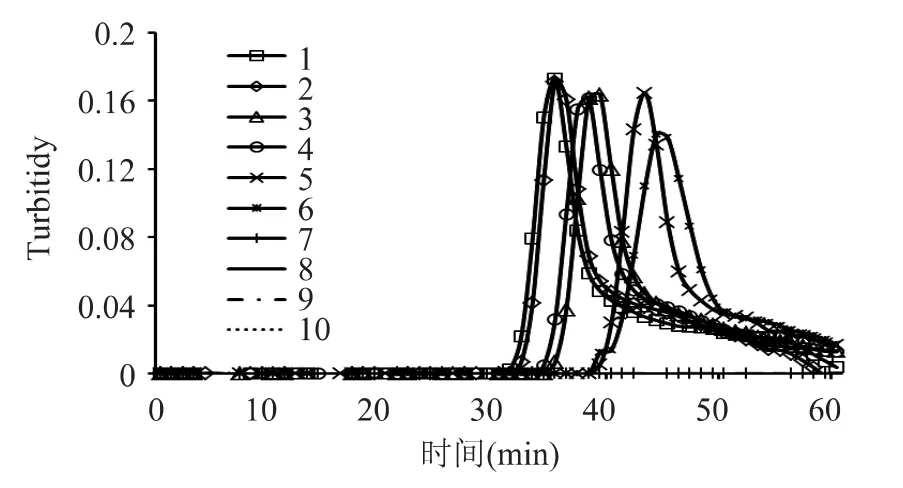
图4 灵敏度实验的LAMP浊度法检测结果Fig.4 Specificity test of Bt176 LAMP assay(turbidity)
2.5 稳定性实验
在上述全部实验中,LAMP实时浊度法和显色法均得到稳定准确的结果,假阳性率和假阴性率均为0。
2.6 讨论
2.6.1 方法的适用性 由于转基因玉米Bt176品系已经退市,理论上正规进口的玉米和玉米制品中应当不再含有转基因玉米Bt176成分。在本文的方法验证过程中也确实遇到难以获得含有该品系的商品的情况。不过,不能排除过去非法流入我国的转基因玉米种植、留种、生产加工的可能性,以及转基因玉米Bt176主要种植国家残存储粮的后续销售。实际上,未经批准的转基因玉米品系非法在我国大面积种植的报道时有发生[19-20]。为此,本文在为农食产品转基因成分检验监管提供技术支撑方面仍然具有重要的现实意义。
考虑到方法验证过程中缺少相关的实际样品,特别是缺少玉米加工制品,本文提出,所建立的方法适用于检测玉米原粮中转基因玉米Bt176品系成分的检测,不建议用于玉米加工制品的检测。
2.6.2 两种LAMP结果判断方式的技术优劣LAMP的实时浊度法和显色法两种结果判读方式都能准确判断实验结果。实时浊度法采用仪器设备实时记录反应体系中的浊度变化,最主要的特点是可对实验过程进行在线监控,与显色法肉眼判断相比记录数据更加准确客观。显色法是终点判断法,不需要依靠仪器,仅通过肉眼观察颜色的变化判断结果。因此,在方法建立和优化阶段,采用浊度法能够迅速有效地选择适宜的参数和条件,对简化研究工作有很大的好处。特别是对于引物的筛选,如果两套引物都能够发生特异性扩增,采用显色法进行结果判断会得到两个相似的实验结果,而采用浊度法则可以通过浊度曲线上出峰时间、峰高和曲线的平滑程度判断出两套引物的扩增效率,为引物的筛选提供了更加可靠的数据。与此同时,在方法的实际应用过程中,采用显色法更为简便,非常适合基层实验室和现场检测用途。
3 结论
本文建立的转基因玉米Bt176品系特异性LAMP检测方法能够准确检测出转基因玉米Bt176成分,灵敏度达到0.5%,特异性和稳定性均达到100%。本方法实验成本低廉、操作简便、无需大型设备,在满足我国大宗粮谷和饲料日常检验和快速通关需要的同时也是我国转基因作物品系特异性检测手段的一种有益补充。
[1]中华人民共和国国务院令第304号《农业转基因生物安全管理条例》
[2]中华人民共和国农业部令第9号《农业转基因生物进口安全管理办法》
[3]中华人民共和国国家质量监督检验检疫总局令第62号《进出境转基因产品检验检疫管理办法》
[4]SN/T 1196-2003,玉米中转基因成分定性PCR检测方法[S].
[5]NYB869HGG-8Y2007,转基因植物及其产品成分检测抗虫和耐除草剂玉米Bt176及其衍生品种定性PCR方法[S].
[6]CRLVL08/04VP.Event- specific Method for the Quantification of Maize Bt176 Using Real-time PCR[S].
[7]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000,28(12):63-68.
[8]Yamazaki W,Taguchi M,Ishibashi M,et al.Development of a loop-mediated isothermal amplification assay for sensitive and rapid detection of Campylobacter fetus[J].Veterinary Microbiology,2009,13:393-396.
[9]Hara-Kudo Y,Konishi N,Ohtsuka K,et al.Detection of verotoxigenic Escherichia coli O157 and O26 in food by plating methodsand LAMP method:A collaborativestudy[J].International Journal of Food Microbiology,2008,122:156-161.
[10]Yoneyama T,Kiyohara T,Shimasaki N,et al.Rapid and real-time detection of hepatitis A virus by reverse transcription loop-mediated isothermal amplification assay[J].Journalof Virological Methods,2007,145:162-168.
[11]Fukuda S,Takao S,Kuwayama M,et al.Rapid detection of norovirus from fecal specimens by real-time reverse transcription-loop- mediated isothermal amplification assay[J].Journal of Clinical Microbiology,2006,44:1376-1381.
[12]Iwamoto T,Sonobe T,Hayashi K.Loop-mediated isothermal amplification for direct detection of Mycobacterium tuberculosis complex,M.avium,and M.intracellulare in sputum samples[J].Journal of Clinical Microbiology,2006,41:2616-2622.
[13]Fukuta S,Mizukami Y,Ishida A,et al.Real-time loopmediated isothermal amplification for the CaMV-35S promoter as a screening method for genetically modified organisms[J].European Food Research And Technology,2004,218(5):496-500.
[14]Liu Mei,Luo Yan,Tao Ran,et al.Sensitive and rapid detection of genetic modified soybean(roundup ready)by loopmediated isothermal amplification[J].Bioscience Biotechnology and Biochemistry,2009,73(11):2365-2369.
[15]Chen Jinsong,Huang Conglin,Zhang Xiuhai,et al.Detection of herbicide-resistant maize by using loop-mediated isothermal amplification of the pat selectable marker gene[J].African Journal of Biotechnology,2011,10(75):17055-17061.
[16]柳毅,张军方,张会彦,等.改良环介导等温扩增技术快速检测转基因大豆[J].大豆科学,2009,28(4):706-710.
[17]SN/T 2754-2011,出口食品中致病菌环介导恒温扩增(LAMP)检测方法[S].
[18]GB/T 19495.3-2004,转基因产品检测核酸提取纯化方法[S].
[19]吴再智.迪卡007玉米成为田林县旱粮生产首选高产品种[N].林田县农业局.2006-01-16.
[20]刘灏.转基因玉米在广西种植过千万亩[N].潇湘晨报,2010-02-09.
