RP-HPLC测定保加利亚乳杆菌腺苷酸方法的建立与应用
2013-09-03孙茂成李艾黎霍贵成孟祥晨戚晓熙
孙茂成,李艾黎,霍贵成,孟祥晨,戚晓熙
(东北农业大学乳品科学教育部重点实验室东北农业大学食品学院,黑龙江哈尔滨150030)
保加利亚乳杆菌呈杆状,一般呈长、大链,不运动,无芽孢,革兰氏阳性,异养兼性厌氧型乳酸菌,是典型的酸奶发酵菌种之一[1-3],它的代谢性质直接影响酸奶的品质,如口感、风味和益生功能[4-7]等,解析其复杂的代谢网络和代谢物组的变化已成为目前研究的热点和难点。代谢组学的出现和发展成为研究微生物代谢和代谢工程的有力工具,与基因组学、蛋白组学和转录组学共同支撑起了系统生物学,为研究生物体完整的生命信息提供了代谢水平的支持[8-9]。淬灭是代谢组学研究中很重要的一个步骤,要求瞬间停止菌体的代谢反应,从而获得真实的菌体代谢片段[10]。60%(V/V)(-40℃)甲醇是使用最广泛的淬灭液,可以亚秒级停止代谢反应[11]。但是近来有文献报道这种淬灭方法可以造成一些微生物胞内代谢物的泄露,从而影响代谢组学研究的数据真实性[12-13]。建立有效的淬灭手段已成为获得真实代谢物组数据的必要条件。随之而来,也就要求建立一个简单快速准确的方法来判断淬灭液的淬灭效果。Faijes M[14]和 Hannes L[15]发现腺苷酸是个很好的鉴定淬灭液淬灭效果的指标,ATP是胞内代谢物泄露的良好指标,能荷值(EC)可以指示菌体代谢反应是否完全停止,正常生长的菌体细胞EC值在0.8~0.9之间;这两位作者分别通过酶法和液质联用(LC-MS)测定腺苷酸并成功地评价了淬灭液的淬灭效果,可见腺苷酸是个简单准确的淬灭评价指标。但是传统的酶法所需试剂昂贵、操作费时,现代的LC-MS法需要的设备价格不菲。高效液相色谱测定腺苷酸不失是一种快速、简便、准确和经济的方法,已广 泛 应 用 于 动 物 脏 器[16-20]、血 液[21]和 植 物 组织[22-24]内腺苷酸的测定,但是应用于微生物的腺苷酸的测定则鲜有报道。本研究目的是建立一种适用于保加利亚乳杆菌腺苷酸快速准确检测的高效液相色谱方法,从而为代谢组学的淬灭研究提供方法支持。
1 材料与方法
1.1 材料与仪器
保加利亚乳杆菌 KLDS 1.0204,由东北农业大学乳品科学教育部重点实验室分离保存;标准品5'-三磷酸腺苷二钠盐(ATP)、5'-二磷酸腺苷二钠盐(ADP)、5'-一磷酸腺苷二钠盐(AMP)Sigama 公司;MRS肉汤培养基 北京陆桥;甲醇 色谱纯;磷酸二氢钾、氢氧化钠 均为国产分析纯。
高效液相色谱仪 配备2487紫外检测器和Empower色谱工作站,美国Waters;ALPHA 1-4 LSC冷冻干燥机 德国Christ。
1.2 实验方法
1.2.1 样品的制备 将保加利亚乳杆菌 KLDS 1.0204的种子培养液按3%接种于MRS肉汤液体培养基中,42℃培养至对数生长期中期,取30mL发酵液,离心(7000 × g,5min,4℃),菌体沉淀用生理盐水洗两次,5mL 60%(V/V)甲醇/水(-40℃)的淬灭液与菌体沉淀快速混合,离心(10000×g,5min,-20℃),收集的上清液即为淬灭液,冻干后保存于-80℃。预热至95℃的2mL去离子水迅速倾倒至菌体,沸水浴3min,冰浴上冷却5min,离心(10000×g,5min,4℃),收集的上清液即为胞内提取物,冻干后保存于-80℃直至分析。
1.2.2 色谱条件 色谱柱:SinoChrom ODS-BP C18(5μm,4.6mm ×250mm);流动相:甲醇-30mmol/L 磷酸钾(pH7.0)缓冲液(V∶V=5∶95);紫外检测波长254nm;柱温25℃;流速0.7mL/min;进样量20μL。
1.2.3 标准溶液的配制与曲线的绘制 精密称取一定量的ATP、ADP和AMP标准品,用流动相溶解并定容配制成浓度为100mg/L的储备液。精密吸取储备液,稀释成 50、25、10、5、2.5mg/L,以峰面积为横坐标,腺苷酸的质量浓度为纵坐标绘制标准曲线,求出直线回归方程。
2 结果与分析
2.1 样品前处理条件的选择
将放置在-80℃中的样品取出,用1mL流动相复溶,快速混匀后用0.45μm的滤膜过滤,立即进行色谱分析。这样操作简单,使得在样品量较多的时候检测更及时,避免待测物质的降解。
2.2 流动相的选择
2.2.1 磷酸盐浓度的选择 在柱温25℃和流速1mL/min,比较 50、40、30、20mmol/L 的磷酸盐浓度(pH6.5)对腺苷酸的分离效果。随着磷酸盐浓度的增加,ATP、ADP、AMP的保留值增大,但是盐浓度过大对仪器及色谱柱的腐蚀性也大。当磷酸盐浓度降到20mmol/L,ATP受到干扰峰的影响。其它的磷酸盐浓度均可以较好分离腺苷酸,但是应该选择低浓度且不影响腺苷酸分离效果的磷酸盐浓度,故选择磷酸盐的浓度为30mmol/L。
2.2.2 甲醇浓度的选择 磷酸盐流动相不但会减少色谱柱的使用寿命而且容易堵塞色谱柱和色谱检测器,在流动相中适当添加有机溶剂会减少对色谱柱的伤害。在30mmol/L的磷酸盐流动相(pH6.5)中分别添加5%、10%和15%的甲醇溶液,比较其对腺苷酸的分离效果的影响。实验结果表明,随着甲醇浓度的增加,ATP和 ADP的分离度逐渐降低,添加10%甲醇时,ATP受到干扰峰的影响;添加15%甲醇时,ATP与 ADP分离不开。故本实验采用在30mmol/L磷酸盐流动相中添加5%甲醇溶液。
2.3 pH的选择
腺苷酸在中性或弱酸性的条件下相对稳定。采用1.2.2的色谱条件,比较流动相pH为7.0、6.5和5.5时对腺苷酸的分离效果。随着pH的降低,ATP、ADP和AMP的保留时间逐渐提前,当pH为5.5时,ATP与ATP的峰形开始出现拖尾;当pH分别为7.0、6.5时,ATP和ADP的保留时间基本一致,只是AMP在pH为6.5时,保留时间明显延后。故选取流动相的pH为7.0,在不影响腺苷酸分离效果的基础上,可以对样品进行快速分析检测。
2.4 柱温的选择
对比柱温为25和30℃对腺苷酸分离效果的影响。结果显示柱温为30℃时会导致AMP的峰形出现分叉,而柱温为25℃时ATP、ADP和AMP的分离度和峰形均令人满意。
2.5 流速的影响
设置柱温25℃,分析流动相流速分别为0.5、0.7、1.0mL/min时对腺苷酸分离效果的影响。结果显示流速的改变会直接影响色谱柱柱压和腺苷酸的出峰时间。当流速为0.7mL/min时,分析一个样品仅在10min之内,且色谱柱柱压适中,故选择流速为0.7mL/min。
2.6 腺苷酸的保留时间和线性范围
取ATP、ADP和AMP的各自浓度为10mg/L的标准品溶液,然后按照优化好的色谱条件进行分析,根据各自腺苷酸的保留时间进行定性,腺苷酸标准品的液相分离图谱见图1。
分别精密称量ATP、ADP和AMP标准品,用流动相配制成各自浓度为100mg/L混合标准品,稀释成50、25、10、5和2.5mg/L,共6个浓度的混合标准品,分别进样20μL,以峰面积为横坐标,腺苷酸的质量浓度为纵坐标绘制标准曲线。直线回归方程见表1。由此看出,质量浓度与峰面积有良好的线性关系,相关系数均大于0.9998。
2.7 精密度和回收率实验
2.7.1 精密度实验 取10mg/L的混合标品,分别进行日内和日间精密度测定,结果见表2,说明该法精密度良好。

图1 腺苷酸标准品的HPLC分离图谱Fig.1 HPLC chromatogram of adenosine phosphates standards

表1 腺苷酸的回归方程和相关系数Table 1 Regression equation and correlation coefficient of the adenosine phosphates
2.7.2 加标回收率 在已知浓度的样品中,分别加入高、中、低三种不同的腺苷酸混合标准溶液,按上述方法和条件测定其加样回收率。结果如表3所示,ATP、AMP和 AMP的回收率分别为 94.12%~98.2%,102.5%~103.4%和108.2%~109.6%,RSD均小于3.3%,说明该法比较准确可靠。

表2 腺苷酸测定的精密度实验(n=5)Table 2 Precision of the measured results(n=5)

表3 样品腺苷酸加样回收率实验结果(n=3)Table 3 Recoveries of the measured results(n=3)
2.8 定量检出限
定量限的确定是根据当样品峰的峰高与噪音峰的峰高的比值,即信噪比(RSN),当信噪比为10时的样品浓度即为定量限。利用进样流动相来确定空白的最大噪音峰的峰高,然后通过测定不断稀释ATP、ADP和AMP的标品来确定定量限。ATP、ADP的定量限均为0.25mg/L,AMP的定量限为0.1mg/L。
2.9 评价冷甲醇淬灭保加利亚乳杆菌的效果
对淬灭液和胞内提取物样品按照上述优化好的色谱条件进行分析,色谱图见图2、图3。由表5可见,保加利亚乳杆菌在60%(V/V)甲醇/水(-40℃)的淬灭液淬灭时造成腺苷酸的大量泄漏,表明胞内小分子物质存在大量泄漏;菌体EC=(ATP+1/2 ADP)/(ATP+ADP+AMP)=0.42±0.015,不在正常生长的菌体细胞的0.8~0.9的范围内,表明菌体代谢反应没有完全停止,故该淬灭方案不适合保加利亚乳杆菌的代谢组学研究。虽然60%(V/V)甲醇/水(-40℃)的淬灭液是目前应用最广泛的,但并不是适用于每一种微生物。
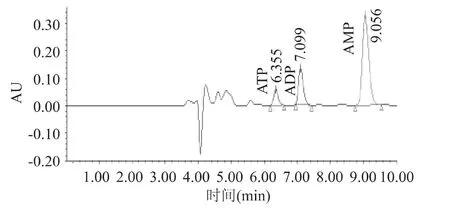
图2 胞内提取物的腺苷酸色谱图Fig.2 HPLC chromatogram of adenosine phosphates in cell extract

图3 淬灭液的腺苷酸色谱图Fig.3 HPLC chromatogram of adenosine phosphates in the supernatant of quenching fluid

表5 样品中腺苷酸含量及胞内代谢物泄露率(n=3)Table 5 The percentage of leaked adenosine phosphates in samples(n=3)
3 讨论与结论
本研究中利用优化的反相高效液相色谱方法,成功地对保加利亚乳杆菌在使用最广泛的60%(V/V)甲醇/水(-40℃)淬灭后的淬灭液和胞内提取物中的腺苷酸进行分离定量,从而反映其淬灭效果,该淬灭液造成的保加利亚乳杆菌腺苷酸的泄露情况与 Hannes L[15]利用 LC-MS 法评价 60%(V/V)甲醇/水(-40℃)淬灭大肠杆菌时造成的泄露情况基本一致,也进一步证明该色谱方法完全可以胜任对代谢组学研究中的淬灭效果的评价。此色谱方法的分离度、精密度、回收率和样品分析时间均取得了令人满意的效果,对今后保加利亚乳杆菌的代谢组学研究中的淬灭液筛选与评价提供了方法支持。
[1]Ongol MP,Sawatari Y,Ebina Y,et al.Yoghurt fermented by Lactobacillus delbrueckii subsp.bulgaricus H+-ATPase-defective mutants exhibits enhanced viability of Bifidobacterium breve during storage[J].International Journal of Food Microbiology,2007,116(3):358-366.
[2]谭文君.保加利亚乳杆菌代谢途径中关键基因的克隆与序列分析[D].天津:天津大学,2009.
[3]程艳宇,李妍,刘晓辉,等.优良保加利亚乳杆菌菌株的筛选及增殖培养[J].中国乳品工业,2010,38(7):11-14.
[4]Aryana KJ,McGrew P.Quality attributes of yogurt with Lactobacillus casei and various prebiotics[J].LWT-Food Science and Technology,2007,40(10):1808-1814.
[5]Pohjanheimo T,Sandell M.Explaining the liking for drinking yoghurt:The role of sensory quality,food choice motives,health concern and product information[J].International Dairy Journal,2009,19(8):459-466.
[6]韩希妍,孙大庆,相丽,等.乳酸菌风味代谢物质的基因调控[J].微生物学报,2007,47(6):1105-1109.
[7]Daniel C,Poiret S,Goudercourt D,et al.Selecting lactic acid bacteria for their safety and functionality by use of a mouse colitis model[J].Applied and Environmental Microbiology,2006,72(9):5799-5805.
[8]Dettmer K,Hammock BD.Metabolomics-A New Exciting Field within the“omics”Sciences[J].Environ Health Perspect,2004,112(7):396-397.
[9]Wurm M,Schöpke B,Lutz D,et al.Microtechnology meets systems biology:The small molecules of metabolome as next big targets[J].Journal of Biotechnology,2010,149(1):33-51.
[10]álvarez-Sánchez B,Priego-Capote F,Luque de Castro MD.Metabolomics analysis II.Preparation of biological samples prior to detection[J].Trends in Analytical Chemistry,2010,29(2):120-127.
[11]Van Gulik WM.Fast sampling for quantitative microbial metabolomics[J].Current Opinion in Biotechnology,2010,21(1):27-34.
[12]Wittmann C,Krömer JO,Kiefer P,et al.Impact of the cold shock phenomenon on quantification of intracellular metabolites in bacteria[J].Analytical Biochemistry,2004,327(1):135-139.
[13]Bolten CJ,Kiefer P,Letisse F,et al.Sampling for metabolome analysis of microorganisms[J].Analytical Chemistry,2007,79(10):3843-3849.
[14]Faijes M,Mars AE,Smid EJ.Comparison of quenching and extraction methodologies for metabolome analysis of Lactobacillus plantarum[J].Microbial Cell Factories,2007,27(6):1-8.
[15]Hannes L,Bernd A,Dirk WB.Leakage of adenylates during cold methanol/glycerol quenching of Escherichia coli[J].Metabolomics,2008,4(3):240-247.
[16]缪宇,王承龙,殷惠军,等.高效液相色谱测定大鼠心肌组织腺苷酸含量[J].北京大学学报:医学版,2005,37(2):201-202.
[17]田岳凤,吴富东,王道东,等.高效液相色谱法测定心肌组织腺苷酸的方法和意义[J].中华中医药学刊,2007,25(1):54-55.
[18]陈建斌,饶邦复,周远大,等.高效液相色谱法测定心肌腺苷酸含量[J].重庆医科大学学报,2003,28(4):485-486.
[19]潘峰,孙玮,路菊,等.高效液相色谱法检测大鼠脑线粒体的腺苷酸[J].第三军医大学学报,2006,28(24):2481-2482.
[20]张玮,倪江,王京花,等.高效液相色谱法检测大鼠子宫内膜腺普酸类物质含量[J].色谱,1993,11(1):60-62.
[21]张春明,刘艺,关承华,等.高效液相色谱测定人血液中腺普酸含量[J].哈尔滨医科大学学报,1992,26(2):96-98.
[22]Liu Hai,Jiang Yueming,Luo Yunbo,et al.A simple and rapid determination of ATP,ADP and AMP concentrations in pericarp tissue oflitchifruitby high performance liquid chromatography[J].Food Technology and Biotechnology,2006,44(4):531-534.
[23]Li Xingtai,Chen Rui,Jin Liming,et al.Regulation on energy metabolism and protection on mitochondria of panax ginseng polysaccharide[J].The American Journal of Chinese Medicine,2009,37(6):1139-1152.
[24]王小红,张卫明,钱骅,等.双孢蘑菇中核苷酸的测定及酶解条件的研究[J].食品工业科技,2010,31(9):171-174.
