明串珠菌SK24.002发酵制备水溶性多糖的初步研究
2013-09-03白爱娟
白爱娟,缪 铭,张 涛,江 波
(江南大学食品科学与技术国家重点实验室,江苏无锡214122)
近年来,老龄化以及与饮食相关的一些疾病如糖尿病、冠心病、某些癌症等已经成为世界性的公共问题。水溶性多糖(water-soluble polysaccharide,WSP)因具有抗氧化性[1]、抗癌[2]、免疫活性[3-4]、低升糖指数[5-6]等多种生理功能,越来越受到关注。水溶性多糖是食品、药品以及化妆品的重要组成成分,一般利用热水、热NaOH溶液或酸溶液从大量的药用植物、真菌中提取,得率一般小于15%。灰树花多糖具有增强免疫力、稳定血压、降低血糖的功能,优化其提取工艺后多糖的得率达到13.4%[7]。孙元林等[8]人从当归中提取的水溶性多糖具有保护白细胞及淋巴细胞的功能,提取率为10.8%。而蒋剑平[9]对白花蛇舌草水溶性多糖提取工艺优化后,多糖得率仅为6.72mg/g。与传统提取工艺相比,利用发酵工程及酶工程能够更有效、更经济的从细菌、酵母中获得大量的水溶性多糖。作者此前从泡菜中筛选获得了一株水溶性多糖产生菌,本文在此基础上利用该菌生产水溶性多糖并研究了该水溶性多糖的分子量分布以及影响其发酵制备的主要因素。
1 材料与方法
1.1 材料与仪器
明串珠菌SK24.002 保藏于江南大学食品科学与技术国家重点实验室;MRS培养基 称取酪蛋白胨10.0g、牛肉膏10.0g、酵母粉5.0g、葡萄糖5.0g溶于1L蒸馏水中,溶解均匀,后加入乙酸钠5.0g、柠檬酸二胺2.0g、吐温80 1.0mL、K2HPO42.0g、MgSO4·7H2O 0.2g、MnSO4·H2O 0.05g,调节 pH 至 6.8,高压灭菌20min。固体培养基加入15.0g/L的琼脂粉;基础培养基(g/L)蔗糖 100、酵母粉 10、K2HPO410.0、MgSO4·7H2O 0.2、MnSO4·H2O 0.05,pH6.8;乳糖、半乳糖、果糖、葡萄糖、甘露糖、苯酚(重蒸馏试剂)、浓硫酸、无水乙醇 均为分析纯,国药集团化学试剂有限公司;葡聚糖标准品:Dextran T-2000(MW2,000,000)、Dextran T-150(MW150,000)、Dextran T-25(MW25,000)、Dextran T-5(MW5,000)Sigma公司。
CL-40M全自动蒸汽灭菌锅 日本ALP公司;Centrifuge 5804R离心机 德国 Eppendorf公司;Agilent 1100型高效液相色谱仪 配置RI101型示差折光检测器,美国Agilent公司;Waters 600E高效液相色谱仪 配置Waters 600四元输液泵、2410示差折光检测器、7725i进样阀、Empower2色谱工作站,美国Waters公司;722E型可见分光光度计 上海光谱仪器有限公司。
1.2 实验方法
1.2.1 培养方法 种子培养:将甘油管保藏的菌种划线于MRS平板,28℃培养至长出单菌落。挑取单菌落接种到MRS液体培养基中,静置培养至菌液浑浊。
摇瓶发酵培养:按5%的接种量将种子液接入到100mL的发酵培养基中,160r/min,28℃恒温振荡培养48h。
1.2.2 菌重的测定 发酵一定时间后取50mL的发酵液离心(10000r/min,10min),上清液备用,菌体用蒸馏水洗涤三次后置于105℃烘箱中烘干至恒重,测量菌重。
1.2.3 水溶性多糖的提取及含量测定 取等量的无水乙醇(-20℃)与发酵上清液混匀,离心(10000r/min,10min),蒸馏水复溶沉淀,同样方法洗涤3次,最后用蒸馏水复溶沉淀得到水溶性多糖溶液,冷冻干燥后得到水溶性多糖粉末,于干燥皿中保藏。取一定体积的水溶性多糖溶液稀释到合适倍数后,采用苯酚硫酸法测定水溶性多糖的含量[10]。利用单因素实验考察不同碳源、碳源浓度、氮源、氮源浓度、接种量、初始pH、培养温度、装液量对水溶性多糖发酵制备的影响。
1.2.4 水溶性多糖分子量分布测定 采用高效体积排阻色谱法(HPSEC)测定水溶性多糖的分子量分布[11]。测定条件:色谱柱 UltrahydrogelTMLinear柱(300mm×7.8mmid×2),柱温45℃,流动相0.1mol/L NaNO3溶液,流速0.9mL/min,试样5mg/mL水溶性多糖溶液,过0.45μm的纤维素滤膜。将不同分子量的葡聚糖标准品配成3mg/mL的溶液,分别进样。根据标准样的保留时间及相应分子量对数,由GPC软件自动做出分子量校正曲线。参照校正曲线,根据水溶性多样样品的保留时间由GPC软件自动计算出样品的分子量。
1.2.5 发酵液中糖组分含量的测定 采用高效液相色谱法(HPLC)测定。色谱条件:Sugar Pak1钙型阳离子交换柱(6.5mm×300mm),柱温85℃,流动相:超纯水,流速 0.4mL/min,试样:发酵上清液过0.45μm的纤维素滤膜,标准溶液10mg/mL的蔗糖、乳糖、半乳糖、果糖、葡萄糖、甘露糖溶液。
2 结果与讨论
2.1 水溶性多糖的分子量分布
明串珠菌SK24.002在基础培养基上摇瓶发酵培养48h后,按1.2.3的方法提取水溶性多糖,采用HPSEC测定水溶性多糖的分子量分布,结果如表1所示。明串珠菌SK24.002水溶性多糖相对分子量为2.4×106,与 L.mesenteroides NRRL B-1355产生的交替糖及L.mesenteroides B-512FMCM产生的右旋糖酐分子量接近[12-13]。与右旋糖酐相比其粘度低,易获得10%的多糖水溶液,水溶液性质与交替糖相似,呈现乳青色。这可能与多糖的分子链构型有关,在之后的研究中会进一步证明。多分散系数(Mw/Mn)越大表示多糖分子量分布越广,由Mw/Mn值可知该水溶性多糖分子量分布集中。HPSEC图谱为一单峰且对称性良好,也说明明串珠菌SK24.002发酵产生的水溶性多糖分子量分布较为集中。表明利用明串珠菌SK24.002直接发酵可以制备较纯、分子量分布较为集中的水溶性多糖。

表1 明串珠菌SK24.002水溶性多糖分子量分布Table 1 The molecular weight distribution of WSP produced by Leuconostoc sp.SK24.002

图1 明串珠菌SK24.002水溶性多糖HPSEC图Fig.1 Chromatogram of WSP produced by Leuconostoc sp.SK24.002
2.2 营养环境对水溶性多糖发酵制备的影响
2.2.1 碳源及其浓度对水溶性多糖制备的影响 在碳原子数相同的原则下,分别用20g/L的蔗糖、麦芽糖、乳糖,40g/L葡萄糖、果糖,13.3g/L甘油代替基础培养基中的碳源,摇瓶发酵48h后测定菌重及多糖含量,结果如表2所示。从表2中可以看出蔗糖作碳源时,水溶性多糖的产量最高,以其他糖类作碳源时,虽然可以获得较高的菌重但是多糖含量极低,表明明串珠菌SK24.002仅能利用蔗糖产生水溶性多糖,蔗糖可能诱导该水溶性多糖的产生。
分别用 40、60、80、100、120、140、160、180g/L 的蔗糖代替基础培养基的蔗糖,摇瓶培养48h,结果如图2所示。结果显示,随着蔗糖浓度的增加水溶性多糖的含量急剧增加,达到160g/L时达到最高,远远高于植物性水溶性多糖的得率。进行显著性分析发现,140、160、180g/L的蔗糖浓度对多糖含量的影响无显著性,从经济成本考虑选用140g/L的蔗糖浓度。研究发现,蔗糖的浓度一般会影响多糖的分子量分布[14],因此测定了不同蔗糖浓度下水溶性多糖的分子量分布(图2),结果表明高浓度蔗糖条件下水溶性多糖的分子量略低于低浓度蔗糖条件,但是变化不明显,均在106以上。说明在此蔗糖浓度范围内,该水溶性多糖的分子量不受蔗糖浓度的影响。

表2 碳源对明串珠菌SK24.002发酵制备水溶性多糖的影响Table 2 Effects of carbon sources on WSP production by Leuconostoc sp.SK24.002

表3 氮源对明串珠菌SK24.002发酵制备水溶性多糖的影响Table 3 Effect of nitrogen sources on WSP production by Leuconostoc sp.SK24.002
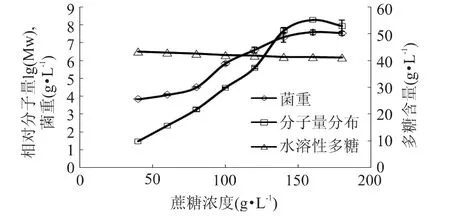
图2 蔗糖浓度对明串珠菌SK24.002水溶性多糖制备的影响Fig.2 Effect of sucrose concentration on WSP production by Leuconostoc sp.SK24.002
2.2.2 氮源及其浓度对水溶性多糖制备的影响 分别将10g/L不同氮源代替基础培养基中的氮源,摇瓶发酵48h后,测定菌重及多糖含量。表3表明胰蛋白胨、牛肉膏及复合氮源作氮源,有利于菌体的生长及多糖的合成,但是采用牛肉膏时产生的水溶性多糖需进行脱色处理,因此从成本角度考虑选用复合氮源,其配比为 1∶1。采用 2.5、5、7.5、10、12.5、15g/L的复合氮源培养,图3显示当氮源浓度为7.5g/L时,多糖含量最高,且菌体生长良好。

图3 氮源浓度对明串珠菌SK24.002水溶性多糖制备的影响Fig.3 Effect of nitrogen sources concentration on WSP production by Leuconostoc sp.SK24.002
2.3 发酵条件对水溶性多糖发酵制备的影响
2.3.1 接种量对水溶性多糖制备的影响 分别取1%、2.5%、5.0%、7.5%、10%的接种量接种到基础培养基中,摇床发酵48h后,测定结果如图4所示。接种量在5%时,多糖获得最大产率。接种量较小时,菌体密度太小,不利于多糖的合成,接种量过大时,菌体生长迅速,初级代谢产物大量合成抑制次级代谢产物的分泌,多糖的合成受到抑制。

图4 接种量对明串珠菌SK24.002水溶性多糖制备的影响Fig.4 Effect of inoculation on WSP production by Leuconostoc sp.SK24.002
2.3.2 初始pH对水溶性多糖制备的影响 调节基础培养基的 pH 为 5.0、5.5、6.0、6.5、7.0、7.5、8.0,发酵48h后,测定菌重及多糖含量。结果如图5所示,pH为7.5时,多糖含量达到最大。

图5 pH对明串珠菌SK24.002水溶性多糖制备的影响Fig.5 Effect of initial pH on WSP production by Leuconostoc sp.SK24.002
2.3.3 发酵温度对水溶性多糖制备的影响 分别在25、28、30、33、35、37℃的条件下,摇瓶发酵 48h 后,测定菌重及多糖含量,结果如图6所示。低温条件下有利于菌体的生长,但多糖合成受到抑制,当发酵温度为30℃时,多糖含量达到最大,高温条件下不利于菌体生长以及多糖合成。温度对水溶性多糖合成的影响主要取决于温度对菌体生长以及水溶性多糖合成酶的影响[14]。
2.3.4 溶氧对水溶性多糖制备的影响 在摇瓶培养中常采用装液量来评价发酵过程中的溶氧量。在250mL 的三角瓶中分别装入 50、75、100、125、150mL的基础培养基,摇瓶发酵48h后,测定菌重及多糖含量,结果如图7所示。从图7中可以看出装液量为100mL时多糖含量最高。明串珠菌SK14.002在厌氧的条件下更利于生长,但稍微增加发酵液中的溶氧有利于水溶性多糖的产生,与Raemaekers等[15]报道的L.mesenteroides NRRL B-1355发酵生交替糖的条件相似。

图6 发酵温度对明串珠菌SK24.002水溶性多糖制备的影响Fig.6 Effect of temperature on WSP production by Leuconostoc sp.SK24.002

图7 装液量对明串珠菌SK24.002水溶性多糖制备的影响Fig.7 Effect of volume of medium on WSP production by Leuconostoc sp.SK24.002
2.4 发酵过程曲线
在上述得到的条件下,连续发酵48h,每隔4h取样测定发酵液的pH、菌重、多糖含量、其他糖分含量,结果如图8所示。从图8可以看出,发酵液中仅存在蔗糖以及果糖,没有其他糖分存在。随着发酵的进行,蔗糖逐渐被消耗,菌体量逐渐增加,发酵液pH下降,多糖、果糖含量增加。菌体增加趋势与pH下降趋势保持一致性,这是由于菌体在生长过程中产生了乳酸等有机酸。多糖及果糖含量增加略滞后于菌体量的增加,表明水溶性多糖的合成集中在菌体生长的对数期及稳定期。水溶性多糖与果糖含量变化趋势一致,两者增加量的和略低于蔗糖减少的量,说明培养基中的蔗糖少部分用于菌体生长,剩余部分用于水溶性多糖的形成同时释放果糖,该水溶性多糖可能为葡聚糖。
发酵到8h菌体量达到最大,pH降低到4.0,之后趋于稳定,发酵到20h左右时,水溶性多糖含量达到51.40g/L。当pH降低到5.0以下时严重影响到菌体的生长,使多糖的合成停止,因此,在扩大到发酵罐时,应在5h时开始补加NaOH溶液并使pH稳定在5.0以上。
3 结论

图8 明串珠菌SK24.002发酵过程曲线Fig.8 Time course of Leuconostoc sp.SK24.002 fermentation
本文研究了明串珠菌SK24.002发酵制备的水溶性多糖的分子量分布以及发酵过程中影响交替糖合成的主要因素。利用明串珠菌SK24.002直接发酵法便可获得相对分子量为2.4×106、分子量分布集中的水溶性多糖。对其发酵条件进行研究发现,蔗糖诱导该水溶性多糖的产生,蔗糖的浓度对其分子量影响不大,均在106以上。多糖形成过程中伴随果糖的释放,140g/L蔗糖、3.75g/L酵母粉、3.75g/L胰蛋白胨利于水溶性多糖的合成;接种量5%、初始pH7.5、发酵温度30℃、装液量100mL/250mL发酵到20h时水溶性多糖含量可达到51.40g/L。利用明串珠菌SK24.002通过发酵工程的方法制备水溶性多糖,产量高、发酵时间短,利于工业化生产。
[1]Xie J H,Xie M Y,Nie S P,et al.Isolation,chemical composition and antioxidantactivitiesofa water-soluble polysaccharide from Cyclocarya paliurus(Batal.)Iljinskaja[J].Food Chem,2010,119(4):1626-1632.
[2]Mantovani M S,Bellini M F,Angeli J P F,et al.β-Glucans in promotinghealth:Prevention against mutation and cancer[J].Mutat Res,2008,658(3):154-161.
[3]Na Y S,Kim W J,Kim S M,et al.Purification,characterization and immunostimulating activity of water-soluble polysaccharide isolated from Capsosiphon fulvescens[J].Int Immunopharmacol,2010,10(3):364-370.
[4]Sato T,Nishimura-Uemura J,Shimosato T,et al.Dextran from Leuconostoc mesenteroides augments immunostimulatory effects by the introduction of phosphate groups[J].J Food Prot,2004,67(8):1719-1724.
[5]Patel S,Majumder A,Goyal A.Potentials of exopolysaccharides from Lactic acid bacteria[J].Indian J Microbiol,2011,52(1):3-12.
[6]Chillo S,Ranawana D V,Pratt M,et al.Glycemic response and glycemic index ofsemolinaspaghettienriched with barley β-glucan[J].Nutrition,2011,27(6):653-658.
[7]廖艳丽,马雪梅,陈贵堂,等.灰树花子实体中水溶性多糖提取工艺优化研究[J].农产品加工学刊,2012(2):11-14.
[8]Sun Y,Tang J,Gu X,et al.Water- soluble polysaccharides from Angelica sinensis(Oliv.)Diels:Preparation,characterization and bioactivity[J].Int J Biol Macromol,2005,36(5):283-289.
[9]蒋剑平,许海顺,卢烨琳,等.响应面分析法优化白花蛇舌草水溶性多糖的提取工艺[J].浙江中医药大学学报,2012,36(2):187-191.
[10]包怡红,刘奇,王薇.酿酒酵母胞外多糖发酵工艺条件优化[J].酿酒,2012,39(2):58-62.
[11]戴军,陈尚卫,朱松,等.不同来源灵芝孢子粉的多糖分子量分布分析与比较[J].食品与机械,2010(1):12-14.
[12]Côté G L.Low-viscosity α-D-glucan fractions derived from sucrose which are resistant to enzymatic digestion[J].Carbohydr Polym,1992,19(4):249-252.
[13]Kim D,Robyt J F,Lee S Y,et al.Dextran molecular size and degree of branching as a function of sucrose concentration,pH,and temperature ofreaction ofLeuconostoc mesenteroides B-512FMCM dextransucrase[J].Carbohydr Res,2003,338(11):1183-1189.
[14]Lopez-Munguia A,Pelenc V,Remaud M,et al.Production and purification of alternansucrase,a glucosyltransferase from Leuconostoc mesenteroides NRRL B-1355,for the synthesis of oligoalternans[J].Enzyme Microb Technol,1993,15(1):77-85.
[15]Raemaekers M H M,Vandamme E J.Production of alternansucrase by Leuconostoc mesenteroides in batch NRRL B-1355 fermentation with controlled pH and dissolved oxygen[J].J Chem Tech Biotechnol,1997,69(4):470-478.
