11个德国甜菜品种指纹图谱的构建
2013-09-03吴则东王华忠马龙彪王茂芊
吴则东 ,王华忠 ,马龙彪 ,王茂芊
(1.黑龙江省普通高等学校甜菜遗传育种重点实验室,哈尔滨 150080;2.中国农业科学院甜菜研究所/黑龙江大学农作物研究院,哈尔滨 150080;3.中国农业科学院北方糖料作物资源与利用重点开放实验室,哈尔滨 150080)
甜菜是我国北方重要的经济作物,建国后,我国的甜菜育种事业开始起步,从引进国外的品系到育成自己的甜菜品种。而甜菜的种植面积也由建国时的1.59万公顷增加到1998年的41.5万公顷[1],此后,我国甜菜种植面积开始萎缩,目前甜菜种植面积基本维持在22万公顷[2]。从2000年开始,国外的甜菜品种开始进入我国,并陆续占领中国甜菜种子市场,目前国外甜菜品种已经占到中国甜菜种子市场的95%以上,其中德国KWS公司是外国公司在我国甜菜种子方面开展活动时间最长、范围最广、推出品种及育种材料最多、种子繁殖及销售量最大的公司[3]。而德国斯特儒博公司的甜菜品种近几年来在我国的种植面积也在逐年增大。
目前我国对甜菜品种的鉴别依然采用形态学的方法,此种方法不仅鉴定周期长,而且准确率差。由于SSR标记具有简单、共显性、条带清晰、重复性好等特点已经广泛地应用到作物品种指纹图谱的构建[4]。目前甜菜SSR引物已经有上千对[5],完全能够满足品种指纹图谱的构建。笔者选择生产上大面积推广种植的德国品种KWS0143、KWS2409、KWS5145[6],以及近几年刚刚审定命名的德国品种,利用SSR分子标记进行指纹图谱的构建,以期为品种鉴定以及维护育种公司以及农民的利益提供参考依据。
1 材料与方法
1.1 供试材料
实验用的11份德国进口的甜菜品种分别来自于德国的KWS公司和斯特儒博公司,所有的品种均由国内甜菜研究机构提供。品种名称及来源见表1。
1.2 方法
1.2.1 DNA提取 将11份甜菜种子播种于黑龙江大学呼兰校区温室营养钵中,待长到4片真叶时,每个品种取10株,经真空冷冻干燥机处理后,将叶片打磨成干粉,利用碱裂解法[7]快速提取甜菜基因组DNA,经λDNA 检测后,最后稀释到 10ng/μL。
1.2.2 引物 我们从黑龙江大学农作物研究院重点实验室筛选出来的核心引物中选择了5对多态性相对较高、带型清晰、易分辨且重复性好的引物,它们是 SB09[8]、S6、S7[9]、SB04[8]和 S2[9](表 2),引物由上海生工合成,HAP 纯化,每对引物均按照说明稀释到10μM的工作液。
1.2.3 SSR体系及 PCR程序 反应体系为 10μL,其中包括 10×PCR buffer 1μL, 模板 DNA 1μL,0.5μL dNTPs(2.5mM each),10μM的正反向引物各0.4μL,Taq DNA聚合酶0.5U,最后加灭菌去离子水至总体积10μL。 PCR 程序:95℃预变性 1min,然后 94℃变性 40s,54℃退火 40s,最后 72℃延伸 40s,35个循环;反应结束后,再72℃延伸5min,4℃保存。扩增反应在PTC-100上进行。扩增产物于8%的非变性聚丙烯酰胺凝胶电泳上分离,然后采用快速银染法[10]显色并照相记录。

表1 品种来源及其编号

表2 SSR核心引物及其序列
1.2.4 数据处理 每个电泳的泳带按照分子量从大到小进行记录,在相同的位置上,有带记为1,无带记为0,利用0和1数字构建11个品种的指纹图谱。
2 结果与分析
2.1 SSR引物的扩增
SSR扩增银染结果见图1,从图中我们可以看出,每对引物均扩增出了清晰的条带,每条引物扩增出的条带最多是8条,最少是2条,这5对引物共扩增出34个条带,其中31个为多态性条带,多态性条带占到总条带的91.17%。
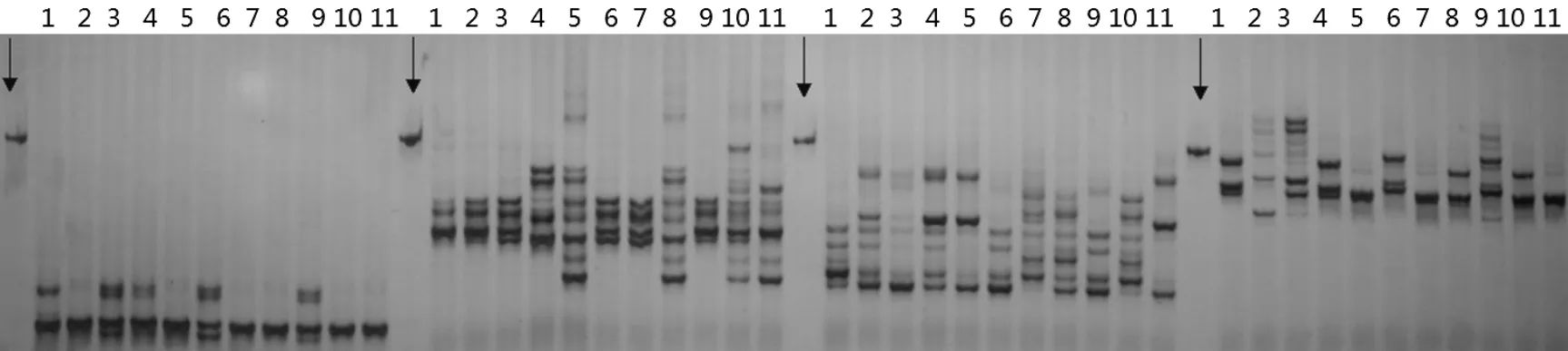
图1 8%聚丙烯酰胺凝胶银染图
2.2 SSR指纹图谱的构建
虽然我们选择的4对SSR引物均具有很高的多态性,但是由于甜菜的遗传基础比较狭窄,所以任何单一的一对引物都不能够将所有的11个甜菜品种区分开来,从银染图可以清晰地看出,单独的SB04可以区分开2、3和9号品种,S6能够区分开4、10和11号品种,S7能够区分开1、3和7号品种,S2能够区分开1、5和8号品种,而SB09中没有特异性的条带,不能单独用于品种的区分。除了6号品种外,其余10个品种的鉴别只需要利用能够区分此品种的引物进行扩增,然后再和标准指纹图谱进行比对,就可确认品种的真伪及其纯度。而利用S6和S7两对引物就可以很好地把6号品种区分开。
3 结论与讨论
传统的品种纯度鉴定的方法大都采用形态学鉴定法,形态学鉴定法不仅周期长,而且鉴定的效果差,容易受到环境条件的影响。而以分子标记为基础的品种纯度和真实性的鉴定技术不受环境条件的影响,鉴定时间短,准确度高。而目前的分子标记技术中,RAPD重复性较差,AFLP不仅有专利条件的限制,而且操作复杂,一般的实验室难以掌握,而SRAP条带较多,统计困难[11];SSR分子标记因其条带较少、统计方便、重复性好而在种子纯度和真实性鉴定中备受青睐。目前国家品种鉴定的行业标准都是以SSR分子标记为基础的,如GB/T1433-2007《三系杂交水稻及亲本真实性和品种纯度鉴定DNA分析方法》、NY/T1433-2007《水稻品种鉴定DNA指纹方法》、NY/T1432-2007《玉米品种鉴定DNA指纹方法》、DB51/T808-2008《杂交玉米品种真实性和纯度SSR分子检测技术方法》等等[12]。本文利用特殊引物法及指纹技术首次构建了11个德国引进品种的指纹图谱,为解决将来可能出现的品种纠纷打下了坚实的技术基础。
致谢:非常感谢内蒙古自治区农牧业科学院甜菜研究所、新疆农业科学院经济作物研究所、新疆石河子农科中心甜菜研究所在甜菜品种提供上给予的帮助。
[1]王桂艳,鞠平.我国甜菜制糖工业五十年回眸[J].中国甜菜糖业,2001(2):28-30.
[2]范素香,侯书林,赵匀.国内外甜菜生产全程机械化概况[J].农机化研究,2011,33(3):12-15.
[3]倪洪涛,吴则东.甜菜品种及其评价[J].北京:化学工业出版社,2011:1-208.
[4]李丽,王海岗,张晓丽,等.SSR分子标记在作物遗传育种中的应用[J].山西农业科学,2008(3):15-18.
[5]史树德,魏磊,张子义,等.甜菜 EST-SSR 引物的开发与应用[J].中国糖料,2011(3):1-5.
[6]马亚怀,邱军,陈连江,等.我国甜菜品种引进工作的现状与分析[J].中国糖料,2013(1):72-75.
[7]陈文岳,包劲松,周祥胜,等.一种可用于PCR分析的水稻DNA简易提取法[J].中国水稻科学,2005(6):561-563.
[8]Richards CM,Brownson M,Mitchell SE,et al.Polymorphic microsatellite markers for inferring diversity in wild and domesticated sugar beet(Beta vulgaris)[J].Molecular Ecology Notes,2004,4(2):243-245.
[9]牛泽如,杨文柱,庞磊,等.基于 ISSR 和 AFLP 标记开发甜菜 SSR 引物[J].中国农学通报,2010(21):147-151.
[10]王凤格,赵久然,郭景伦,等.一种改进的玉米SSR标记的PAGE/快速银染检测新方法[J].农业生物技术学报,2004(5):606-607.
[11]文雁成,王汉中,沈金雄,等.SRAP和SSR标记构建的甘蓝型油菜品种指纹图谱比较[J].中国油料作物学报,2006(3):233-239.
[12]赵耀,刘康,李仕钦,等.种子质量检测工作的思考与体会[J].中国种业,2011,194(6):42-43.
