姜黄素上调caspase-3和p53表达后对人肺癌干细胞增殖与侵袭的影响
2013-09-01赵雅瑞张立凡刘特
赵雅瑞 张立凡 刘特
(1.上海医药职工大学,上海 200050;2.复旦大学附属华东医院胸外科,上海 200040;3.上海中医老年医学研究所,上海 200031)
在过去的20年中,肺癌的发病率和病死率不断上升,且患者有年轻化的趋势。目前越来越多的研究[1-2]证实,在许多肿瘤组织中,存在一群特殊的具有很强的增殖和侵袭能力细胞亚群,对多种化疗药物具有耐受性;该细胞亚群还表达胚胎干细胞的部分生物学标志物。基于上述特征,该肿瘤细胞亚群被称为肿瘤干细胞或肿瘤起始细胞(carcinoma-initiating cells,CICs)。肺癌细胞中也存在CICs,该类细胞高表达CD44+和CD133+蛋白,且具有很强的化疗药物耐受性。因此,寻找能够有效抑制CICs增殖的药物显得十分重要。姜黄素是从姜黄属(Curcuma longa L.)植物根茎中提取的一种多酚类物质,被广泛应用于食品色素添加剂,具有显著的抗氧化、抗突变作用。近期研究[3]证实,姜黄素可以抑制多种肿瘤细胞(如肝癌细胞、淋巴瘤细胞、前列腺癌细胞、结肠癌细胞等)的增殖和侵袭。本研究以肺癌CICs作为研究对象,探讨姜黄素通过调控肿瘤增殖相关基因caspase-3和p53的表达来实现对该类细胞体外增殖和侵袭的抑制作用。
1 资料与方法
1.1 细胞及主要试剂 人肺癌细胞株A549和姜黄素由复旦大学附属华东医院实验室保存。四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO)、核糖核酸酶 A(ribonuclease A,RNase A)购自美国 Sigma公司。DMEM细胞培养基、胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司。兔抗人CD44-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)抗体、兔抗人CD133-藻红蛋白(phycoerythrin,PE)抗体、兔抗人p53抗体、兔抗人caspase-3抗体及兔抗人GAPDH抗体购自美国CST公司。
1.2 肺癌CICs筛选与培养 依据参考文献[4]的方法。A549细胞用 DMEM培养基[内含10%FBS、青-链双抗(青霉素 100 U/mL、链霉素 100 U/mL)]置于37℃,体积分数5%CO2孵箱中培养。选取处于对数生长期的A549细胞,用0.25%胰蛋白酶-EDTA处理后,离心收集细胞沉淀,然后分别加入2 μL兔抗人 CD44-FITC抗体和2 μL兔抗人CD133-PE抗体,4℃下孵育30 min,用PBS清洗1次,并重悬细胞。取500 μL细胞悬液(细胞浓度调整为2×107/mL),用流式细胞仪进行细胞分选,并收集表达CD44+/CD133+的肺癌CICs。按实验要求,将细胞分为3组:空白对照组(不作任何处理的细胞组);姜黄素处理组(IC50浓度姜黄素处理的细胞组);阴性对照组(加入DMSO处理的细胞组)。
1.3 MTT比色法检测肺癌CICs增殖抑制 将空白对照组、阴性对照组和姜黄素处理组细胞接种于96孔细胞培养板中(密度为2×103/孔),置于37℃、含5%CO2孵箱中培养,当细胞生长至指数期时,分别加入不同浓度的姜黄素(0、5、10、20、40、60、80、100 μmol/mL)进行干预,并于24 h后检测。在检测前4 h加入MTT 20 μL(5 mg/L),继续培养4 h。离心去上清液,加入DMSO溶解沉淀。用酶标仪在490 nm波长处读取所对应的吸光度(OD490值),设立3个复孔,取其平均值。测得各孔吸光度数值,计算公式:(1-实验组OD490值/对照组OD490值)×100%,计算出姜黄素对肺癌CICs的IC50浓度。
1.4 实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)检测增殖相关基因转录的影响 按照Trizol Reagent说明书的方法,抽提各组细胞的总RNA,并经实时荧光定量PCR生成cDNA。以各组cDNA作为模板,在实时荧光定量PCR仪上利用两步法进行实时荧光定量PCR,根据mRNA的相对变化量公式[Ratio=2-ΔΔCt,其中 ΔΔCt=(ΔCtSample Group-ΔCtBlank Control)]计算目标片段的扩增比例。扩增产物以2%琼脂糖凝胶电泳进行观察。各样本重复实验3次,以18S rRNA作为内参照。目标片段的扩增引物序列为:caspase-3-FP:5'-CTGCCTCTTCCCCCATTCT-3';caspase-3-RP:5'-TCGCTTCCATGTATGATCTTTG-3';p53-FP:5'-GCTTTCCACGACGGTGAC-3';p53-RP:5'-GCTCGACGCTAGGATCTGAC-3';18S rRNA-FP:5'-CGTTGATTAAGTCCCTGCCCTT-3';18S rRNA-RP:5'-TCAAGTTCGACCGTCTTCTCAG-3'。两步法中退火温度为58℃,扩增循环数为40次。
1.5 Western blot检测增殖相关蛋白表达量 于转染24 h后收集各组细胞(根据Western blot试剂盒说明书中的步骤),抽提各组细胞的总蛋白,利用Lowry法测定总蛋白浓度,以每个泳道20 μg浓度的蛋白样品上样,经30%变性十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳后,利用半干电转化法将蛋白转移至PVDF膜上,经过封闭、一抗(稀释倍数1∶1000)孵育、PBST洗脱、HRP标记的二抗(稀释倍数1∶500)孵育、PBST再洗脱等步骤后,增强化学发光法(enhanced chemiluminecence,ECL)化学发光及X线片曝光,并且经定影、显影处理,获得清晰条带。利用BandScan软件分析各条带的灰度值。
1.6 Transwell小室侵袭实验检测姜黄素对肺癌CICs体外侵袭能力的影响
1.7 统计学处理 采用SPSS 10.0统计软件进行分析,计量资料以均数±标准差()表示,采用方差分析(ANOVA)或独立样本t检验进行比较,P<0.05为差异有统计学意义。
2 结 果
2.1 姜黄素有效抑制肺癌CICs体外增殖 MTT比色法检测结果显示,在低质量浓度姜黄素(5、10和20 μmol/mL)作用下,姜黄素处理组细胞增殖抑制率与阴性对照组及空白对照组比较,差异无统计学意义(P>0.05,n=6)。而当姜黄素质量浓度增加至40 μmol/mL时,姜黄素处理组的细胞增殖抑制率显著大于阴性对照组和空白对照组(P<0.01,n=6),而阴性对照组的细胞增殖抑制率与空白对照组比较差异无统计学意义(P>0.05,n=6)。本实验结果表明,姜黄素对于肺癌CICs具有抑制增殖效果,且当质量浓度增加时,细胞的增殖抑制率也显著增加。姜黄素对于肺癌CICs的增殖抑制作用呈剂量正相关,见图1。按照公式计算,姜黄素处理肺癌CICs 24 h 的姜黄素 IC50 为61.06 μmol/mL。
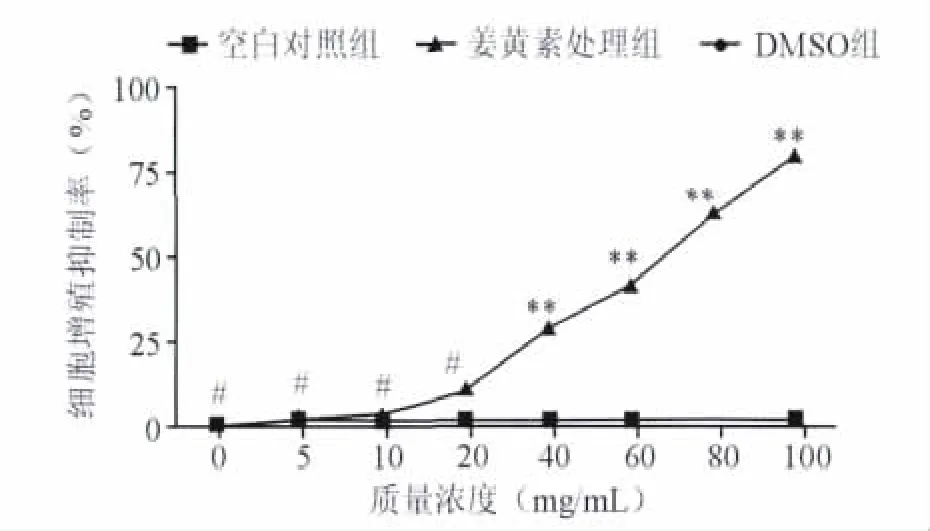
图1 MTT比色法检测肺癌CICs增殖抑制率
2.2 姜黄素对肺癌CICs增殖相关基因转录的影响实时荧光定量PCR检测肿瘤CICs增殖相关基因caspase-3和p53的mRNA表达结果显示,姜黄素处理组细胞中caspase-3和p53基因mRNA的表达水平(3.64 ±0.59,4.98 ±0.82)高于阴性对照组(1.00 ±0.04,0.99 ±0.07)和空白对照组(0.99 ±0.07,1.03 ±0.27),差异有统计学意义(P 均 <0.01),见图2。结果表明,姜黄素能有效地活化肿瘤增殖抑制因子p53和凋亡因子caspase-3基因转录,由此抑制肺癌CICs在体外增殖。
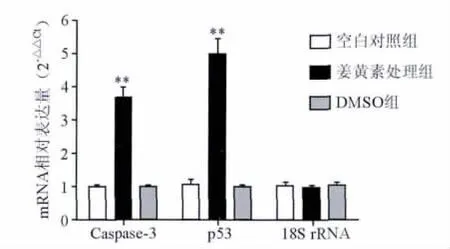
图2 实时荧光定量PCR检测caspase-3和p53基因的表达
2.3 姜黄素对肺癌CICs增殖相关蛋白表达的影响Western blot检测肿瘤凋亡相关蛋白caspase-3和p53的表达结果显示,姜黄素处理组细胞中caspase-3和 p53蛋白表达水平(0.65 ±0.12,0.43 ±0.05)高于阴性对照组(0.05 ±0.02,0.08 ±0.03)和空白对照组(0.09 ±0.03,0.12 ±0.17),差异有统计学意义(P <0.01 和0.05,n=3),见图3。姜黄素可以有效地上调肿瘤增殖抑制因子p53蛋白和凋亡因子caspase-3蛋白的表达,由此抑制肺癌CICs在体外的增殖。

图3 CICs中的caspase-3和p53蛋白表达
2.4 姜黄素抑制肺癌CICs的侵袭 采用Transwell小室侵袭实验检测各组肺癌CICs细胞在体外的影响,结果显示,姜黄素处理组侵袭细胞数(26±15)少于阴性对照组(82±13)和空白对照组(78±12),差异有统计学意义(P<0.01)。而阴性对照组与空白对照组细胞侵袭数比较差异无统计学意义(P>0.05)。见图4。姜黄素可以有效地削弱肺癌CICs在体外基质中的迁移与侵袭能力。
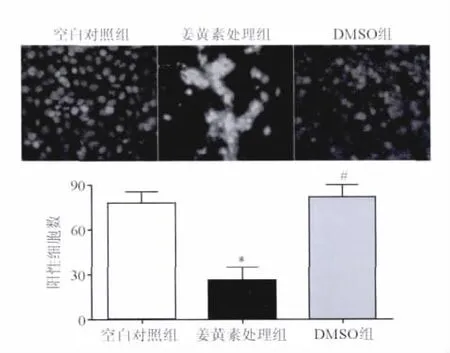
图4 Transwell小室实验检测的肺癌CICs在体外的侵袭影响
3 讨 论
目前关于姜黄素对CICs的作用机制的研究较少。姜黄素对CICs是否存在显著的增殖抑制作用尚不明确。本研究通过分离肺癌CICs,利用相关分子生物学和细胞学技术,分析姜黄素对体外肺癌CICs增殖和侵袭的影响。本研究结果表明,随着姜黄素质量浓度的提高,肺癌CICs的增殖抑制率也显著提高。同时,姜黄素可以显著提高肺癌CICs内caspase-3和p53基因mRNA和蛋白的转录和表达。caspase-3是死亡受体介导的凋亡途径中关键的启动因子。caspase-3能够通过寡聚而自身切割活化,并能激活下游半胱氨酸蛋白酶,产生凋亡效应。caspase-3在诱发细胞凋亡及细胞增殖抑制等方面发挥着重要的作用。而p53蛋白是广谱的肿瘤抑制因子,是细胞生长周期中的负调节因子,与细胞周期的调控、DNA修复、细胞凋亡与肿瘤复发转移等重要的生物学功能有关[5-7]。本研究证实,姜黄素激活p53和caspase蛋白的表达后可抑制肺癌CICs体外增殖。Transwell小室侵袭实验还揭示了姜黄素可以有效抑制肺癌CICs的侵袭能力。
[1] Lundin A,Driscoll B.Lung cancer stem cells:Progress and prospects[J].Cancer Lett,2012,17(3):239-245.
[2] Nurwidya F,Murakami A,Takahashi F,et al.Lung cancer stem cells:Tumor biology and clinical implications[J].Asia Pac J Clin Oncol,2012,8(3):217-222.
[3] Metzler M,Pfeiffer E,Schulz SI,et al.Curcumin uptake and metabolism[J].Biofactors,2013,39(1):14-20.
[4] Gao Y,Liu T,Cheng W,et al.Isolation and characterization of proliferative,migratory and multidrug-resistant endometrial carcinoma-initiating cells from human typeⅡendometrial carcinoma cell lines[J].Oncol Rep,2012,28(2):527-532.
[5] Shadfan M,Lopez-Pajares V,Yuan ZM.MDM2 and MDMX:Alone and together in regulation of p53[J].Transl Cancer Res,2012,1(2):88-89.
[6] Inoue K,Kurabayashi A,Shuin T,et al.Overexpression of p53 protein in human tumors[J].Med Mol Morphol,2012,45(3):115-123.
[7] Prabhu VV,Allen JE,Hong B,et al.Therapeutic targeting of the p53 pathway in cancer stem cells[J].Expert Opin Ther Targets,2012,16(12):1161-1174.
