hedgehog信号通路的负调控基因在早期非小细胞肺癌中的甲基化状态及其意义
2013-09-01耿峻峰孙晋枫林强顾峻赵仰星王韦张红宇何英华余坚
耿峻峰 孙晋枫 林强 顾峻 赵仰星 王韦 张红宇 何英华 余坚
(1.上海交通大学附属胸科医院胸外科,上海 200030;2.复旦大学附属中山医院,上海 200032;3.上海交通大学医学院仁济医院,上海市肿瘤研究所,癌基因及相关基因国家重点实验室,上海 200032)
近年来,我国的肺癌发病率不断升高,肺癌的病死率已跃居肿瘤死因之第一位[1]。85%的肺癌患者为非小细胞肺癌(NSCLC)[2]。NSCLC患者的预后主要取决于能否得到早期诊断和治疗。据文献[3]报道,ⅠA期 NSCLC患者的 5年生存率达73%,而ⅢA期NSCLC患者的5年生存率仅为25%。因此,寻找理想的NSCLC生物学标志物对NSCLC的早期诊断至关重要。目前,目标基因的甲基化状态在肿瘤的早期诊断中已彰显出优势[4]。
hedgehog信号通路在肿瘤发生、发展中的作用越来越受到重视。我们研究了hedgehog信号通路的3个负调控基因:生长停顿特异蛋白1(growth arrest specific1,GAS1)、人类hedgehog相互作用蛋白(human hedgehog interacting protein,HHIP)和 patched1(PTCH1)在早期NSCLC患者肺癌组织中的甲基化状态,探讨它们在NSCLC早期诊断中的价值。
1 资料与方法
1.1 一般资料 采用随机数字表法选取2007—2011年上海交通大学附属胸科医院收治的Ⅰ期NSCLC患者85例(NSCLC组),其中男性66例,女性19例;年龄32~79岁,平均(61.67±9.41)岁;其中鳞癌30例,腺癌51例,腺鳞癌4例。另选同期住院的23例非肿瘤性肺部疾病患者作为对照组,其中男性17例,女性6例;年龄42~75岁,平均(59.95±9.42)岁;其中肺结核5例,支气管扩张3例,肺脓肿4例,迁延性肺炎2例,肺硬化性血管瘤3例,肺巨大淋巴结增生1例,肺错构瘤2例,肺隔离症1例,肺炎性假瘤2例。
1.2 细胞株 肺腺癌细胞株 A549(编号:CCL-185TM)、NSCLC细胞株 NCI-H1299(编号:CRL-5803 TM)以及肺大细胞癌细胞株NCI-H460(编号:HTB-177TM)均购自美国典型培养物保藏中心(A-merican Type Culture Collection,ATCC),肺腺癌细胞株LTEP-a-2(编号:TCHu 33)及 SPC-A-1(编号:TCHu 53)均购自中国科学院上海生命科学研究院细胞资源中心。
所有肺癌细胞株均采用含10%胎牛血清的DMEM培养基于37℃、5%CO2(体积分数)、饱和湿度条件下培养。
1.3 方法
1.3.1 采用生物信息学方法分析hedgehog通路的负调控基因在NSCLC全基因组甲基化谱式数据库中的甲基化状况 本课题组前期采用Methylcap-seq方法建立了NSCLC及其癌旁组织的全基因组甲基化谱式数据库,实验方法见前期发表论文[5]。在本研究中,以该数据库(信息未公开)信息为基础,以10kb DNA长度为窗口显示范围,定位于hedgehog通路基因5’端启动子区域的CpG岛,以甲基化峰值高低作为判断基因启动子区域甲基化程度的标准,峰值高低与甲基化程度正相关。
1.3.2 基因组DNA的亚硫酸氢盐修饰 (1)提取基因组DNA后,取1 μg DNA,补水至终体积为20 μL;(2)加入3 mol/L氢氧化钠溶液至质量终浓度为0.3 mol/L,混匀后在37℃环境放置20 min;(3)加入亚硫酸氢钠230 μL后混匀,加石蜡油覆盖液面,90℃环境放置30 min;(4)样品脱盐及磺酸根置换采用博大泰克生物科技有限公司生产的胶回收试剂盒,吸去石蜡油后,加入500 μL溶胶液,混匀后过柱,用漂洗液漂洗1次,然后加入0.3 mol/L氢氧化钠溶液(含50%乙醇)300 μL,在室温放置15 min,9000 r/min离心30 s,去除废液,漂洗液漂洗2次;(5)用200 μL TE缓冲液洗脱后,保存于-20℃。
1.3.3 引物设计及合成 采用MethPrimer软件进行引物设计,引物由上海赛百盛生物科技有限公司合成,引物序列见表1。
1.3.4 甲基化特异性聚合酶链反应(methylationspecific polymerase chain reaction,MSP)方法 反应条件:94℃预变性3 min;94℃变性20 s,58℃退火20 s,72℃延伸20 s,35个循环;72℃完全延伸1 min。MSP结束后,将产物用1.5%的琼脂糖凝胶电泳分析,并选择有代表性的条带割胶回收后,作T-A克隆并送上海杰李生物科技有限公司测序。
1.4 统计学处理 采用SPSS 13.0软件进行统计学分析。计数资料采用Fisher精确检验进行分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 hedgehog通路的负调控基因在NSCLC全基因组甲基化谱式数据库中的甲基化状况 生物信息检索结果显示,与NSCLC癌旁组织相比,GAS1、HHIP和PTCH1在NSCLC癌组织中均呈不同程度的高甲基化状态,见图1。hedgehog负调控基因在NSCLC细胞株中的甲基化状态,见表2。

表1 引物序列

图1 NSCLC癌组织及癌旁组织的全基因甲基化组学数据库中hedgehog信号通路负调控基因的甲基化状态
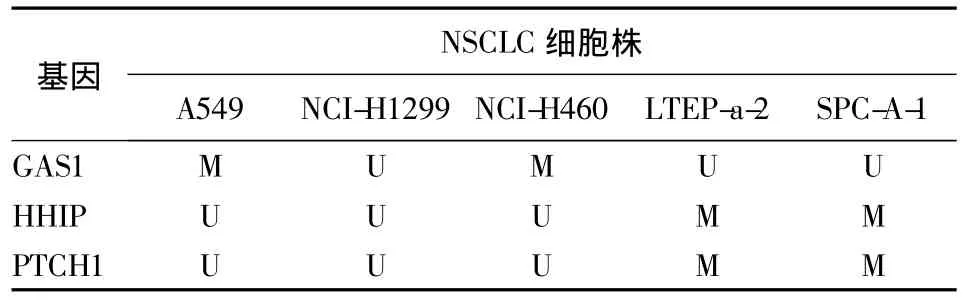
表2 NSCLC细胞株中各基因的甲基化状态
2.2 hedgehog负调控基因在NSCLC组及对照组中的甲基化状态 2组部分患者DNA样品的MSP产物的电泳情况见图2。
统计分析显示,GAS1、HHIP和 PTCH1在NSCLC组的甲基化率高于对照组,差异有统计学意义(P<0.05)。这3个基因的甲基化检测用于诊断临床Ⅰ期NSCLC的敏感性和特异性见表3。
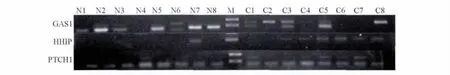
图2 2组部分患者MSP产物的电泳图

表3 GAS1、HHIP和PTCH1的甲基化检测用于诊断Ⅰ期NSCLC的敏感性和特异性
3 讨 论
hedgehog信号通路参与发育过程中许多生长及分化过程的调控,是进化中最保守的信号途径之一,GAS1、HHIP和PTCH1是该信号通路中的3个负调控基因[6]。hedgehog信号通路的异常不仅与出生缺陷、肥胖等多种发育异常相关,而且与肿瘤的发生发展相关。hedgehog信号通路与肿瘤的关系最早在神经胶质瘤中被证实[7],其后多项研究[8-10]表明,它与肝癌、肺癌、胰腺癌、前列腺癌等许多肿瘤相关。
一般认为,肿瘤的发生主要是由于致癌因素造成DNA序列变异而致细胞生长、分化失控。近年来,随着研究的深入,人们发现DNA序列改变以外的调控机制异常在肿瘤的发生、发展过程中更为普遍和重要,这种不依赖于DNA序列变化的可遗传的调控机制被称为表观遗传学机制,包括组蛋白乙酰化、DNA甲基化、染色质重塑、microRNA以及非编码长RNA的调控等,其中以DNA甲基化在肿瘤中的研究最为深入和广泛。抑癌基因、DNA修复基因、细胞周期控制基因和抗凋亡基因等一些在正常细胞中处于低甲基化状态的基因常被发现在肿瘤细胞中呈现异常高甲基化状态而转录失活,据此考虑其参与了肿瘤的发生发展或导致肿瘤细胞生长失控。近年来,随着DNA甲基化在基因层面、全基因组层面以及功能调控领域的广泛研究,DNA甲基化在肿瘤诊断和治疗中的应用越来越受到重视。
我们前期应用Methylcap-seq技术建立了NSCLC全基因组甲基化谱式。本研究我们在前期工作的基础上采用生物信息学分析GAS1、HHIP和PTCH1的甲基化状态,结果发现与癌旁正常组织相比,3个基因在NSCLC中呈异常甲基化。采用MSP方法进一步分析3个基因在肺癌细胞株基因组DNA中的甲基化状态,结果发现,除在NCI-H1299中3个基因均呈去甲基化状态以外,在其他4个肿瘤细胞株中均有1~2个基因呈甲基化状态。随后,对3个基因在85例临床Ⅰ期NSCLC癌组织和23例非肿瘤肺部疾病组织中的甲基化状态进行了检测,结果显示,3个基因在NSCLC组中的甲基化率与对照组差异有统计学意义,提示GAS1、HHIP和PTCH1在临床Ⅰ期NSCLC中均表现为异常高甲基化。由此推断,hedgehog信号通路中的这3个基因的异常高甲基化以及失活是NSCLC发生的早期事件。hedgehog信号通路的异常激活及其下游的一系列信号通路的异常可能是NSCLC发生发展的驱动因素。
综上所述,GAS1、HHIP和 PTCH1在临床Ⅰ期NSCLC肺癌组织中均存在显著异常甲基化,这可能是hedgehog通路被异常激活的重要因素。对这3个基因在早期NSCLC患者血浆游离DNA中的甲基化状态的进一步阐明,并进行大样本量的临床试验,那么,这有望为NSCLC的早期诊断提供新的肿瘤分子生物学标志物。
[1] Chen W,Zhang S,Zou X.Estimation and projection of lung cancer incidence and mortality in China[J].Zhongguo Fei Ai Za Zhi,2010,13(5):488-493.
[2] Molina JR,Yang P,Cassivi SD,et al.Non-small cell lung cancer:epidemiology,risk factors,treatment,and survivorship[J].Mayo Clin Proc,2008,83(5):584-594.
[3] Besse B,Le Chevalier T.Adjuvant or induction cisplatin-based chemotherapy for operable lung cancer[J].Oncology(Williston Park),2009,23(6):520-527.
[4] Feinberg AP.Cancer epigenetics is no Mickey Mouse[J].Cancer Cell,2005,8(4):267-268.
[5] Zhao Y,Guo S,Sun J,et al.Methylcap-seq reveals novel DNA methylation markers for the diagnosis and recurrence prediction of bladder cancer in a Chinese population.PloS One,2012,7(4):e35175.
[6] Østerlund T,Kogerman P.Hedgehog signalling:how to get from Smo to Ci and Gli[J].Trends Cell Biol,2006,16(4):176-180.
[7] Kenney AM,Cole MD,Rowitch DH.Nmyc upregulation by sonic hedgehog signaling promotes proliferation in developing cerebellar granule neuron precursors[J].Development,2003,130(1):15-28.
[8] Bailey JM,Mohr AM,Hollingsworth MA.Sonic hedgehog paracrine signaling regulates metastasis and lymphangiogenesis in pancreatic cancer[J].Oncogene,2009,28(40):3513-3525.
[9] Kim Y,Yoon JW,Xiao X,et al.Selective down-regulation of glioma-associated oncogene 2 inhibits the proliferation of hepatocellular carcinoma cells[J].Cancer Res,2007,67(8):3583-3593.
[10] Sanchez P,Hernández AM,Stecca B,et al.Inhibition of prostate cancer proliferation by interference with SONIC HEDGEHOGGLI1 signaling[J].Proc Natl Acad Sci U S A,2004,101(34):12561-12566.
