盐度、温度和pH 对2 株海南地衣芽孢杆菌相对蛋白酶活性的影响
2013-08-29朱彦博唐叶玲陈圣丰吴海武郭伟良冯永勤王世锋周永灿谢珍玉
朱彦博,唐叶玲,陈圣丰,吴海武,郭伟良,冯永勤,王世锋,周永灿,谢珍玉
(海南大学 海南省水生生物技术重点实验室,海南大学 海洋学院,海南 海口 570228)
目前,由于地衣芽孢杆菌(Bacillus licheniformis)能产生多种具有重要生物活性的胞外产物,如肽类或非肽类的抗菌物、小分子活性物质及多种胞外消化酶[1],因此,它可促进养殖水体的营养循环,从而净化水质[2-4],有效避免了化学药物的滥用[5-7],同时还能增强动物的免疫反应,提高养殖生物的消化机能[8-14],所以地衣芽孢杆菌已被广泛应用于水产养殖中.然而,在净化水质的实际应用中,该菌的生长、产酶能力以及胞外产物的活性均会受到复杂的水质环境因子的影响[15].为了有效评估培养条件对菌株培养液中蛋白酶活性(包括产酶能力和酶活)的综合影响,笔者引入了“相对蛋白酶活性”,它是指菌株培养液中的蛋白酶活相对于最佳培养条件下的蛋白酶K 的酶活的大小,同时测定了盐度、温度和pH 值3 个主要水质环境因子对分离自海南海水养殖系统的地衣芽胞杆菌(Pb-WC09001、Pb-WC09002)相对蛋白酶活性的影响,以期在海南水产养殖系统中应用这2 个菌株提供指导.
1 材料与方法
1.1 材 料
1.1.1 菌种野生型热带地衣芽孢杆菌(Bacillus licheniformis)Pb-WC09001、Pb-WC09002,由本实验室从海南省文昌市的养殖水体中分离、筛选和保存,这2 个菌株表现出较高的蛋白酶活性.
1.1.2 培养基普通海水液体培养基:酵母浸膏1 g·L-1,牛肉膏3 g·L-1,蛋白胨5 g·L-1,NaCl 30 g·L-1,pH7.5.脱脂牛奶培养基:参考陈圣丰等[16]的方法制备.
1.2 方 法
1.2.1 标准曲线的建立将蛋白酶K(北京全式金生物技术有限公司,50 U·mg-1)稀释为80,40,20,10,5,对应的酶活分别为80×10-3,40×10-3,20×10-3,10×10-3mg·L-1,5×10-3U·mL-1(最适孵育温度为58 ℃).分别将20 μL 加入d=4 mm 的脱脂牛奶培养基平板的孵育孔内,用封口胶将平板封闭,保持湿度,置于30 ℃的培养箱内孵育24 h,测量其蛋白酶水解圈直径,然后建立蛋白酶水解圈直径(X 轴)与酶活(Y 轴)的标准曲线,用于本试验中菌体上清液的蛋白酶水解圈直径换算为最适条件下的蛋白酶K蛋白酶活性.
1.2.2 盐度对菌株相对蛋白酶活性的影响将2 株高蛋白酶活地衣芽孢杆菌分别接种于不同盐度(0,10,20,30,40,50)的50 mL 灭菌的普通海水液体培养基中,接种菌落浓度为2×103/mL(下同),30 ℃150 r·min-1振荡培养24 h,按照陈圣丰等[16]的方法制备上清液(下同).
按上法将2 株细菌在不同盐度下培养的上清液分别加入其对应盐度的脱脂奶平板孵育孔中,30 ℃孵育24 h,观察和记录结果,并将各孔的蛋白酶水解圈直径换算为最适条件下的蛋白酶K 活性.试验设置3个平行组.
1.2.3 温度对菌株相对蛋白酶活性的影响将菌株分别接种于6 瓶已灭菌的50 mL 普通海水液体培养基中,分别置于6 个温度为18,22,26,30,34,38 ℃的培养箱中,150 r·min-1培养24 h,并制备成上清液.
试验组1:在上述6 个温度梯度下取2 个株菌的上清液20 μL,分别加入脱脂牛奶孵育孔内,并置于6个不同温度的生化培养箱中(各样品均置于与培养时相同的温度)孵育24 h,然后观察和记录结果,并计算其相对酶活性.试验设置3 个平行组.
试验组2:加样方法与试验组1 相同,不同的是所有平板均置于30 ℃的生化培养箱中孵育24 h,然后观察和记录结果,并计算其相对酶活性.试验设置3 个平行组.
1.2.4 pH 对菌株相对蛋白酶活性的影响配制pH 为6.0,6.5,7.0,7.5,8.0,8.5,9.0 共7 份不同的普通海水液体培养基,每份50 mL,分别接种Pb-WC09001 和Pb-WC09002 后,30 ℃180 r·min-1振荡培养24 h,然后测定不同菌液的上清液的水解圈直径,并计算其相对酶活.
2 结果与分析
2.1 标准曲线的建立 不同质量浓度的蛋白酶K 的水解圈直径在(6.30±0.06)mm~(16.32±0.08)mm 之间(见表1),与厂家标明的酶活(最适条件下)存在明显的线性关系,即y=4.826 9x-4.757 6,R2=0.984 9(见图1).因此,蛋白酶的水解圈直径与其相对酶活(相对于最适条件下的蛋白酶K)存在良好的线性关系.

表1 不同质量浓度的蛋白酶K 水解圈直径及酶活
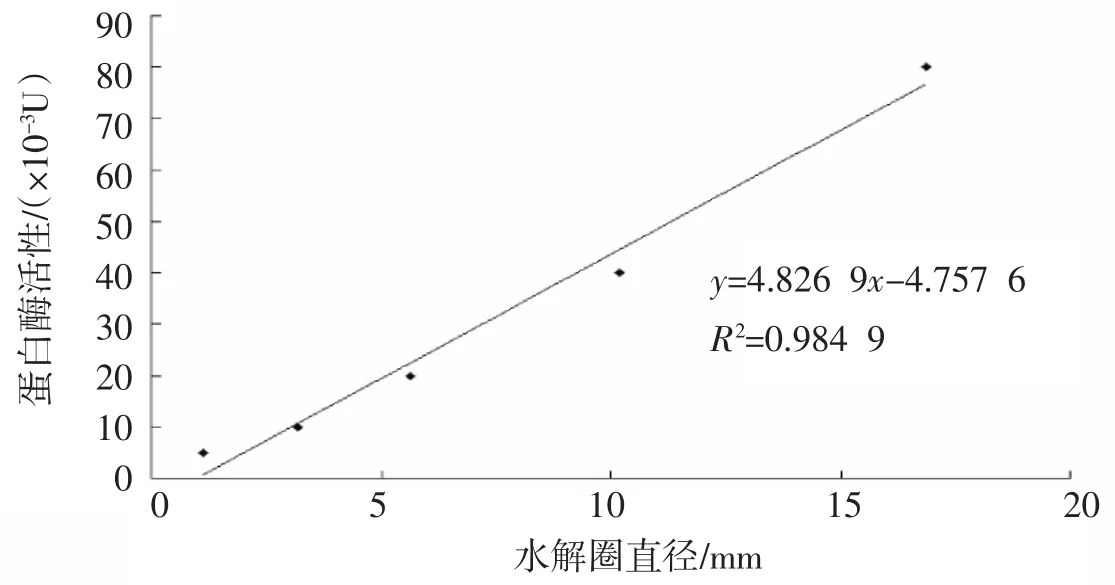
图1 蛋白酶K 水解圈直径与酶活性的线性关系
2.2 盐度对相对蛋白酶活性的影响 除Pb-WC09002 在盐度为30 时的相对酶活性略大于其在盐度为20 时的相对酶活性外,总体而言,2 株细菌的相对蛋白酶活性随盐度的增加而逐渐减弱(见表2):在盐度为0(即淡水)时,相对酶活性最高,分别为3.2 U·mL-1(Pb-WC09001)和3.19 U·mL-1(Pb-WC09002);在盐度为50 时,仅Pb-WC09001 存在一定的酶活性,相对酶活为1.56 U·mL-1,而Pb-WC09002 完全丧失酶活性.
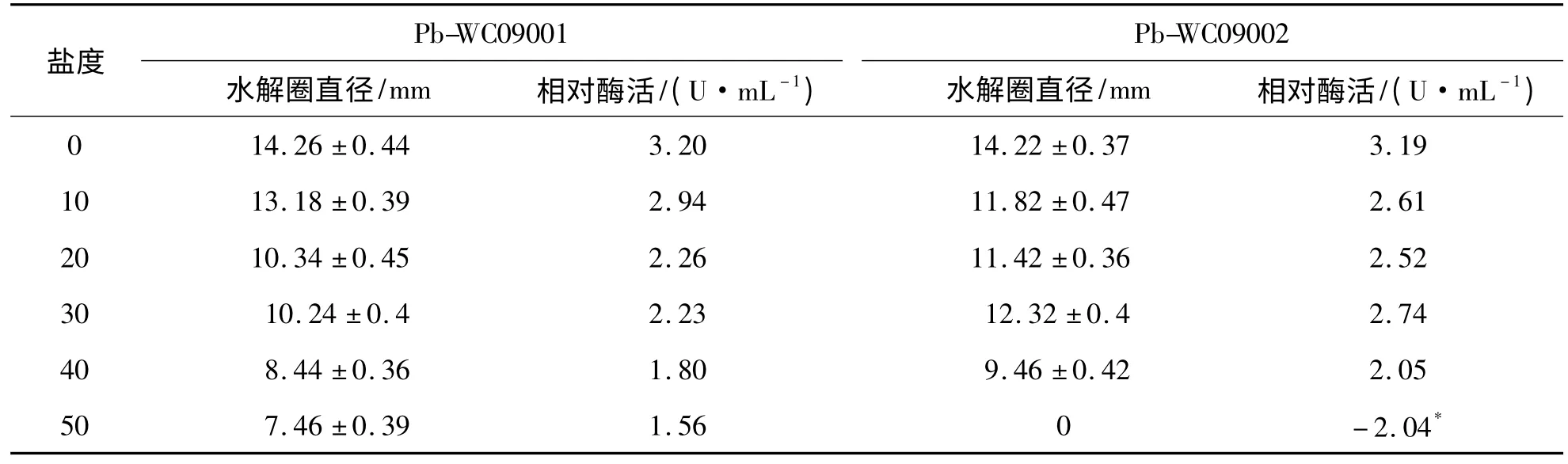
表2 盐度对菌株Pb-WC09001 和Pb-WC09002 相对蛋白酶活性的影响
2.3 温度对相对蛋白酶活性的影响 试验组1∶Pb-WC09001 的蛋白酶活性随温度的升高而逐渐升高,在34 ℃时酶活性最高,相对酶活为3.77 U·mL-1,38 ℃时的酶活性略低于34 ℃时,相对酶活为3.75 U·mL-1;Pb-WC09002 的蛋白酶活性在22 ℃时最低,相对酶活为2.22 U·mL-1,34 ℃时酶活性最高,相对酶活为3.76 U·mL-1(见表3).
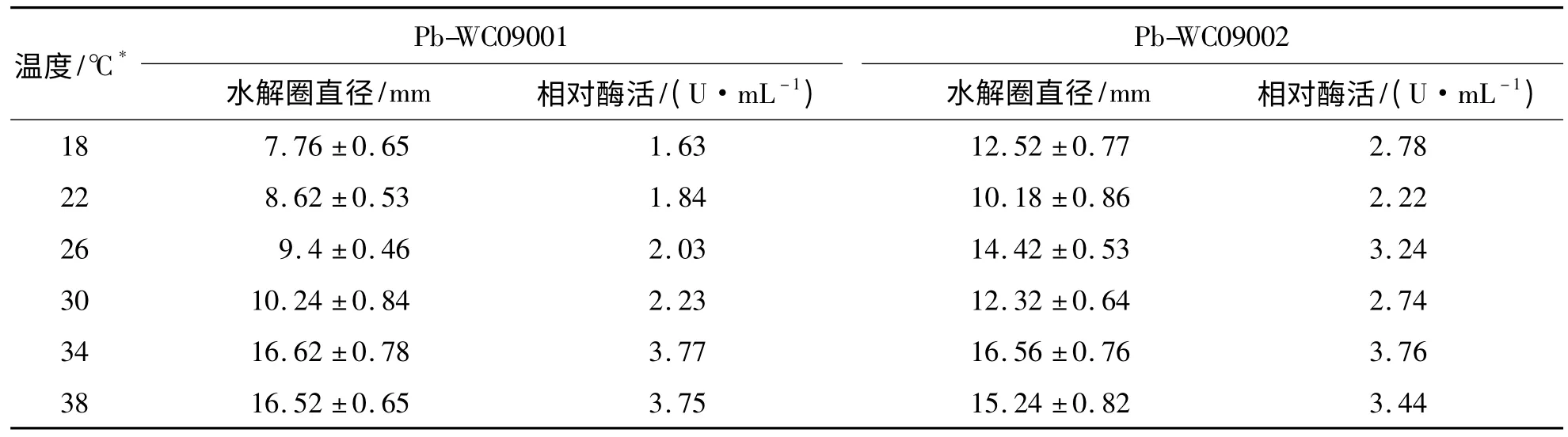
表3 温度对菌株Pb-WC09001 和Pb-WC09002 相对蛋白酶活性的影响(Ⅰ)
试验组2:在30 ℃孵育条件下,Pb-WC09001 在22 ℃培养时所获得的上清液的相对酶活性最高,为2.46 U·mL-1,26 ℃时最低,仅为1.33 U·mL-1;Pb-WC09002 在30 ℃培养时所获得的上清液的相对酶活性最高,为2.74 U·mL-1,在38 ℃时水解圈直径为0,即没有酶活(见表4).

表4 温度对菌株Pb-WC09001 和Pb-WC09002 相对蛋白酶活性的影响(Ⅱ)
2.4 pH 值对相对蛋白酶活性的影响 pH 值对2 株细菌的酶活性存在明显的影响,pH8.0 时,Pb-WC09001 的上清液的相对酶活性最高,为2.74 U·mL-1,pH6.0 时最低,仅为1.53U·mL-1;pH7.5 时,Pb-WC09002 的上清液的相对酶活性最高,为2.74 U·mL-1,pH9.0 时最低,为0(见表5).
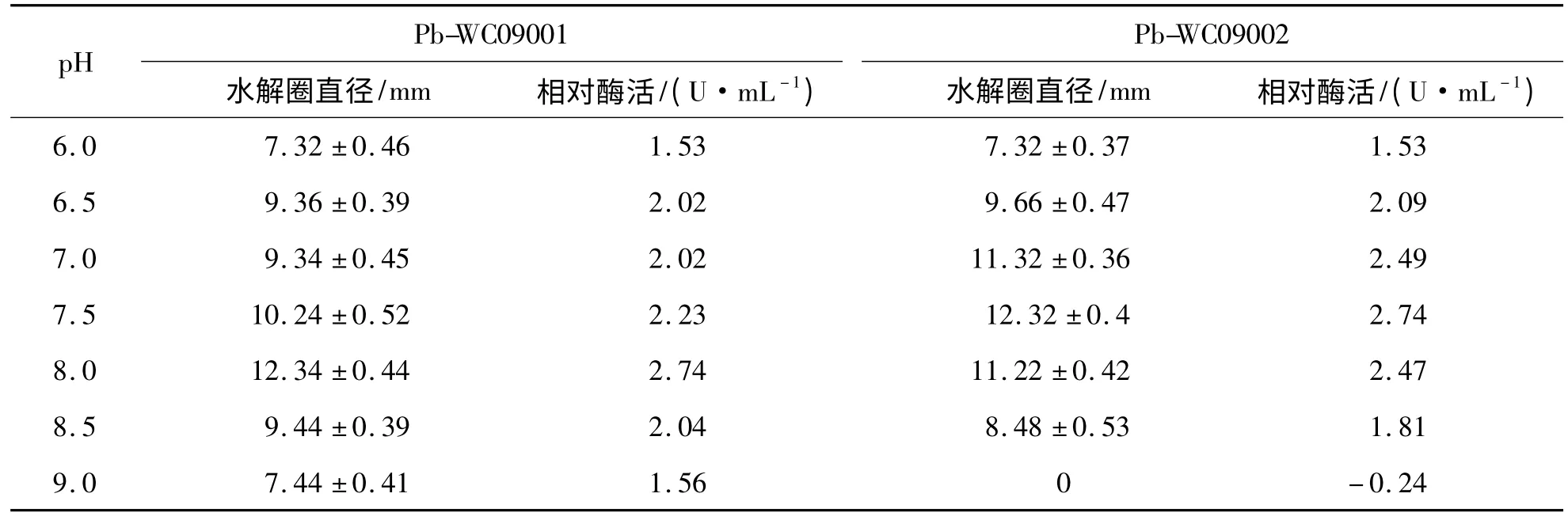
表5 pH 对菌株Pb-WC09001 和Pb-WC09002 相对蛋白酶活性的影响
3 讨论
地衣芽孢杆菌能分泌多种高活性的胞外消化酶,主要有蛋白酶、淀粉酶、脂肪酶等水解酶和一些分解植物性饵料中非淀粉多糖的酶类,如果胶酶、葡聚糖酶、纤维素酶等[1,17-18],可将水体中的蛋白质、多糖等高聚物变成有利于被其他生物吸收利用的小分子物质[19],常表现出较好的水质净化作用.SOGARRD等[13]也曾报道:地衣芽孢杆菌胞外酶可以降解果胶等某些复杂的植物性碳水化合物.然而在实际应用中,菌体在水体中的生长、产酶活性及其胞外酶活性都会受到盐度、温度和pH 值等多种水质因子的影响.在本试验中,虽然Pb-WC09002 在盐度为30 时的酶活高于盐度为20 时的酶活,但总体而言,低盐度下的蛋白酶活性高于高盐度下的酶活,表明盐度对该菌的胞外蛋白酶活具有抑制作用,与谢航等[20]的研究结果基本一致.这可能是由于盐度改变了细菌培养液的渗透压,从而影响细菌蛋白酶的表达或释放,也可能通过影响酶本身的活性而使菌株的表观酶活下降.温度也明显影响地衣芽孢杆菌的相对蛋白酶活性.试验组Ⅰ的结果表明,尽管Pb-WC09002 的蛋白酶活性存在一定的波动性,但是,在不同培养温度下,随着温度的升高,Pb-WC09001 和Pb-WC09002 的蛋白酶活的总体趋势表现为逐步增高,因此,培养温度对这2株细菌的酶活力起促进作用.试验组2 的结果表明,同一菌株在不同培养温度下获得的上清液酶活不同,不同菌株在38 ℃的上清液在30 ℃孵育温度下的酶活差异较大,Pb-WC09002 在38 ℃下获得的上清液在30 ℃孵育温度下基本不表现蛋白酶活,而Pb-WC09001 在38 ℃下获得的上清液在30 ℃孵育温度下表现较强蛋白酶活,这表明不同菌株在相同温度下可产生不同的蛋白酶.无论是在低盐度条件下,还是在低温条件下,Pb-WC09002 的相对酶活性总体上均高于Pb-WC09001.海南岛沿岸水温在秋季和冬季较低,平均水温分别为23.22 ℃和18.5 ℃[21],秋季(9~10 月份)受降雨量的影响,盐度普遍降低,有些海域,如英潮港,盐度最低时只有12[22],因此,Pb-WC09002 更适应于水温和盐度均较低的季节.到了春末和夏季,海水温度普遍升高,盐度也增高,东海岸的清澜港盐度高达34.47,西海岸的东方和莺歌海分别高达36.0和36.2[21],相对于Pb-WC09002,Pb-WC09001 更适应于这些季节.
pH 值也能明显影响地衣芽孢杆菌胞外蛋白酶的活力.不同菌株在相同pH 值条件下,蛋白酶活性存在显著差异.pH8.0 时,Pb-WC09001 的酶活性最高,而Pb-WC09002 的酶活却低于pH7.5 时,pH 9.0 时,Pb-WC09001 的相对酶活为1.56U·mL-1,而Pb-WC09002 的蛋白酶没有活性,表明Pb-WC09001 对海水环境(pH8.0~8.4)的适应性更高.曹煜成等[15]的研究表明,该菌的蛋白酶水解最适pH 为6.0~9.0,pH9.0 时酶活性最高,彭勇等[23]认为地衣芽孢杆菌胞外蛋白酶的最适pH 为8.0~12.0,在pH 为10.5 时酶活性最高,袁铸等[24]和黄红英等[25]则认为,其最适pH 为7.0~11.0,最大酶活力出现在pH 为9.0.这可能是因为该研究分别涉及了不同的地衣芽胞杆菌菌株,而不同菌株的最适pH 值存在差异的缘故,因此,在今后的相关研究中,应对不同的野生型地衣芽孢杆菌开展其最适环境因子的研究;同时,由于长期的进化,地衣芽孢杆菌很可能存在不同的地理种群,只有本地菌株才能更好地适应当地的水质环境因子.
[1]曹煜成,李卓佳,冯娟,等.地衣芽孢杆菌胞外产物消化活性的研究[J].热带海洋学报,2006,24(6):6-12.
[2]MORIARTY D J.The role of microorganisms in aquaculture ponds[J].Aquaculture,1997,151(1):333-349.
[3]SAHU M K,SWARNAKUMAR N S,SIVAKUMAR K,et al.Probiotics in aquaculture:importance and future perspectives[J].Indian Journal of Microbiology,2008,48(3):299-308.
[4]刘朝阳,孙晓庆.生物控制法在水产养殖水质净化中的综合应用[J].南方水产,2007,3(1):69-74.
[5]GATESOUPE F J.The use of probiotics in aquaculture[J].Aquaculture,1999,180(1):147-165.
[6]CABELLO F C.Heavy use of prophylactic antibiotics in aquaculture:a growing problem for human and animal health and for the environment[J].Environmental Microbiology,2006,8(7):1137-1144.
[7]SAPKOTA A,SAPKOTA A R,KUCHARSKI M,et al.Aquaculture practices and potential human health risks:current knowledge and future priorities[J].Environment International,2008,34(8):1215-1226.
[8]LIN H Z,GUO X Z,YANG Y Y,et al.Effect of dietary probiotics on apparent digestibility coefficients of nutrients of white shrimp Litopenaeus vannamei Boone[J].Aquaculture Research,2004,35(15):1441-1447.
[9]NIKOSKELAINEN S,SALMINEN S,BYLUND G,et al.Characterization of the properties of human-and dairy-derived probiotics for prevention of infectious diseases in fish[J].Applied and Environmental Microbiology,2001,67(6):2430-2435.
[10]刘波,谢骏,刘文斌,等.地衣芽孢杆菌与低聚木糖对异育银鲫消化酶活性、肠道菌群及生长的影响[J].大连水产学院学报,2007,21(4):336-340.
[11]沈文英,余东游,李卫芬,等.地衣芽孢杆菌对三角帆蚌消化酶活性、免疫指标和抗氧化指标的影响[J].动物营养学报,2009,21(1):95-100.
[12]丁贤,李卓佳,陈永青,等.芽孢杆菌对凡纳对虾生长和消化酶活性的影响[J].中国水产科学,2005,11(6):580-584.
[13]SÖGARRD H,SUHR-JESSEN T.Microbials for feed:beyond lactic acid bacteria[J].Feed International,1990,11(1):32-38.
[14]BOMBA A,NEMCOVA R,GANCARCIKOVA S,et al.Improvement of the probiotic effect of micro-organisms by their combination with maltodextrins,fructo-oligosaccharides and polyunsaturated fatty acids[J].British Journal of Nutrition,2002,88(S1):S95-S99.
[15]曹煜成,李卓佳,吴灶和,等.地衣芽孢杆菌胞外蛋白酶的纯化及特性分析[J].水生生物学报,2006,30(3):262-268.
[16]陈圣丰,林钦,周永灿,等.高蛋白酶活性的地衣芽孢杆菌热带菌种的筛选与鉴定[J].热带生物学报,2010,1(3):210-214.
[17]CALIK P,CELIK E,TELLIIE,et al.Protein-based complex medium design for recombinant serine alkaline protease production[J].Enzyme and Microbial Technology,2003,33(7):975-986.
[18]MAITIN V,KAVITHA R,UMESH-KUMAR S.Properties of an extracellular amylase purified from a Bacillus species[J].World Journal of Microbiology and Biotechnology,2001,17(8):823-826.
[19]王斐,郑天凌,洪华生.细菌胞外酶的生态作用[J].海洋科学,1999,23(3):33-36.
[20]谢航,邱宏端,王秀斌,等.地衣芽孢杆菌降解水产养殖中残余饵料的特性研究[J].福建水产,2008(3):31-35.
[21]中共海南省委党史研究室,海南省地方志办公室.海南省志·自然地理志·海洋水文[EB/OL].(2012-09-07)[2013-01-19].http://www.hnszw.org.cn/data/news/2012/09/54771/.
[22]中共海南省委党史研究室,海南省地方志办公室.海南省志·海洋志·水文气象[EB/OL].(2009-07-24)[2013-01-19].http://www.hnszw.org.cn/data/news/2009/07/44809/.
[23]彭勇,王忠彦.地衣芽孢杆菌碱性蛋白酶的研究——Ⅱ.碱性蛋白酶的提纯和性质研究[J].工业微生物,2000,30(4):37-40.
[24]袁铸,王忠彦,胡承,等.地衣芽孢杆菌JF-UN122 碱性蛋白酶的分离纯化与性质[J].工业微生物,2003,33(3):25-29.
[25]黄红英,方海红,刘爱民,等.一株地衣芽孢杆菌碱性蛋白酶的研究Ⅰ[J].微生物学通报,2001,28(5):20-24.
