新型α-葡萄糖苷酶抑制剂类降血糖药的合成及其活性研究Δ
2013-08-29王谦边晓丽樊向妮罗振吉赵桂兰西安交通大学医学院西安7006陕西科技大学生命科学与工程学院西安7002
王谦,边晓丽,樊向妮,罗振吉,赵桂兰(.西安交通大学医学院,西安7006;2.陕西科技大学生命科学与工程学院,西安 7002)
糖尿病的主要危害是高血糖诱发血管病变进而导致多种并发症发生[1-2],而血糖的波动较持续性高血糖更易导致血管损伤[3-5]。餐后高血糖是导致血糖波动的主要原因之一,对于饮食结构以碳水化合物为主的亚洲人群更为突出。α-葡萄糖苷酶抑制剂(α-Glucosidase inhibitor,α-GI)通过延缓碳水化合物的分解而降低餐后高血糖,对于控制餐后血糖波动及其糖尿病并发症具有其独特的优势。寻找新型α-GI成为抗糖尿病药物研究的热点之一[6]。本课题组在设计合成新型α-GI的研究中发现,具有取代基的酞酰亚胺类化合物(如图1中的化合物1)具有明显的α-葡萄糖苷酶抑制活性(另文报道)。为了增加水溶性,在4-硝基酞酰亚胺的氮上引入吡喃葡萄糖基,合成了氮苷化合物5-硝基-2-(β-D-吡喃葡萄糖基)-1H-异吲哚-1,3二酮(5-nitro-2-(β-D-glucopyranosyl)-1H-isoindole-1,3-dione,化合物2,即目标化合物),对其α-葡萄糖苷酶抑制活性及降低餐后血糖活性进行了研究,以为开发新型α-GI奠定了基础。
具有抑酶活性的酞酰亚胺类化合物的结构通式见图1。
1 材料
X-5数字显示显微熔点测定仪(郑州泽铭科技有限公司);Bruker AVANCEⅡ300型核磁共 振(NMR)仪 、API-QTRAP 3200液相色谱-质谱(MS)联用仪(日本岛津制作所);罗氏血糖仪(德国罗氏诊断公司)。
α-葡萄糖苷酶(来源于酵母,加拿大Bio Basic Inc公司,批号:201004AX,活力:42U/mg);4-硝基苯-α-D-吡喃葡萄糖苷(PNP-G,美国Sigma公司,批号:2009J03T4,纯度:>99.5%);阿卡波糖片(拜耳医药保健有限公司,批号:201001040002,规格:每片100mg);酞酰亚胺、无水葡萄糖均为分析纯;合成所用其他化学试剂均为市售分析纯或化学纯。
昆明小鼠,♂,动物合格证号:陕动证字08-004,由西安交通大学医学院实验动物中心提供。
罗氏血糖试纸(德国罗氏诊断公司,批号:201007050411);葡萄糖测试盒(南京建成生物工程研究所,批号:20100924)。

图1 具有抑酶活性的酞酰亚胺类化合物的结构通式Fig 1 Structure of phthalimide compound with enzyme inhibition activity
2 方法与结果
2.1 目标化合物的合成
2.1.1 4-硝基酞酰亚胺钾盐的合成。
以邻苯二甲酰亚胺(化合物3)为原料,按文献[7]方法制备4-硝基酞酰亚胺钾盐(化合物5),合成路线见图2。
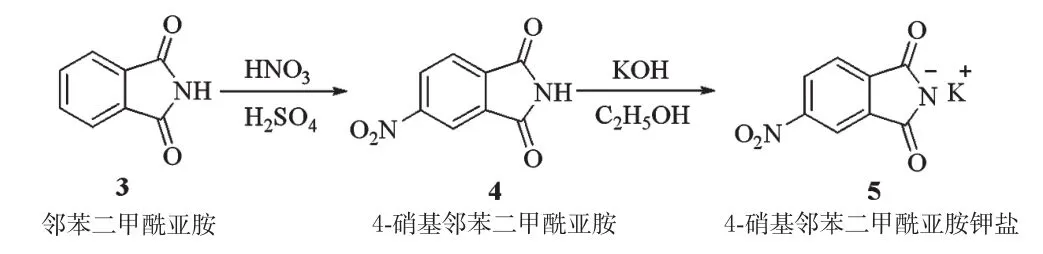
图2 4-硝基酞酰亚胺钾盐的合成路线Fig 2 Synthetic route of 4-nitro phthalimidopotassium
2.1.2 目标化合物的合成。
合成路线见图3。
2.1.3 目标化合物的合成方法。

图3 目标化合物的合成路线Fig 3 Synthetic route of target compound
(1)2,3,4,6-四-O-乙酰基-α-D-吡喃溴代葡萄糖(化合物7)的制备:于100ml三口瓶中加入乙酸酐30ml(273.2mmol),冷却至5℃,搅拌下加入高氯酸数滴。室温升高至30℃,分批加入葡萄糖(并保持温度不超过40℃),室温搅拌至澄清。将反应混合物降温至20℃以下,加入红磷4.5g(36.1mmol),滴加2ml溴水,其间控制滴加速度,使混合物温度不超过20℃,室温搅拌3h。向反应瓶中加入60ml氯仿,抽滤,滤液中加入50g碎冰,待冰全部溶化后转入分液漏斗中,分出有机层,并用氯仿萃取2次。合并氯仿层,依次用水、饱和碳酸氢钠、饱和氯化钠洗涤。氯仿层用无水硫酸钠干燥。55℃减压蒸除溶剂,得到微黄色油状物。将所得油状物溶于20ml乙醚中,加入石油醚(15ml),渐渐析出白色沉淀。静置过夜,抽滤得到白色固体14.05g,收率为81.5%,熔点(mp)为87~88℃(文献[8]值:88~89℃)。
(2)5-硝基-2-(2′,3′,4′,6′-O-四乙酰基-β-D-吡喃葡萄糖基)-1H-异吲哚-1,3(2H)二酮(化合物8)的制备:于100ml三口瓶中加入3g化合物5(13mmol)和20mlN,N-二甲基甲酰胺(DMF),搅拌0.5h后,滴加化合物7的DMF溶液。滴加完毕后,边搅拌边升温至80℃,反应55min后DMF基本澄清。降至室温,抽滤除去反应生成的KBr。减压蒸干DMF,得到黄色固体,经石油醚-乙酸乙酯(8∶1)重结晶,得黄色晶体3.3g,收率为82.4%,mp为155~156℃,1H-NMR[二甲基亚砜(DMSO)],δ:H2.02~2.11(m,12H,CH3),3.72~3.76(m,1H,GH-5),4.09~4.23(m,2H,GH-6),5.01~5.23(m,4H,GH1-4,J1,2=8.5),8.39(d,1H,ArH),8.62(d,1H,ArH),9.07(s,1H,ArH)。
(3)目标化合物的合成:取3g化合物8(6mmol)于40ml无水甲醇中,搅拌下滴加0.5mol/L甲醇钠(2.4ml),10min后溶液开始变混浊,有沉淀析出,置于冰箱过夜,收集析出物,干燥得粗品2.2g,用无水乙醇重结晶,得白色粉末2.0g,收率为68.5%,mp为188~190℃,m/z:354.03,1H-NMR(DMSO),δ:2.2(s,4H,4×OH),3.732~3.78(m,1H,GH-5),4.09~4.23(m,2H,GH-6),5.03~5.24(m,4H,GH1-4,J1,2=8.4),8.40(d,1H,ArH),8.63(d,1H,ArH),9.07(s,1H,ArH)。
葡萄糖经乙酰化及溴化,得到2,3,4,6-四-O-乙酰基-α-D-吡喃溴代葡萄糖(化合物7),经烃化反应将其引入到4-硝基酞酰亚胺的氮上得到对应的葡萄糖氮苷(化合物8),去乙酰基后得到目标化合物2,其结构经NMR及1H-NMR等得以确证。
2.2 对酵母α-葡萄糖苷酶和鼠肠α-葡萄糖苷酶的抑制活性研究
2.2.1 对酵母α-葡萄糖苷酶的抑制活性。
反应体系:α-葡萄糖苷酶溶液10U/ml(10μl),PNP-G溶液20μmol/ml(10μl),加入化合物2溶液(浓度为1mmol/ml),体积分别为10、20、30、40、50μl。化合物2溶液以DMSO-磷酸盐缓冲溶液(1∶9)混合溶液为溶剂,最后加入终止剂碳酸钠,总体积为100μl。阿卡波糖为阳性对照,质量浓度为20mg/ml(参照文献[9]),加入体积分别为10、20、30、40、50μl;同时以α-葡萄糖苷酶溶液、PNP-G溶液、缓冲溶液以及终止剂的混合液为空白对照。
具体操作过程:取酶液10μl于37℃温孵30min,分别加入浓度为1mmol/ml的化合物2溶液10、20、30、40、50μl,混匀后于37℃保温10min,再加入PNP-G 5μl,37℃保温10min后,加入终止剂混匀。吸取20~40μl反应试液,稀释至3ml后,在400nm波长处测定溶液吸光度,计算抑制率(IR,%),以产生50%抑制活性时对应的化合物浓度值(半数抑制浓度,IC50)表示抑制剂的活性,并用Xlfit软件中的4Parameter Logistic Model计算IC50值。IR=(A0-A1)/A0×100%,A0为未加抑制剂的吸光度,A1为加入酶抑制剂后的吸光度。
2.2.2 对鼠肠α-葡萄糖苷酶的抑制活性。
(1)小鼠小肠黏膜酶液的制备。小鼠禁食不禁水12h后处死,快速切取完整的结肠,去除系膜组织和十二指肠,用冷生理盐水冲洗肠腔,除去内容物。将漂洗后的肠段用冷生理盐水漂洗干净后,用玻片小心刮取黏膜组织,于冰浴中制备匀浆。然后以10000r/min离心10min,取上清液、分装、快速冰冻,-20℃冰箱保存。(2)抑酶活性测定。取0.1ml小鼠小肠酶液37℃下孵育15min,加入浓度为1mmol/ml的化合物2溶液10、30、50、70、90μl后,继续保温30min,分为3组:分别加入50μl 0.05mol/L的麦芽糖、乳糖和淀粉,在37℃水浴中准确反应60min后,即入沸水浴终止反应;同时做空白对照,即另取0.1ml小鼠肠酶液,在沸水中加热灭活后,加入50μl 0.05mol/L的麦芽糖、乳糖和淀粉,其余步骤同上。取反应液10μl于EP管中,再加入葡萄糖测试盒中A试液500μl、B试液500μl后混匀,37℃下保温10min。取此反应试液50μl,稀释至3ml,于505nm波长下测定其吸光度。按照试剂盒方法计算葡萄糖的生成量。以阿卡波糖为阳性对照,加入的质量浓度为20mg/ml,体积为10、30、50、70、90μl;同时设定空白对照。按下式计算IR,并根据IR计算IC50值:IR=(样品组葡萄糖含量/空白对照组葡萄糖含量)×100%。
抑酶活性测定结果显示,化合物2对酵母α-葡萄糖苷酶表现出明显的抑制活性,其IC50远小于阿卡波糖;对鼠肠α-葡萄糖苷酶的麦芽糖酶的抑制作用明显,对乳糖酶的抑制作用次之,而对淀粉酶的抑制活性较弱。表明化合物2抑制α-葡萄糖苷酶、麦芽糖酶和乳糖酶的活性较阿卡波糖强,具体详见表1。

表1 目标化合物对α-葡萄糖苷酶的抑制活性结果(n=3)Tab 1 Enzyme inhibition activity of target compound on α-glucosidase(n=3)
2.3 对小鼠餐后血糖的影响[10]
取正常小鼠,禁食不禁水12h,筛选出空腹血糖水平为4.0mmol/L左右的小鼠,随机分为3组,每组10只。空白组:淀粉(2g/kg);受试药物(化合物2)组:淀粉(2g/kg)+化合物2(25mg/kg);阿卡波糖组:淀粉(2g/kg)+阿卡波糖(25mg/kg)。分别在灌胃后0.5、1.0、2.0h尾静脉取血测定血糖,初步观察化合物2对小鼠餐后血糖的影响。经统计学处理结果显示,受试药物(化合物2)组与空白组和阿卡波糖组比较均有显著性差异,表明化合物2能降低餐后血糖水平,但其降低血糖活性不及阳性对照药阿卡波糖,详见表2及图4。
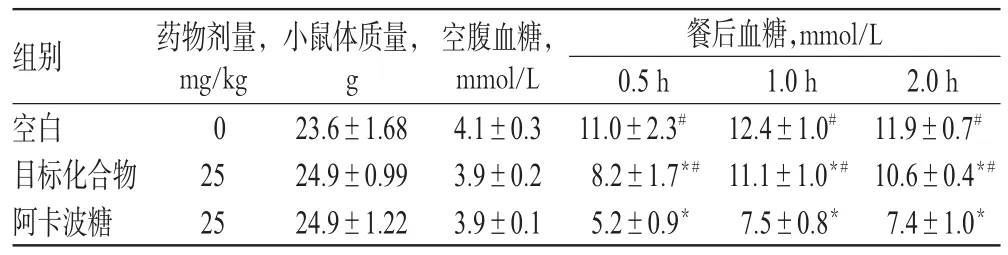
表2 各组小鼠餐后血糖水平比较Tab 2 Comparison of postprandial blood glucose of mice in each group

图4 各组小鼠餐后血糖水平比较曲线Fig 4 Comparison of postprandial blood glucose curves of mice in each group
3 讨论
葡萄糖在1位成苷键时,可能有α型和β型2种构型:在β构型中,H1和H2都处于a键,二者之间的偶合常数通常在8~13之间;而α构型时H1和H2分别处于e键和a键,二者之间的偶合常数较小,通常在2~6之间。根据文献[9]方法制备2,3,4,6-四-O-乙酰基-α-D-吡喃溴代葡萄糖,当4-硝基酞酰亚胺钾盐与其反应时,从β位进攻得到β型构型产物,产物的偶合常数也证明其构型为β型。
越来越多的临床及实验研究[11]表明,餐后高血糖导致的血糖波动已成为多种糖尿病并发症尤其是心血管疾病发病的独立危险因素。α-GI通过阻断碳水化合物在肠道的分解,延缓葡萄糖的生成和吸收,减缓餐后血糖波动,对于控制糖尿病并发症的独特优势越来越突出。本文在前期对酞酰亚胺类衍生物研究的基础上,合成了化合物2,体外抑酶活性测定结果表明,该化合物对α-葡萄糖苷酶具有较强的抑制作用,尤其是对酵母α-葡萄糖苷酶表现出较低的IC50值。对鼠肠α-葡萄糖苷酶,该化合物主要是抑制双糖酶(麦芽糖酶、乳糖酶),对淀粉酶活性较差。通过计算机辅助药物设计软件进行Docking分析显示,该分子与α-葡萄糖苷酶蛋白活性催化区域的氨基酸残基间可形成多个氢键,从分子水平阐明化合物2对α-葡萄糖苷酶的抑制作用提供了依据,详见图5。
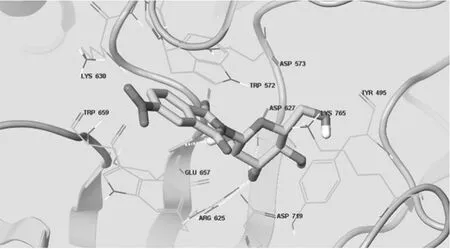
图5 α-葡萄糖苷酶活性位点与化合物2的氢键结合示意图Fig 5 Hydrogen bond binding mode of compound 2and the active site of α-glucosidase
由于饮食中的碳水化合物(多糖)被水解后主要以麦芽糖和异麦芽糖为主,因此对麦芽糖酶抑制活性更强的化合物,更有利于控制餐后葡萄糖的生成[12]。体外抑酶活性预示化合物2可能具有降低餐后血糖的活性。但通过初步研究该化合物对正常小鼠餐后血糖的作用,发现该化合物的体内降血糖活性不及阿卡波糖,可见其体外较强的α-葡萄糖苷酶抑制活性在正常小鼠体内并未显现。其原因可能是多方面的,例如,动物模型的选择、给药方式等。本研究只初步观察了对正常小鼠进食(淀粉)时血糖的影响,而对糖尿病时鼠小肠α-葡萄糖苷酶高表达情况下的作用有待进一步探索[12]。阿卡波糖对α-葡萄糖苷酶抑制活性较好,而目标化合物主要抑制双糖酶,对淀粉酶活性较差,在显效时序上也有差别。化合物体内显效受众多因素的影响,如在消化道的稳定性、对靶酶的亲和性等,也不排除体外活性假阳性的可能。由于体外α-葡萄糖苷酶为游离状态,而α-葡萄糖苷酶在跨越小肠上皮细胞双分子层时被多肽链锚定在膜上,N端向内,C端向外,这样如果体外试验中α-GI作用于游离α-葡萄糖苷酶的N端,则检测到的体外抑制活性不能在体内重现。笔者就可能的影响因素将做进一步的实验探讨,为该化合物的进一步开发应用及设计活性更强、性能更优良的α-GI提供实验依据。
综上所述,本文合成了一种新的葡萄糖氮苷化合物5-硝基-2-(β-D-吡喃葡萄糖基)-1H-异吲哚-1,3二酮,其对α-葡萄糖苷酶尤其是双糖酶具有强体外抑制活性,但体内降低正常小鼠餐后血糖活性不及阿卡波糖。
[1] 韦昭.糖尿病并发症的防治进展[J].中华实用心脑肺血管病杂志,2008,16(8):61.
[2] Matteo A.Cardiovascular prevention in type 2diabetes mellitus patients:the role of oral glucose-lowering agents[J].Diabetes and Its Complications,2009,23(2):427.
[3] Zaccardi F,Pitocco D,Ghirlanda G.Glycemic risk factors of diabetic vascular complications:the role of glycemic variability[J].Diabetes Metab Res,2009,25(2):199.
[4] Ceriello A,Esposito K,Piconi L,et al.Oscillating glucose is more deleterious to endothelial function and oxidative stress than mean glucose in normal and type 2diabetic patients[J].Diabetes,2008,57(11):1349.
[5] Nalysnyk L,Hernandez-medina M,Krishnarajah G.Glycaemic variability and complications in patients with diabetes mellitus:evidence from a systematic review of the literature[J].Diabetes Obes Metab,2010,12(6):288.
[6] 翟清波,李诚,王静,等.植物多酚降血糖和降血脂作用研究进展[J].中国药房,2012,23(3):279.
[7] Leopold FL,Henry S.The preparation of 4-nitrophthalimide and derivatives[J].J Chem Soc,1931:79.
[8] 邓小娟,万谦宏.2,3,4,6-四-O-乙酰基-β-D-吡喃葡萄糖基异硫氰酸酯的合成与应用[J].精细化工,2005,22(4):307.
[9] 庞宗然,裴凌鹏.药桑不同提取物对2型糖尿病大鼠的治疗作用[J].中国老年学杂志,2009,29(11):2733.
[10] 张琪,陈宁,陈国广,等.小麦α-淀粉酶抑制剂降血糖作用的实验研究[J].中国新药杂志,2006,6(15):432.
[11] 孙向东,付丽琳.餐后高血糖的危害及其干预策略[J].实用糖尿病杂志,2008,4(5):4.
[12] 王竹,杨月欣.植物化学物α-葡萄糖苷酶抑制剂样降血糖作用及其评价方法[J].国外医学卫生学分册,2008,35(6):355.
