厄贝沙坦胃滞留渗透泵片的制备及其在犬体内的药动学研究
2013-08-10潘振华曹德英河北医科大学药学院石家庄050017
方 瑜,潘振华,曹德英(河北医科大学药学院,石家庄 050017)
厄贝沙坦是目前唯一具有全程干预糖尿病肾病进程证据的血管紧张素受体拮抗药(ARB)[1]。对于给予厄贝沙坦干预早期糖尿病肾病的患者,长期坚持治疗是成功的关键。对于血压正常的早期糖尿病肾病患者,患者口服厄贝沙坦普通片剂后,其在胃内崩解,药物较快地溶出并被吸收,体内血药浓度迅速达到峰值。由于厄贝沙坦的生理活性,部分患者可能出现一过性体位性低血压。该不良反应的发生,将严重降低患者的依从性,从而导致干预失败。开发厄贝沙坦胃滞留渗透泵片,控制患者口服厄贝沙坦后的血药浓度保持在平稳的水平,避免血药峰谷波动现象[2],减少不良反应,从而提高患者依从性,可使厄贝沙坦干预早期糖尿病肾病患者获得成功。笔者制备了厄贝沙坦胃滞留渗透泵片,并采用高效液相色谱(HPLC)-荧光检测法测定了Beagle犬血浆中厄贝沙坦浓度,考察了厄贝沙坦胃滞留渗透泵片在Beagle犬体内的药动学并评价了缓释作用。
1 材料
1.1 仪器
Agilent 1100液相系统,包括G1311A型四元输液泵、G1321A荧光检测器、G1313A型自动进样器、G1316A型柱温箱和G1379A型脱气机(美国Agilent公司);BY300A型小型包衣机(上海黄海药检仪器厂)。
1.2 药品与试剂
厄贝沙坦对照品(批号:100607-200301,纯度:99.8%)、缬沙坦对照品(批号:100651-200902,纯度:99.9%)均由中国食品药品检定研究院提供;厄贝沙坦原料药(修正药业集团柳河制药有限公司,批号:20101101,纯度:99.6%);厄贝沙坦胃滞留渗透泵片(河北医科大学药学院自制,批号:20110601,规格:每片150 mg);厄贝沙坦片(杭州赛诺菲安万特民生制药有限公司,批号:1004043,规格:每片150 mg);甲醇、乙腈为色谱纯,磷酸、三乙胺、二氯甲烷均为分析纯,其他辅料均为药用级。
1.3 动物
健康Beagle犬6只,体质量(7.5±1.0)kg,♀♂各半,上海新冈实验动物场提供,合格证号:SCXK(沪)2002-0014。
2 方法与结果
2.1 厄贝沙坦胃滞留渗透泵片的制备
2.1.1 轻质多孔微球的制备:将聚丙烯酸树脂RS溶于适量乙醇-二氯甲烷中,加入0.3%十二烷基硫酸钠水溶液,50~100 r/min搅拌,至油珠粒径为0.3~0.8 mm时,开始缓慢升温,至40℃时固化4 h,过滤,装柱,10倍柱体积热水淋洗后,干燥即得。
2.1.2 片芯的制备:将轻质多孔微球、聚氧乙烯(PEO)、羟丙甲纤维素(HPMC)、氯化钠、聚维酮按处方量混合均匀,加入无水乙醇制软材,过20目筛制粒,40℃干燥12 h,加入硬脂酸镁混匀,压制膨胀漂浮层片芯;将厄贝沙坦、PEO按处方量混合均匀,加入无水乙醇制软材,过20目筛制粒,40℃干燥12 h,加入硬脂酸镁混匀,在上述片芯两侧加压含药层,制成片芯。
2.1.3 包衣与打孔:用醋酸纤维素丙酮溶液包衣,在片剂的双侧表面各打一直径0.8 mm的小孔,即得。
2.2 血浆中厄贝沙坦测定方法[3-4]
2.2.1 色谱条件:色谱柱为Inersil CN(250 mm×4.6 mm,5 μm);流动相为pH 3.0磷酸盐缓冲液-甲醇-乙腈(67∶20∶13,V/V/V),流速为1.0 ml/min;荧光激发波长为250 nm,发射波长为371 nm;进样量为20 μl。
2.2.2 血浆样品的预处理:精密量取血浆0.3 ml,加内标缬沙坦溶液(50 μg/ml)10 μl、2 mol/L磷酸50 μl,混匀,加二氯甲烷5 ml,涡流混合10 min,10 000 r/min离心5 min,分取下层有机相于另一试管中,氮气流吹干,残留物加0.1 ml流动相溶解,涡流混合,取20 μl进样。
2.3 方法学考察
2.3.1 方法的专属性:取犬空白血浆、空白血浆+厄贝沙坦+内标、血浆样品(给药后4 h)+内标,依法处理后,在“2.2.1”项色谱条件下,进样测定。结果表明,厄贝沙坦和内标的保留时间分别为12.49、14.19 min,峰形良好,无杂质干扰。色谱图见图1。
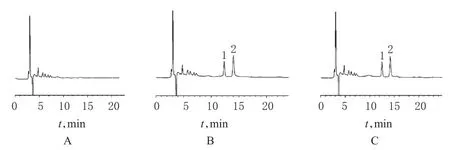
图1 高效液相色谱图A.空白血浆;B.空白血浆+厄贝沙坦+内标;C.血浆样品+内标;1.厄贝沙坦;2.内标Fig1 HPLC chromatogramsA.blank plasma;B.blank plasma+irbesartan+internal standard;C.plasma sample+internal standard;1.irbesartan;2.internal standard
2.3.2 标准曲线的制备:取空白血浆0.3 ml,加厄贝沙坦对照品溶液适量制备成质量浓度分别为0.5、1.0、2.5、5、10、25、50 μg/ml的血浆样品,照“2.2.2”项下方法处理,进样20 μl,记录色谱图。以样品及内标的峰面积比值(A)为纵坐标,厄贝沙坦质量浓度(c)为横坐标,进行线性回归。得回归方程为c=987.51A-27.36(r=0.999 1),结果表明,厄贝沙坦检测质量浓度的线性范围为0.5~50 μg/ml。
2.3.3 方法精密度及准确度试验:取空白血浆0.3 ml,制备成低、中、高(1.0、5.0、30 μg/ml)3个质量浓度的血浆样品,每日测3次,连续测定3 d的血浆样品浓度,根据结果计算本法的方法回收率与精密度。结果,方法回收率分别为96.3%、95.9%、102.4%,日内RSD分别为4.97%、3.49%、3.06%,日间RSD分别为5.75%、8.82%、10.04%。
2.3.4 提取回收率试验:取空白血浆0.3 ml,制备成低、中、高(1.0、5.0、30 μg/ml)3 个质量浓度的血浆样品,依法处理。同时另取空白血浆0.3 ml,不加内标溶液,按“2.2.2”项下方法处理,向获得的澄清液中加入相应浓度的标准溶液和内标溶液各10 μl,氮气流下吹干。残留物均以流动相0.1 ml溶解,进样分析,获得相应峰面积,以每一浓度2种处理方法峰面积比值计算提取回收率。结果,厄贝沙坦的提取回收率分别为89.4%、95.4%、92.1%,内标的提取回收率为94.7%。
2.3.5 样品稳定性试验:取空白血浆0.3 ml,制备低、高(1.0、30 μg/ml)2个质量浓度的血浆样品,分别进行2次循环冻融稳定性、-20℃条件下冻存45 d稳定性和室温放置2 h稳定性考察。结果,样品2次循环冻融、-20℃条件下冻存45 d、室温放置2 h均稳定。
2.4 药动学实验
将犬6只随机均分成2组,采用双周期自身交叉试验,一组服用受试制剂厄贝沙坦胃滞留渗透泵片,另一组服用参比制剂厄贝沙坦片,剂量均为150 mg。2周后进行交叉试验。于口服给药前(0 h)和给药后0.25、0.5、0.75、1、1.5、2、3、4、6、8、12、24、36、48、72 h取前肢静脉血3 ml,并立即移入肝素化离心管中,10 000 r/min离心10 min,分离血浆,于-20℃冰箱中保存,检测每个时间点厄贝沙坦的血药浓度。用DAS统计软件,采用梯形法计算AUC0-72h值,以半对数作图法由消除相浓度点计算t1/2、tmax、cmax。2种制剂在犬体内的药-时曲线见图2,药动学参数见表1。
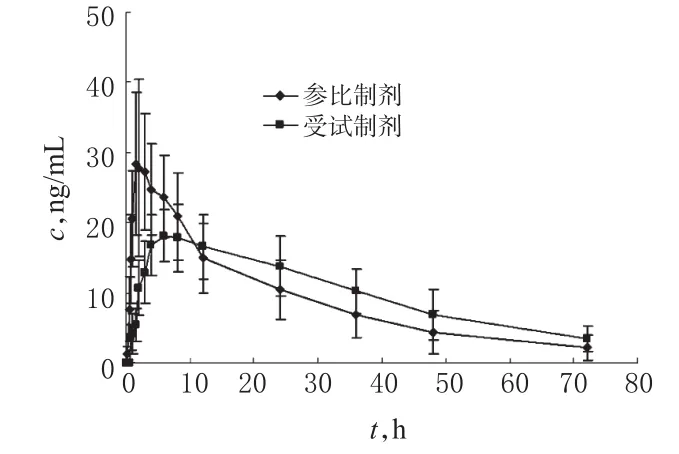
图2 2种制剂在犬体内的药-时曲线Fig2 Plasma concentration-time curves of 2 kinds of preparations in Beagle dogs
表1 2种制剂在犬体内的药动学参数(±s,n=6)Tab1 Pharmacokinetic parameters of 2 kinds of preparations in Beagle dog(±s,n=6)

表1 2种制剂在犬体内的药动学参数(±s,n=6)Tab1 Pharmacokinetic parameters of 2 kinds of preparations in Beagle dog(±s,n=6)
与参比制剂比较:*P<0.05vs.reference preparation:*P<0.05
受试制剂5.43±3.79*1.87×104±0.45×104*17.5±4.7 6.07×105±8.61×104 6.26×105±8.94×104参数tmax,h cmax,μg/L t1/2,h AUC0-72 h,μg·h/L AUC0-∞,μg·h/L参比制剂1.21±0.76 2.93×104±0.71×104 14.2±4.9 6.57×105±1.19×105 6.84×105±1.28×105
结果,以厄贝沙坦AUC0-72h计算,厄贝沙坦胃滞留渗透泵片中厄贝沙坦的相对生物利用度为(92.1±18.5)%。方差分析结果显示,受试制剂与参比制剂生物利用度无显著性差异(P>0.05),受试制剂AUC0-72h的90%置信区间为参比制剂相应参数的92.1%~119.4%。经分析,受试制剂与参比制剂间的tmax、cmax均有显著性差异(P<0.05):受试制剂cmax的 90%置信区间为参比制剂的57.0%~81.3%,显著降低。上述结果表明,受试制剂较参比制剂tmax明显延长,cmax显著降低,生物利用度无显著性差异,具有明显的缓释作用。
3 讨论
现有的难溶性药物渗透泵制剂设计方法主要为普通双室渗透泵片,主要问题在于药物以固体微粒状态进入肠道,而其进一步的溶解与吸收是否能完全进行,不能有效验证[5]。厄贝沙坦在水中不能溶解,如果开发普通双室渗透泵控释制剂,其口服后在肠道中可排出药物固体微粒,药物的溶解存在困难,因此难以达到预期的生物利用度。由于厄贝沙坦在胃液的偏酸性环境下具有一定溶解度,制备具有胃滞留功能的渗透泵片,在整个释药周期内均能够滞留于胃液中,因此药物释放后能够快速溶解从而吸收,保证获得理想的生物利用度。
[1]Andersen S,Bröchner-Mortensen J,Parving HH,et al.Kidney function during and after withdraw of long-term irbesatan treatment in patients with type 2 diabetes and microalbuminunor[J].Diabetes Care,2003,26(12):3 296.
[2]Thombre AG,Appel LE,Chidlaw MB,et al.Osmotic drug delivery using swellable-core technology[J].J Control Release,2004,94(1):75.
[3]王婉钢,刘启.HPLC-荧光检测法测定人血浆中厄贝沙坦的浓度[J].中国药房,2007,18(32):2 512.
[4]González L,López JA,Alonso RM,et al.Fast sc-reeningmethod for the determination of angiotensinⅡreceptor antagonists in human plasma by high-performance liquid chromatography with fluorimetric detection[J].J Chromatogr A,2002,949(1):49.
[5]Lu EX,Jiang ZQ,Zhang QZ,et al.A water-insoluble drug monolithic osmotic tablet system utilizing gum arabic as an osmotic,suspending and expanding agent[J].J Control Release,2003,92(3):375.
