复方硫磺洗剂微生物限度检查方法的建立
2013-08-29王海华南宁食品药品检验所南宁530001
王海华(南宁食品药品检验所,南宁 530001)
复方硫磺洗剂处方由升华硫、硫酸锌、樟脑醑、甘油、甲基纤维素等组成,制剂中硫磺与皮肤分泌物作用生成硫化物,能使表皮软化,并有脱脂、杀菌、止痒以及抑制角质形成作用;硫酸锌具有轻度杀菌以及收敛作用;樟脑具有局部止痛、止痒的效果。该洗剂可用于治疗疥疮、体癣、手足癣、脚气等,为外用药。
在对具有抗菌活性的药品进行微生物限度检查时,应首先消除其抗菌活性,并通过试验验证是否彻底去除抗菌活性,以保证检验结果的有效性。薄膜过滤法是消除药品中抗菌活性的最有效方法,但由于复方硫磺洗剂处方中升华硫不溶于水,使得无法简单地采用水溶液作为冲洗剂去除抗菌活性。笔者在试验中发现,在薄膜过滤法中以聚山梨酯80作为增溶剂,可有效去除复方硫磺洗剂的抑菌作用。据此,笔者建立了通过薄膜过滤结合在冲洗液中加入聚山梨酯80的方法,对复方硫磺洗剂进行了微生物限度检查;并按2010年版《中国药典》(二部)规定的方法[1]对复方硫磺洗剂微生物限度检查方法进行了验证,以确定该制剂所用微生物限度检查方法的有效可行。
1 材料
1.1 仪器
LRH-250-G型光照培养箱、LRH-250-A型生化培养箱(广东省医疗器械厂);HR-8753GM微波炉(青岛海尔微波制品有限公司);Ⅱ级生物安全柜(上海振梓创空气净化设备有限公司)。
1.2 药品
复方硫磺洗剂(广西中医学院瑞康医院制剂室,批号:090218、090303、090316,规格:每瓶 200ml,含硫磺 0.03g/ml)。
1.3 菌种
枯草芽孢杆菌(Bacillus subtilis)[CMCC(B)63501]、金黄色葡萄球菌(Staphlococcus aureus)[CMCC(B)26003]、大肠埃希菌(Escherichia coli)[CMCC(B)44102]、铜绿假单胞菌(Pseudomonas aeruginosa)[CMCC(B)10104]、白色念珠菌(Candida albicans)[CMCC(F)98001]、黑曲霉(Aspergillus niger)[CMCC(F)98003]均来自中国医学细菌保藏管理中心。
1.4 培养基及稀释剂、增溶剂
营养琼脂培养基(批号:090226)、玫瑰红钠琼脂培养基(批号:090318)、胆盐乳糖培养基(BL,批号:090529)、蛋白胨(批号:090617)均来源于广西食品药品检验所;营养肉汤培养基(批号:090518)、溴化十六烷基三甲铵琼脂培养基(批号:090601)均来源于北京三药科技开发公司;改良马丁培养基(批号:090302)、甘露醇氯化钠琼脂培养基(批号:090311)均来源于北京陆桥技术有限责任公司;适用性检查符合2010年版《中国药典》的相关规定。pH7.0无菌氯化钠-蛋白胨缓冲液、0.1%蛋白胨水溶液、含0.1%聚山梨酯80的0.1%蛋白胨水溶液、0.9%无菌氯化钠溶液等为自制。
2 方法与结果
参照2010年版《中国药典》(二部)微生物限度检查法[1]进行试验,简述如下:
2.1 菌液的制备
接种金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌和铜绿假单胞菌的新鲜培养物至营养肉汤培养基中,30~35℃培养18~24h;接种白色念珠菌的新鲜培养物至改良马丁培养基中,23~28℃培养24~48h。上述培养物用0.9%无菌氯化钠溶液制成每1ml含菌数为50~100CFU的菌悬液。接种黑曲霉的新鲜培养物至改良马丁琼脂培养基中,23~28℃培养5~7d,加入3~5ml 0.9%无菌氯化钠溶液,将孢子洗脱。吸出孢子悬液至无菌试管内,用0.9%无菌氯化钠溶液制成每1ml含孢子数为50~100CFU的孢子悬液。
2.2 供试液制备
取供试品10ml,加pH 7.0无菌氯化钠-蛋白胨缓冲液稀释至100ml,制备成均匀的1∶10的供试液,静置5min,取上清液备用。
2.3 微生物限度检查方法
2.3.1 平皿法:取1∶10的供试液1ml注入平皿。
2.3.2 培养基稀释法:取1∶10的供试液1ml,注入5个平皿,每个平皿0.2ml。
2.3.3 薄膜过滤法:取1∶10的供试液10ml,采用薄膜过滤法,分别以0.1%蛋白胨水溶液(A)及含0.1%聚山梨酯80的0.1%蛋白胨水溶液(B)为冲洗液。冲洗量:A 100、200、300、400、500、600、700、800ml,B 100、200ml。
2.4 细菌、霉菌和酵母菌检查方法学验证试验
2.4.1 试验组:按“2.3”项下方法操作后,分别将50~100CFU/ml的试验菌1ml,注入同一平皿中(n=3),立即倾注琼脂培养基,待凝固后置于规定温度,细菌培养24~48h,白色念珠菌和黑曲霉培养48~72h,测定其菌数;薄膜过滤法时,取供试液过滤、冲洗,在最后一次冲洗液中加入试验菌1ml,过滤,按薄膜过滤法测定其菌数。
2.4.2 菌液组:取试验菌1ml注入平皿中(n=3),立即倾注琼脂培养基,待凝固后置于规定温度,细菌培养24~48h,白色念珠菌和黑曲霉培养48~72h,测定所加入的试验菌数;薄膜过滤法时,取供试液过滤,冲洗,在最后一次冲洗液中加入试验菌1ml,过滤,按薄膜过滤法测定其菌数。
2.4.3 供试品对照组:按“2.3”项下相应方法操作后,立即倾注琼脂培养基,待凝固后置于规定温度,细菌培养24~48h,白色念珠菌和黑曲霉培养48~72h,测定供试品本底菌数;薄膜过滤法时,取供试液过滤,冲洗,按薄膜过滤法测定其菌数。
2.4.4 回收率的计算:试验组的加菌回收率=(试验组平均菌落数-供试品对照组平均菌落数)/(菌液组的平均菌落数)×100%。
试验结果表明,本品采用平皿法、培养基稀释法、薄膜过滤法[A,即以0.1%蛋白胨水溶液为冲洗液(冲洗量100、200、300、400、500、600、700、800ml)进行检验,枯草芽孢杆菌的回收率均小于70.0%];采用薄膜过滤法[B,即以含0.1%聚山梨酯80的0.1%蛋白胨水溶液为冲洗液(冲洗量为每膜200ml)]进行检验,枯草芽孢杆菌的回收率均>85.0%。而大肠埃希菌、金黄色葡萄球菌、白色念珠菌、黑曲霉采用培养基稀释法(每皿0.2ml)测定,回收率均>80.0%,结果详见表1。3批样品5种试验菌采用薄膜过滤法(B),回收率均>85.0%,结果见表2。
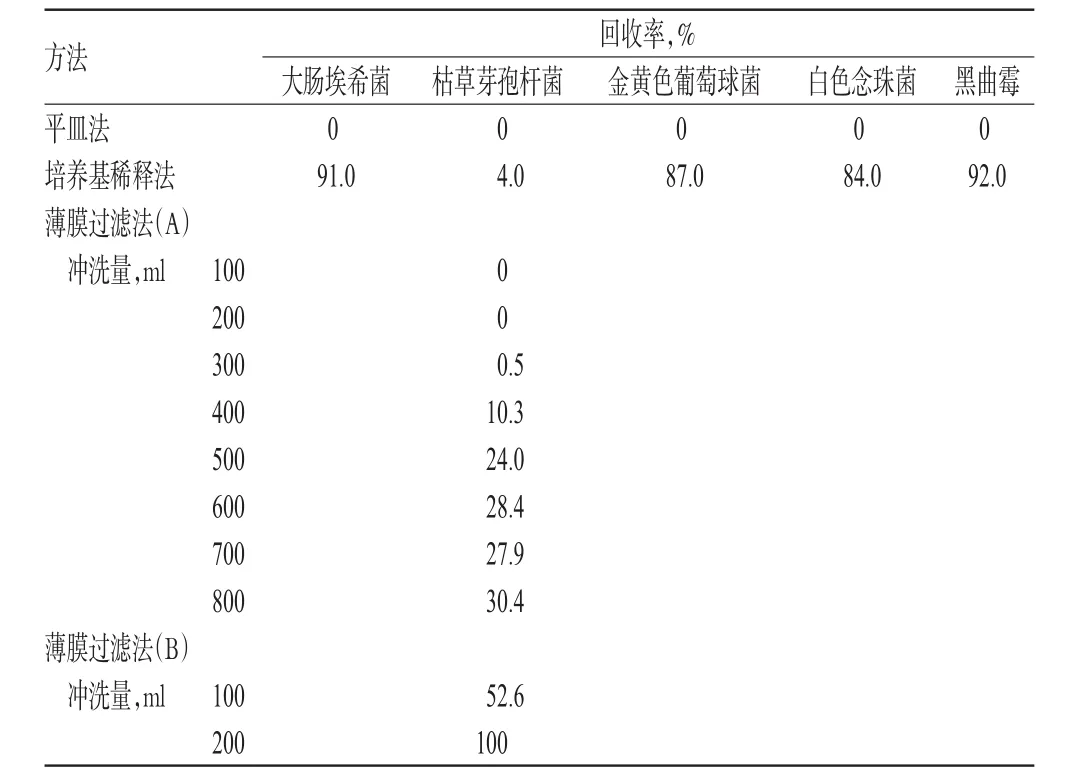
表1 不同方法回收率结果(n=3)Tab 1Recovery rate by different methods(n=3)

表2 3批样品薄膜过滤法(B)回收率结果(n=3)Tab 2 Recovery rate of membrane filtration method(B)for 3batches of samples(n=3)
2.5 控制菌检查验证试验
2.5.1 金黄色葡萄球菌:取上述1∶10的供试液10ml加入至相应100、200、300ml的营养肉汤培养基中(共2组),同时一组接种金黄色葡萄球菌10~100CFU作为试验组,另一组接种大肠埃希菌10~100CFU作为阴性菌对照组,35℃培养24h。结果,试验组、阴性菌对照组的营养肉汤均呈现浑浊。分别取培养物划线接种于甘露醇氯化钠琼脂培养基平板上,35℃培养24~72h,结果阴性菌对照组100、200、300ml及试验组100、200ml在平板上均未见菌落生长,试验组300ml在平板上有金黄色葡萄球菌典型菌落生长,结果见表3。

表3 金黄色葡萄球菌验证试验结果Tab 3 Results of validation tests for Staphlococcus aureus
从表3可得出,采用培养基稀释法(培养基300ml),阴性菌对照组未检出阴性对照菌,试验组检出试验菌。表明金黄色葡萄球菌可采用此法进行控制。
2.5.2 铜绿假单胞菌:取上述1∶10的供试液10ml加入至100ml BL培养基中(共2组),同时一组接种铜绿假单胞菌10~100CFU作为试验组,另一组接种大肠埃希菌10~100CFU作为阴性菌对照组,35℃培养18~24h。结果,试验组、阴性菌对照组的BL均呈现浑浊。分别取培养物划线接种于溴化十六烷基三甲铵琼脂培养基平板上,35℃培养18~24h,结果阴性菌对照组在平板上未见菌落生长,试验组在平板上有铜绿假单胞菌典型菌落生长,结果表明铜绿假单胞菌可采用常规法进行控制,详见表4。

表4 铜绿假单胞菌验证试验结果Tab 4 Results of validation tests for Pseudomonas aeruginosa
2.6 验证试验结果
按上述建立的复方硫磺洗剂微生物限度检查法,细菌数采用薄膜过滤法(B),即以含0.1%聚山梨酯80的0.1%蛋白胨水溶液为冲洗液(冲洗量为每膜200ml)进行测定,霉菌、酵母菌数采用培养基稀释法(每皿0.2ml)测定,对控制菌金黄色葡萄球菌采用培养基稀释法(培养基300ml),铜绿假单胞菌采用常规法。对3批样品进行检验,结果可确定上述方法为本品的微生物限度检查方法,详见表5。

表5 3批样品微生物限度检查方法验证试验结果Tab 5 Results of validation tests of microbial limit test for 3batches of samples
3 讨论
(1)增溶剂对试验结果的影响:复方硫磺洗剂处方中主要抑菌成分为升华硫,不溶于水,微溶于乙醇、醚,易溶于二硫化碳。最直接、有效的去除抑菌活性的方法当属薄膜过滤法。试验中,薄膜过滤采用以0.1%蛋白胨水溶液为冲洗液从100ml至800ml进行冲洗,但枯草芽孢杆菌的回收率仍无法达到《中国药典》70.0%的要求;且试验菌生长缓慢、弱小,往往需要延长2d培养时间。聚山梨酯80是非离子型的表面活性剂,具有乳化、扩散、增溶和稳定的作用,还可作为中和剂(灭活剂),即其使用不但增加药品的溶解性,还对药品抑菌性具有中和作用[2],故选择聚山梨酯80作为增溶剂。其增溶机制是表面活性剂在水中形成“胶束”的结果,由于胶束的内部与周围溶剂的介电常数不同,难溶性药物根据自身的化学性质,以不同方式与胶束相互作用,使药物分子分散在胶束中。对增溶剂的加入量进行选择,结果显示,加入量过小,不能完全分散药物;加入量过大,会出现过量的泡沫,影响冲洗效果。故最后以0.1%的聚山梨酯80作为增溶剂,可满足试验需要。
(2)不同医院生产的复方硫磺洗剂在微生物限度检查方法有所不同,有使用薄膜过滤法[3],也有采用离心沉淀法结合薄膜过滤法[4]。原因有可能是不同医院同一制剂在处方原料和制备方法上有所不同,由于制剂稳定性的问题,有的医院可能对该制剂作一些改进;也可能有的医院用升华硫,有的用沉降硫;还有可能硫磺的质量不同等。因此,在药品监督检验工作中,经常遇到同一制剂不同生产厂家提供的微生物限度检查资料所采用的方法不同的情况,比如有常规法、培养基稀释法、离心沉淀法、薄膜过滤法等。
微生物限度检查目前在国外越来越受到重视,每版药典收载的品种也越来越多,如《美国药典》(USP)24版收载微生物限度品种(217个)较23版(150个)增加67个[5]。从发展趋势来看,国家药品标准对不同单位生产的同一剂型同一品种的药品应制订统一的检验方法,以促进我国由以剂型制订微生物限度标准向以品种制订微生物限度标准过渡工作的进行。从本试验结果得出,为了制订科学合理的复方硫磺洗剂微生物限度检查方法,建议统一采用在冲洗液中加入0.1%聚山梨酯80的薄膜过滤法较为稳妥。该方法具有简便、实用的特点。
(3)《中国药典》规定[1],若药品的组分或原检验条件发生改变可能影响检验结果时,对检查方法应重新验证。由于进行再验证时,药品中的活性成分未发生改变,故其抗菌谱也未改变,因此笔者认为再验证工作仅需针对《中国药典》规定的全部验证菌株中的最敏感菌株即可,而不必对全部菌株进行再验证。即对复方硫磺洗剂进行再验证时,仅需证明试验中最敏感菌株(枯草芽孢杆菌)的回收率大于70.0%,即可说明检查方法有效,无需再逐一验证大肠埃希菌、金黄色葡萄球菌、白色念珠菌和黑曲霉的回收率。采用这种方法,既可保证检验方法的有效性,又节省了大量人力、物力,使得验证工作有可能成为日常检验的一部分。建议《中国药典》逐步收载各抗菌药物的最敏感验证菌株作为质控菌株,以方便日常检验工作。
[1] 国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:附录107-116.
[2] 张光华,余立.聚山梨酯80和卵磷脂在化学药微生物限度检查时的中和作用[J].药物分析杂志,2008,28(7):1127.
[3] 夏巧凤,王晓梅.复方硫磺洗剂微生物限度检查方法研究[J].临床合理用药,2012,5(2B):32.
[4] 马晓璇,李汶,温玉莹.2种含硫磺制剂的微生物限度检查方法验证[J].今日药学,2009,19(2):50.
[5] 周剑,李霞.药品微生物限度检查法中几种样品前处理方法的可行性研究[J].中国药房,2012,23(33):3136.
