选择性血管加压素V2受体拮抗剂治疗肝硬化腹水的Meta分析
2013-08-28汤绍辉张良鹏徐丽艳张小娟周金梅
汤绍辉,张良鹏,徐丽艳,张小娟,周金梅
肝硬化是一种常见的由一种或多种病因引起的慢性﹑进行性﹑弥漫性肝脏病变,其特点是肝细胞在坏死基础上的纤维化,并代之以纤维包绕的异常肝细胞结节(假小叶),是严重且不可逆的肝脏疾病。腹水是肝硬化失代偿期常见的临床表现,常伴有稀释性低钠血症。腹水的发生机制较为复杂,主要是肝硬化时门脉高压﹑低蛋白血症以及舒血管物质的释放,使外周血管扩张,导致有效循环血量不足,通过激活肾素-血管紧张素-醛固酮系统,引起钠﹑水潴留,导致腹水的形成[1]。大约15%的肝硬化腹水患者在1年内死亡,44%在5年内死亡[2]。限制盐﹑水的摄入和使用利尿剂,在一定程度上可以减少肝硬化腹水,但大量使用利尿剂会诱发或加重低钠血症﹑肝性脑病和肝肾综合征等并发症。目前临床上尚无较为理想的减少肝硬化腹水的药物。选择性血管加压素V2受体拮抗剂(selective vasopressin V2receptor antagonists)是一类较为新型的排水利尿药物。近年来,一些学者研究发现,它可通过与肾脏集合管上血管加压素V2受体竞争性结合来抑制肾脏集合管对水的重吸收,达到排水利尿的作用,因此可用于肝硬化腹水的治疗,并可改善低钠血症[3-4]。但另一些研究对此持相反意见,认为其不能使肝硬化腹水的恶化得到改善,且对肝脏有一定损害,因此其疗效并不是很明显[5]。有鉴于此,本研究通过随机对照试验(randomized controlled trial,RCT)对选择性血管加压素V2受体拮抗剂对肝硬化腹水的治疗价值进行系统评价,以期为其临床应用提供客观依据。
1 材料与方法
1.1 检索策略 采用计算机检索PubMed﹑EM-base﹑Web of Science﹑The Cochrane Central Register of Controlled Trials﹑中国期刊全文数据库﹑中国科技期刊数据库(维普)﹑万方数字化期刊全文数据库﹑中国生物医学文献数据库。语种为中文和英文。联合使用下列检索词:英文检索词包括Vasopressin﹑V2receptor antagonist﹑Cirrhosis﹑Ascites﹑Satavaptan﹑Lixivaptan﹑Mozavaptan﹑Tolvaptan﹑Randomized controlled trial,中文检索词包括血管加压素﹑V2受体拮抗剂﹑萨特普坦﹑利希普坦﹑莫扎伐普坦﹑托伐普坦﹑肝硬化﹑腹水﹑随机对照试验。对综述性文献的参考文献进行二次检索。检索无年限限制。
1.2 文献纳入与排除标准 纳入标准:①选择性血管加压素V2受体拮抗剂治疗肝硬化腹水疗效及安全性的RCT;②研究对象为肝硬化合并腹水和(或)低钠血症的患者。研究组使用选择性血管加压素V2受体拮抗剂,对照组使用安慰剂。排除标准:①非随机对照试验;②未提供患者结局和测量方法的试验;③文献综述;④重复报告。
1.3 数据提取及文献质量评价 由2名评价员独立进行计算机检索﹑选择试验并提取资料,遇到不一致时向第三方咨询并通过讨论最终达到一致。文献的质量评价参照Jadad评分法,由两位评价员独立进行,主要从受试者分组是否真正随机﹑研究过程中是否使用了盲法﹑对失访者是否进行记录等方面对入选文献进行质量评价。
1.4 统计学处理 采用Cochrane协作网提供的Rev-Man5.0版软件进行统计分析。Meta分析前先分析研究间的异质性,I2>50%,P<0.05表示研究间有异质性,采用随机效应模型合并;若I2<50%,P>0.05则表示研究间无异质性,采用固定效应模型合并。处理效应量若为数值变量资料,则采用加权均数差值(weighted mean difference,WMD)和95%可信区间(confidence interval,CI)表示;若为二分类变量资料,则采用相对危险度(relative risk,RR)和95%CI表示,P<0.05为差异有统计学意义。
2 结 果
2.1 纳入文献情况 共检索到国内外文献2680篇,阅读文题﹑摘要及全文后,有9篇文献符合纳入标准而入选本研究。9篇文献[3-11]均为选择性血管加压素V2受体拮抗剂与安慰剂对比的对照试验,共1884例患者。各组基础资料对比无差异。纳入文献的基本的基本情况详见表1。
2.2 纳入文献质量评价 纳入文献的Jadad评分多数为3~5分(表2)。
2.3 Meta分析结果
2.3.1 选择性血管加压素V2受体拮抗剂与安慰剂对比对体重变化的影响 有2项临床试验评价了对体重变化的影响,各研究间无明显异质性(I2=0%,P=0.87),采用固定效应模型合并效应量。Meta分析结果显示:治疗组患者体重降低的幅度明显大于安慰剂组(WMD=–1.98kg,95%CI:–3.24~–0.72kg,P=0.002,图1)。
2.3.2 选择性血管加压素V2受体拮抗剂与安慰剂对比对血清钠的影响 有2篇文献评价了对血清钠的影响,各研究间存在异质性(I2=77%,P=0.04),采用随机效应模型合并效应量。Meta分析结果显示:治疗组患者血清钠升高幅度明显大于安慰剂组(WMD=3.74mmol/L,95%CI:0.91~6.58mmol/L,P=0.01,图2)。
2.3.3 选择性血管加压素V2受体拮抗剂与安慰剂对比对腹水恶化的影响 有2篇文献评价了对腹
水恶化的影响,各研究间无明显异质性(I2=0%,P=0.53),采用固定效应模型合并效应量。Meta分析结果显示:治疗组患者腹水恶化的比例较安慰剂组明显降低(RR=0.51,95%CI: 0.34~0.77,P=0.001,图3)。
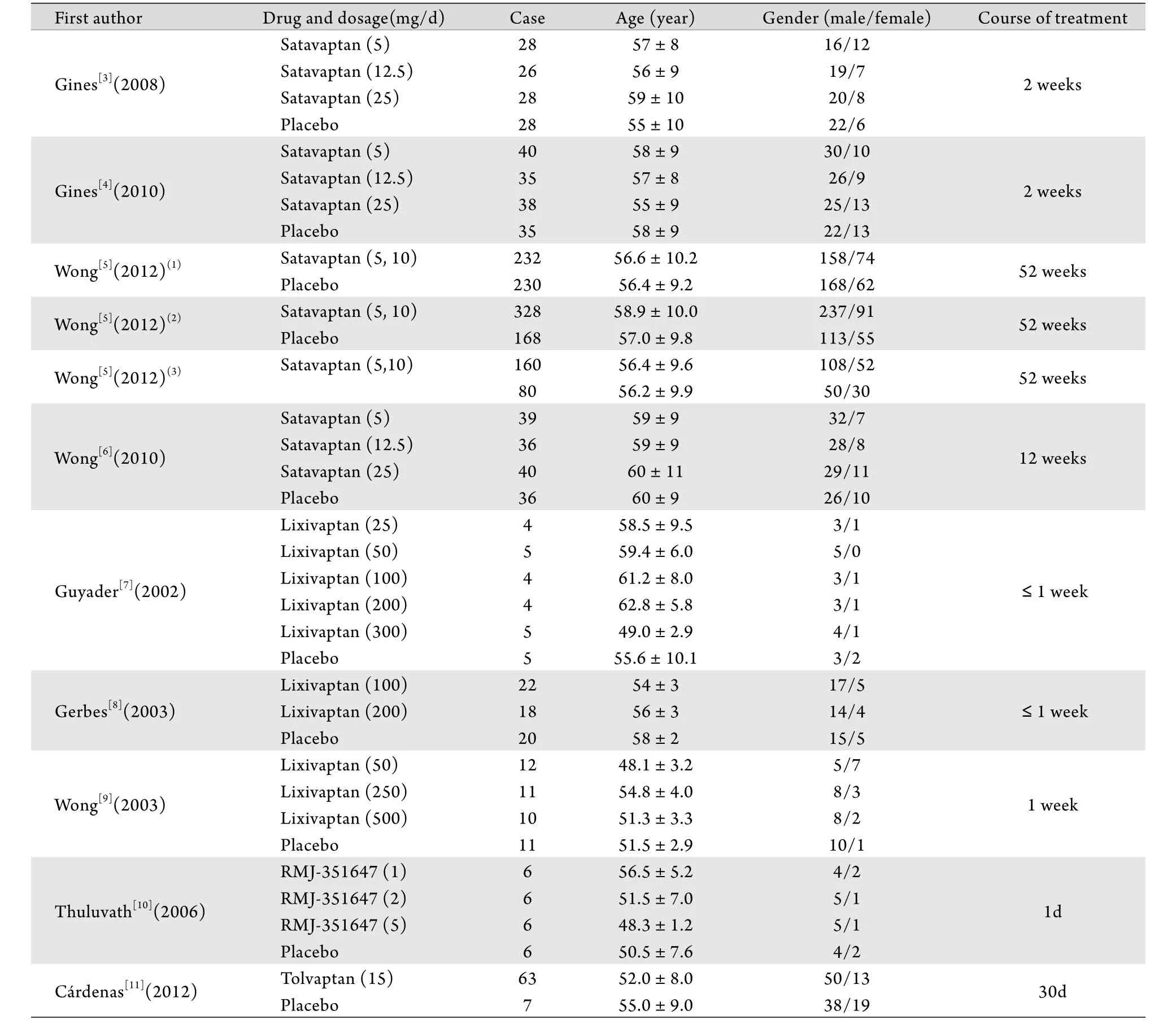
表1 纳入临床试验的基本情况Tab.1 Clinical trials of the selective vasopressin V2 receptor antagonists in cirrhotic patients with ascites

表2 纳入临床试验的Jadad评分Tab.2 Jadad score of included trails
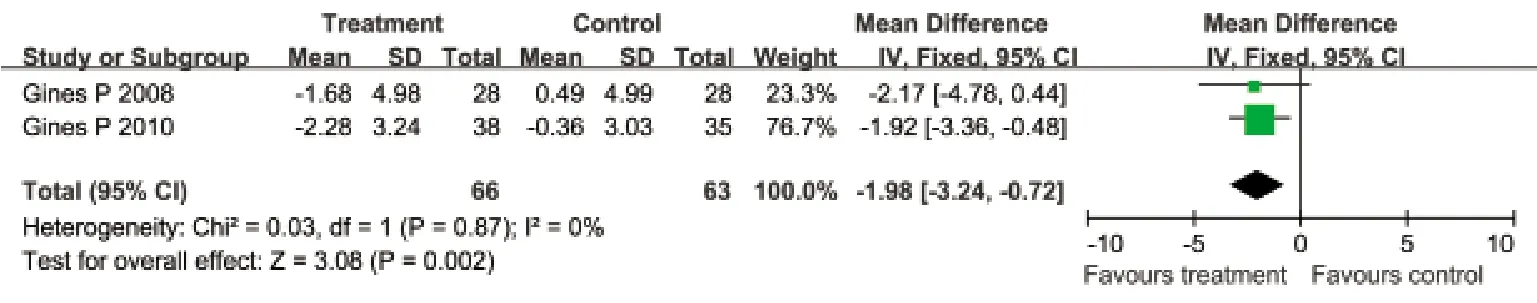
图1 血管加压素V2受体拮抗剂与安慰剂对比对体重变化的影响Fig.1 Effects of vasopressin V2 receptor antagonists and placebo on weight change
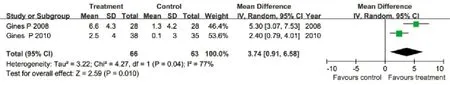
图2 血管加压素V2受体拮抗剂与安慰剂对比对血清钠的影响Fig.2 Effects of vasopressin V2 receptor antagonists and placebo on serum sodium
2.3.4 选择性血管加压素V2受体拮抗剂与安慰剂对比对尿量的影响 有2项临床试验评估了对尿量的影响,各研究间无明显异质性(I2=68%,P=0.08),采用随机效应模型合并效应量。Meta分析结果显示:治疗组患者尿量增加的幅度明显大于安慰剂组(WMD=1437.65ml,95%CI: 649.01~2226.30ml,P=0.0004,图4)。
2.3.5 选择性血管加压素V2受体拮抗剂与安慰剂对比对血肌酐的影响 有3项临床试验评估了对血肌酐的影响,各研究间无明显异质性(I2=0%,P=0.88),采用固定效应模型合并效应量。Meta分析结果显示:治疗组患者血肌酐与安慰剂组相比差异无统计学意义(WMD=–3.49μmol/L,95%CI:–12.54~5.56μmol/L,P=0.45,图5)。
2.3.6 选择性血管加压素V2受体拮抗剂与安慰剂对病死率的影响 有6项临床试验评估了对病死率的影响,各研究间无明显异质性(I2=0%,P=0.59),采用固定效应模型合并效应量。Meta分析结果显示:治疗组患者病死率与安慰剂组相比差异无统计学意义(RR=1.02,95%CI: 0.97~1.06,P=0.49,图6)。
2.3.7 选择性血管加压素V2受体拮抗剂与安慰剂对心率的影响 有2项临床试验评估了对心率的影响,各研究间无明显异质性(I2=0%,P=0.44),采用固定效应模型合并效应量。Meta分析结果显示:治疗组患者心率与安慰剂组相比差异无统计学意义(WMD=1.21次/min,95%CI: –2.51~4.93次/min,P=0.52,图7)。
2.3.8 选择性血管加压素V2受体拮抗剂与安慰剂对血压的影响 有3项临床试验分别评估了对收缩压和舒张压的影响,治疗组与安慰剂组均无明显异质性(P=0.71;P=0.78),采用固定效应模型合并效应量。Meta分析结果显示:治疗组对患者收缩压和舒张压的影响与安慰剂组相比差异无统计学意义(其中收缩压WMD=–0.72mmHg,95%CI: –4.61~3.18mmHg,P=0.72;舒张压WMD=–0.65mmHg,95%CI: –3.28~1.97mmHg,P=0.63,图8﹑9)。
2.3.9 其他不良反应分析 有3项临床试验比较了血管加压素V2受体拮抗剂与安慰剂的其他不良反应情况,结果显示选择性血管加压素V2受体拮抗剂的不良反应(主要表现为口渴﹑高钠血症等)发生率为17%,与安慰剂(3%)相比,差异有统计学意义(RR=4.88,95%CI: 1.70~14.02,P=0.003)。其他研究由于提供的不良反应发生的资料不充分,故未纳入统计。
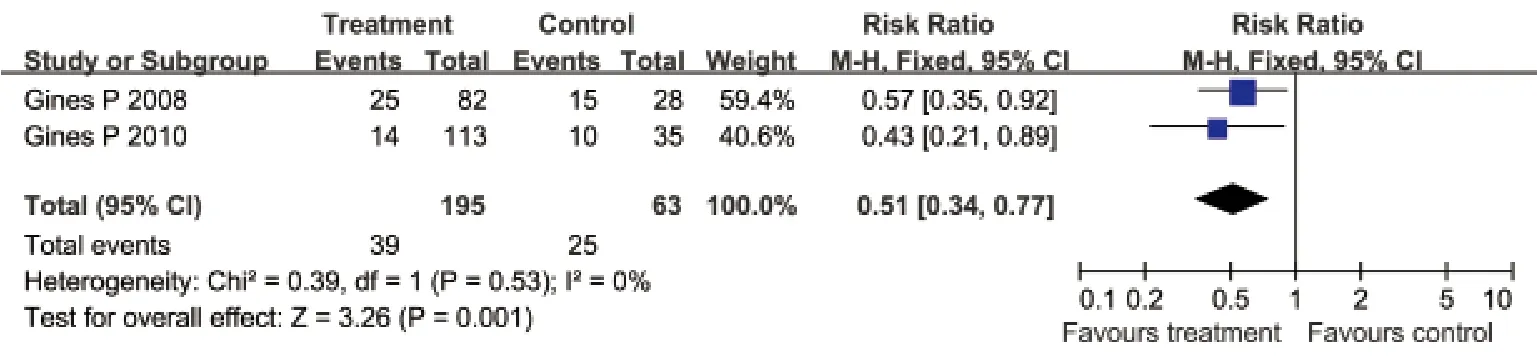
图3 血管加压素V2受体拮抗剂与安慰剂对比对腹水恶化的影响Fig.3 Effects of vasopressin V2 receptor antagonists and placebo on ascites worsening
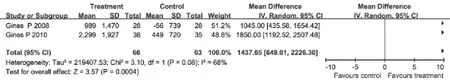
图4 血管加压素V2受体拮抗剂与安慰剂对比对尿量的影响Fig.4 Effects of vasopressin V2 receptor antagonists and placebo on urine volume
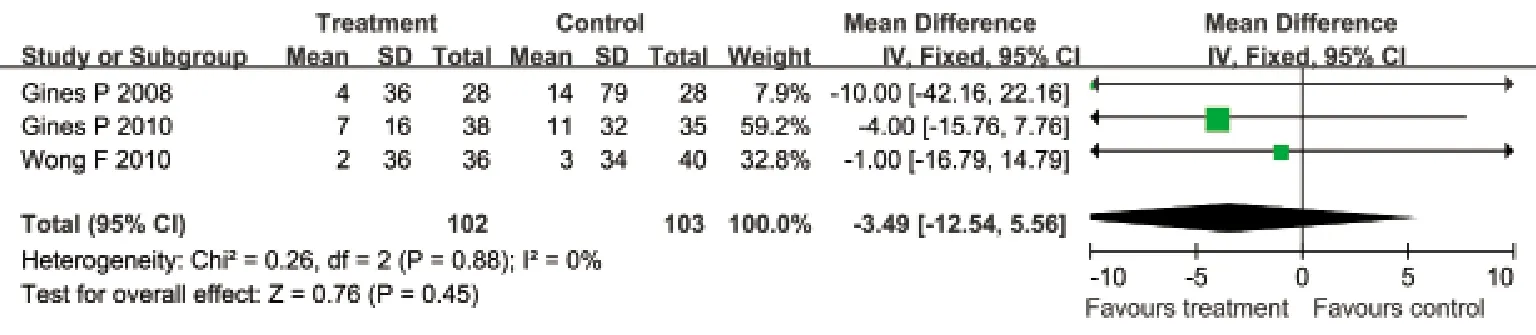
图5 血管加压素V2受体拮抗剂与安慰剂对比对血肌酐的影响Fig.5 Effects of vasopressin V2 receptor antagonists and placebo on serum creatinine
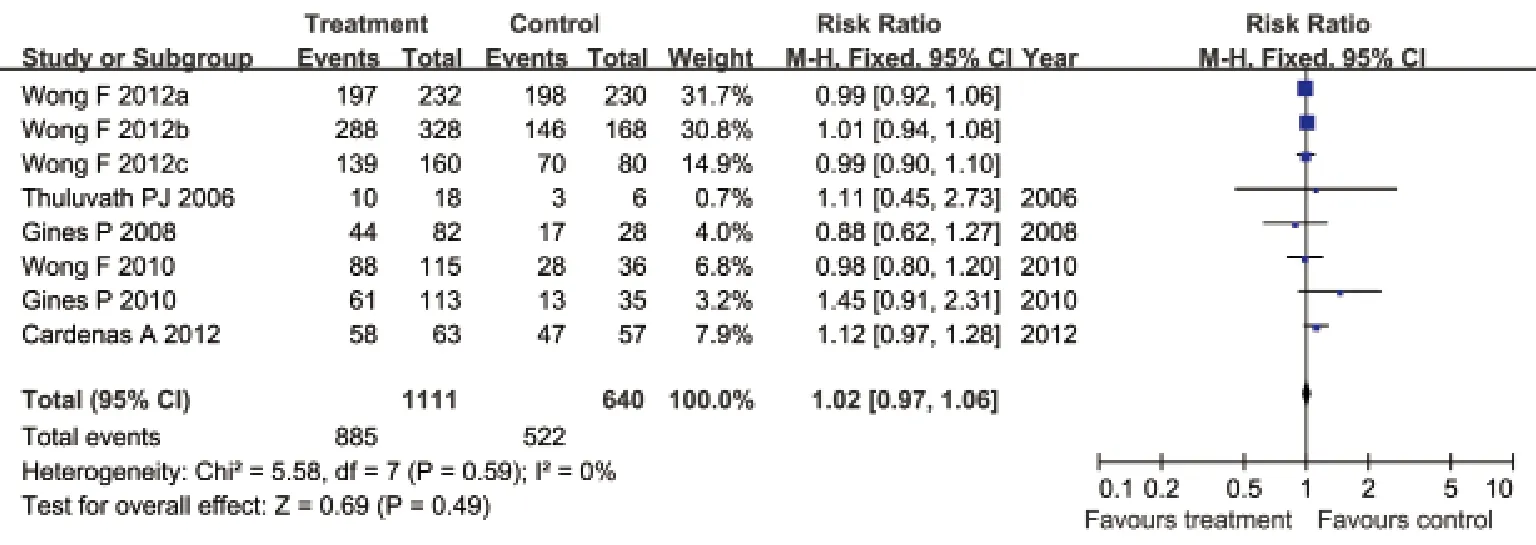
图6 血管加压素V2受体拮抗剂与安慰剂对比对死亡率的影响Fig.6 Effects of vasopressin V2 receptor antagonists and placebo on mortality
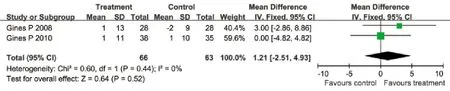
图7 血管加压素V2受体拮抗剂与安慰剂对比对心率的影响Fig.7 Effects of vasopressin V2 receptor antagonists and placebo on heart rate
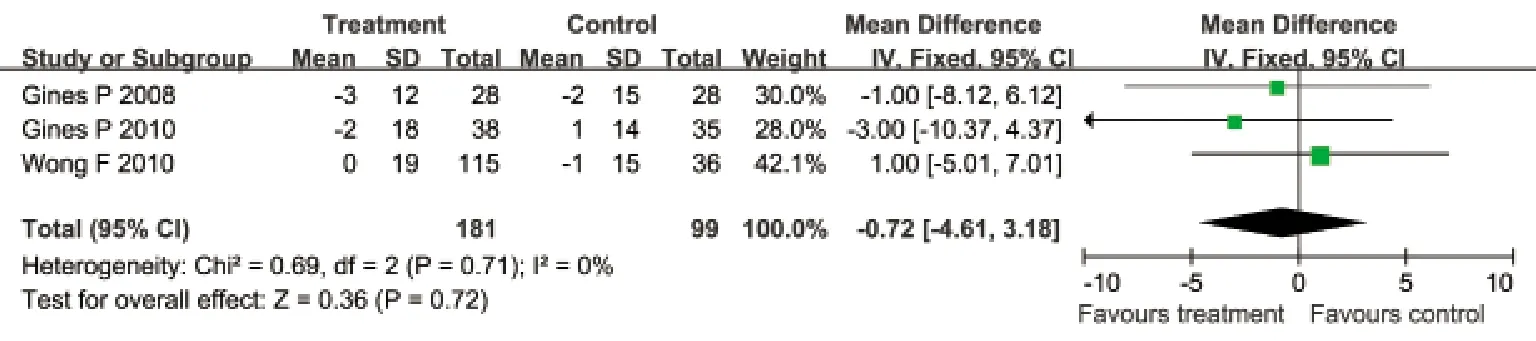
图8 血管加压素V2受体拮抗剂与安慰剂对比对收缩压的影响Fig.8 Effects of vasopressin V2 receptor antagonists and placebo on systolic pressure
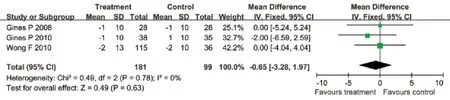
图9 血管加压素V2受体拮抗剂与安慰剂对比对舒张压的影响Fig.9 Effects of vasopressin V2 receptor antagonists and placebo on diastolic pressure
3 讨 论
目前临床上治疗肝硬化腹水的方法主要包括限制钠盐和水的摄入﹑利尿剂的使用﹑腹腔穿刺术和经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt,TIPS)等,但反复使用利尿剂和腹腔穿刺可能诱发或加重低钠血症﹑肝性脑病和肝肾综合征等并发症[12]。TIPS对控制腹水有一定疗效,但术后肝性脑病发生率较高,且易造成分流管狭窄或闭塞,故其临床应用受到一定限制[13]。因此,探索新的减少肝硬化腹水的药物已成为当前的研究热点。
研究发现,肝硬化患者腹水形成的重要因素之一是精氨酸血管加压素(arginine vasopressin,AVP)水平升高。AVP合成于视上核和室旁核的神经元,具有激素和神经肽的双重作用。肝硬化时,肝脏对血管加压素和醛固酮的灭活减少,可引起肾脏集合管对水的重吸收,从而导致患者体内的水潴留,而钠相对不足,临床表现为稀释性低钠血症。AVP受体包括V1aR﹑V1bR(V3R)和V2R,V2受体与环磷酸腺苷作为第二信使的腺苷酸环化酶信号通路有关,主要存在于肾脏集合管主细胞的基底膜上,介导水的重吸收,从而维持血浆渗透压及血容量的稳定[14]。因此,国外一些学者应用选择性血管加压素V2受体拮抗剂治疗肝硬化腹水。但目前已发表的研究结果显示,不同学者报道的疗效差异较大,是否具有确切的减少腹水效果尚存在争议。有鉴如此,刘慧敏[15]采用Meta分析评价了选择性血管加压素V2受体拮抗剂对肝硬化腹水的治疗效果,结果显示选择性血管加压素V2受体拮抗剂减少肝硬化腹水的幅度明显大于安慰剂(P=0.002)。不过,该研究也存在一些不足之处:第一,纳入Meta分析的随机对照试验均为短期,未对药物的长期疗效进行评估;第二,纳入的临床试验偏少,存在较明显的发表偏移。因此,所得结果的可靠性受到一定程度的影响。
本研究根据循证医学原则,制定严格的纳入标准,选择高质量(Jadad评分≥3分)的随机对照试验进行Meta分析,以期更为客观地评价选择性血管加压素V2受体拮抗剂的临床疗效。结果显示,在反映腹水变化指标方面,由于直接测量腹水容量较为复杂,而有研究表明患者体重下降在某种程度上是由腹水容量减少所致,因此我们使用体重变化来间接判断患者的腹水情况[2-3]。选择性血管加压素V2受体拮抗剂可减轻肝硬化腹水患者的体重,其疗效明显优于安慰剂;治疗组患者腹水恶化的比例较安慰剂组明显降低;在血清钠方面,治疗组患者血清钠升高,其幅度明显大于安慰剂组;在反映肾功能指标方面,治疗组患者尿量增加的幅度明显大于安慰剂组,但两者血肌酐无明显差别;在反映循环功能标方面,两组患者心率﹑收缩压和舒张压均无明显差异;在其他不良反应如口渴和高钠血症等方面,治疗组发生率高于安慰剂,但两者病死率无明显区别。上述结果提示,选择性血管加压素V2受体拮抗剂可以改善肝硬化腹水和稀释性低钠血症,并且对心脏和肾脏无明显影响,不良反应相对较少,在治疗肝硬化腹水药物方面,可能成为肝硬化腹水治疗的一种新选择。
虽然本研究制定了较为严格的纳入标准,但是,仍存在一些局限性:①目前能够纳入的RCT及其样本数不够多(仅9个RCT,总共1884例患者);②入选RCT的疗程不一致(1d~52周),且跨度大,半数研究疗程较短(1~2周);③入选的试验多数去除了严重的失代偿期肝硬化﹑肾功能不全和循环功能障碍等重症患者,这在一定程度上影响了试验结果的外在有效性。上述不足之处使本研究结论的可靠性受到一定程度的影响。尽管如此,本研究是目前纳入RCT最多的评价选择性血管加压素V2受体拮抗剂治疗肝硬化腹水疗效的Meta分析,所得出的结论对于选择性血管加压素V2受体拮抗剂治疗肝硬化腹水具有一定的指导意义。期待更多高质量﹑大样本﹑多中心的随机双盲安慰剂对照临床试验,以便更全面地评价选择性血管加压素V2受体拮抗剂治疗肝硬化腹水的疗效与安全性,为其临床应用提供可靠的循证医学证据。
[1] Han P, Ji D, Zhang J, et al. Predictive value of FibroScan on liver ascites cause by cirrhosis[J]. Med J Chin PLA, 2011, 36(11):1143-1144. [韩萍, 纪冬, 张健, 等. 瞬时弹性成像检测对肝硬化腹水的预测作用研究[J]. 解放军医学杂志, 2011, 36(11):1143-1144.]
[2] Planas R, Montoliu S, Ballesté B, et al. Natural history of patients hospitalized for management of cirrhotic ascites[J]. Clin Gastroenterol Hepatol, 2006, 4(11): 1385-1394.
[3] Gines P, Wong F, Watson H, et al. Effects of satavaptan, a selective vasopressin V(2) receptor antagonist, on ascites and serum sodium in cirrhosis with hyponatremia: a randomized trial[J]. Hepatology, 2008, 48(1): 204-213.
[4] Gines P, Wong F, Watson H, et al. Clinical trial: short-term effects of combination of satavaptan, a selective vasopressin V2 receptor antagonist, and diuretics on ascites in patients with cirrhosis without hyponatremia-a randomized, double-blind,placebo-controlled study[J]. Aliment Pharmacol Ther, 2010,31(8): 834-845.
[5] Wong F, Watson H, Gerbes AL, et al. Satavaptan for the management of ascites in cirrhosis: ef fi cacy and safety across the spectrum of ascites severity[J]. Gut, 2012, 61(1): 108-116.
[6] Wong F, Gines P, Watson H, et al. Effects of a selective vasopressin V2 receptor antagonist, satavaptan, on ascites recurrence after paracentesis in patients with cirrhosis[J]. J Hepatol, 2010, 53(2): 283-290.
[7] Guyader D, Patat A, Ellis-Grosse J, et al. Pharmacodynamic effects of a nonpeptide antidiuretic hormone V2 antagonist in cirrhotic patients with ascites[J]. Hepatology, 2002, 36(5):1197-1205.
[8] Gerbes AL, Gulberg VA, Gines P, et al. Therapy of hyponatremia in cirrhosis with a vasopressin receptor antagonist: a randomized,double-blind multicenter trial[J]. Gastroenterology, 2003,124(4): 933-939.
[9] Wong F, Blei AT, Blendis LM, et al. A vasopressin receptor antagonist (VPA-985) improves serum sodium concentration in patients with hyponatremia: a multicenter, randomized, placebocontrolled trial[J]. Hepatology, 2003, 37(1): 182-191.
[10] Thuluvath PJ, Maheshwari A, Wong F, et al. Oral V2receptor antagonist (RWJ-351647) in patients with cirrhosis and ascites: a randomized, double-blind, placebo-controlled, single ascending dose study[J]. Aliment Pharmacol Ther, 2006, 24(6): 973-982.[11] Cárdenas A, Ginès P, Marotta P, et al. Tolvaptan, an oral vasopressin antagonist, in the treatment of hyponatremia in cirrhosis[J]. J Hepatol, 2012, 56(3): 571-578.
[12] Wang GQ, Liu WP. Diagnosis and treatment of cirrhosis ascites[J]. Chin J Pract Intern Med, 2006, 26(21): 1733-1736.[王贵强, 刘卫平. 肝硬化腹水的诊断与治疗进展[J]. 中国实用内科杂志, 2006, 26(21): 1733-1736.
[13] Zhuang ZW, Teng GJ, Jeffery RF, et al. Long-term results and quality of life in patients treated with transjugular intrahepatic portosystemic shunts[J]. AJR Am J Roentgenol, 2002, 179(6):1597-1603.
[14] Gassanov N, Semmo N, Semmo M, et al. Arginine vasopressin(AVP) and treatment with arginine vasopressin receptor antagonists (vaptans) in congestive heart failure, liver cirrhosis and syndrome of inappropriate antidiuretic hormone secretion(SIADH)[J]. Eur J Clin Pharmacol, 2011, 67(4): 333-346.
[15] Liu HM. V2receptor antagonists for the treatment of cirrhotic patients with ascites: systematic review and a meta-analysis[D].Shijiazhuang: Hebei Medical University, 2010. [刘慧敏. 选择性血管加压素V2受体拮抗剂治疗肝硬化的系统评价和meta分析[D]. 石家庄: 河北医科大学, 2010.]
