当归调经胶囊的薄层鉴别与阿魏酸、芍药苷的测定
2013-08-28谢仲德方应权李文烈夏天水
谢仲德, 方应权, 李文烈, 夏天水
(1.重庆三峡医药高等专科学校药学系,重庆万州 404020;2.石家庄以岭药业股份有限公司,河北石家庄 050035;3.成都倍特药业有限公司,四川成都 610041)
当归调经胶囊是由当归、熟地黄、川芎、党参、白芍、甘草和黄芪组成的复方制剂。具有补血助气,调经功效,用于贫血衰弱,病后、产后血虚以及月经不调,痛经[1]。是在原当归调经颗粒[已收载于《部颁中药成方制剂》第10册 (WS3-B-1925-95)]的基础上进行工艺改良而制备的新制剂,具有疗效好、服用剂量小的特点。采用薄层色谱法对制剂中的当归、川芎、白芍进行了定性鉴别研究,采用高效液相色谱法建立阿魏酸、芍药苷的定量测定方法。
1 仪器与试药
紫外分光光度计 (岛津UV-3150)、恒温水浴锅 (余姚精益温度仪表厂)、硅胶G(青岛海洋化工有限公司)、高效液相色谱法仪 (北京创新通恒科技有限公司高效液相色谱仪:D3000高压输液泵,UV2000紫外分光检测器)、电子天平 (BS-224S型,北京赛多利斯仪器系统有限公司)。当归对照药材 (批号9271-9905)、川芎对照药材 (批号0919-200004)、阿魏酸对照品 (批号0773-9910)、芍药苷对照品 (批号0736-200014)均购自中国药品生物制品检定所。化学试剂为分析纯。当归调经胶囊 (批号110201、110202、110203,自制)。
2 薄层鉴别
2.1 当归、川芎的薄层色谱鉴别[2]取当归调经胶囊样品10粒,研细,取粉末2 g至烧杯中,加水10 mL溶解,加乙醇40 mL,边加边搅拌,倾溶液至蒸发皿中,置水浴上蒸去乙醇至约10 mL,移至分液漏斗中,用少量水洗涤蒸发皿,洗涤液倒入分液漏斗中,用乙醚振摇提取2次,每次15 mL,合并乙醚提取液,再向上述乙醚溶液中加2%碳酸钠溶液振摇提取2次,每次15 mL,弃去乙醚液,提取液用盐酸调节pH值至2~3,用少量苯洗涤,弃去苯液,再用乙醚振摇提取2次,每次30 mL,合并乙醚提取液,挥干,残渣加乙醇1 mL溶解,作为供试品溶液。另取当归和川芎对照药材各1 g,分别加水100 mL,煎煮1 h,滤过,滤液浓缩至约10 mL,分别加乙醚振摇提取2次,每次15 mL,合并乙醚提取液,挥去乙醚,残渣加乙醇1 mL使溶解,分别制成当归和川芎的对照药材溶液。另取阿魏酸对照品,加乙醇制成每1 mL含1 mg的溶液,作为对照品溶液。照薄层色谱法 (中国药典2010年版一部附录VI B)试验,吸取上述各溶液各10 μL分别点于同一硅胶G薄层板上,以苯-冰醋酸-甲醇 (30∶1∶3)为展开剂,展开,取出,晾干,置紫外光灯 (365 nm)下检视。供试品色谱中,在与对照药材和对照品色谱相应的位置上,显相同颜色的荧光斑点,阴性对照无干扰,见图1。
2.2 白芍的薄层色谱鉴别[3]取当归调经胶囊样品10粒,研细,取粉末2 g,加水20 mL加热溶解,置分液漏斗中,用水饱和的正丁醇提取2次,每次30 mL,合并正丁醇液,用水洗涤萃取液2次,每次20 mL。正丁醇液置水浴上浓缩至约1 mL,加中性氧化铝0.5 g,拌匀,干燥,装入中性氧化铝柱 (100~200目,约1 g,内径1~1.5 cm)上,以乙酸乙酯-甲醇 (1∶1)30 mL洗脱,收集洗脱液,蒸干,残渣加乙醇1 mL使溶解,作为供试品溶液。另取白芍对照药材的粉末1 g,加乙醇15 mL,振摇5 min,滤过,滤液蒸干,残渣加乙醇1 mL使溶解,制成白芍的对照药材溶液。另取芍药苷对照品,加乙醇制成每1 mL含2 mg的溶液,作为对照品溶液。照薄层色谱法 (中国药典2010年版一部附录ⅤI B)试验,吸取上述供试品溶液10 μL、对照品溶液5 μL,分别点于同一硅胶G薄层板上,以三氯甲烷-乙酸乙酯-甲醇-乙酸 (10∶4∶6∶0.8)为展开剂,展开,取出,晾干,喷5%香草醛硫酸溶液,热风吹至斑点显色清晰。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点,阴性对照液色谱中无干扰,见图2。
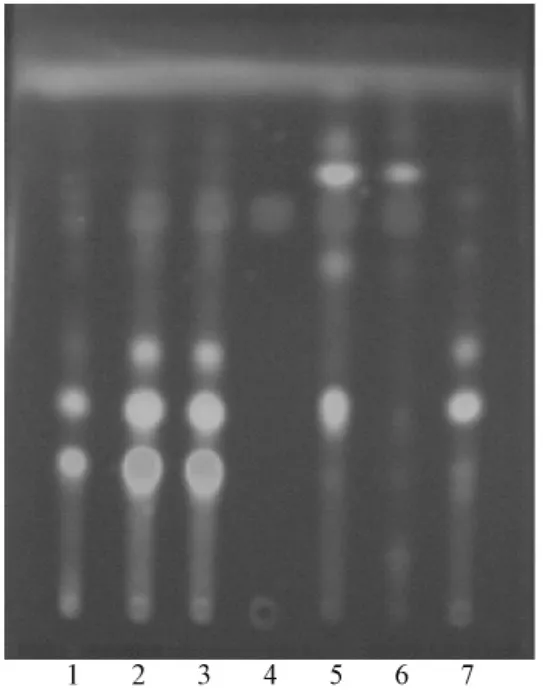
图1 当归、川芎 (阿魏酸)的TLC色谱图
3 HPLC测定当归调经胶囊中阿魏酸
3.1 色谱条件[4-7]Kromasil-C18色谱柱(250 mm×4.6 mm,5 μm);流动相为甲醇-乙腈-1%冰乙酸溶液 (5∶1∶10);体积流量1.0 mL/min;柱温为室温;检测波长为323 nm;进样量10 μL;阿魏酸出峰时间为20 min;理论板数按阿魏酸计算应不低于2 000。
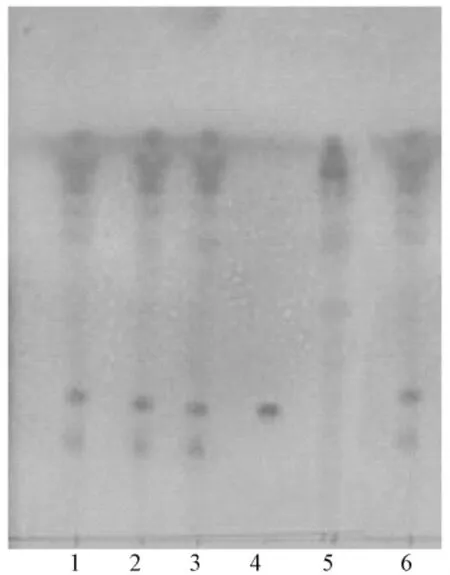
图2 白芍 (芍药苷)的TLC色谱图
3.2 对照品溶液的制备 取阿魏酸对照品适量,精密称定,加甲醇制成每1 mL含50 μg的溶液,即得。
3.3 供试品溶液的制备 取当归调经胶囊样品 (批号110201)10粒,研细,取粉末5 g,精密称定,置分液漏斗中,用20 mL水溶解,加少量氯化钠,用二氯甲烷提取4次 (每次20 mL),合并二氯甲烷层,用旋转蒸发器挥干并回收二氯甲烷,残渣用甲醇溶解并定容至5 mL量瓶中,作为供试品溶液。
3.4 阴性样品溶液的制备 按当归调经胶囊处方和制法,制成缺当归和白芍阴性制剂,精密称取5 g,再按供试品溶液制备方法制备阴性溶液。进样20 μL测定,结果表明阴性样品对阿魏酸测定无干扰,见图3。
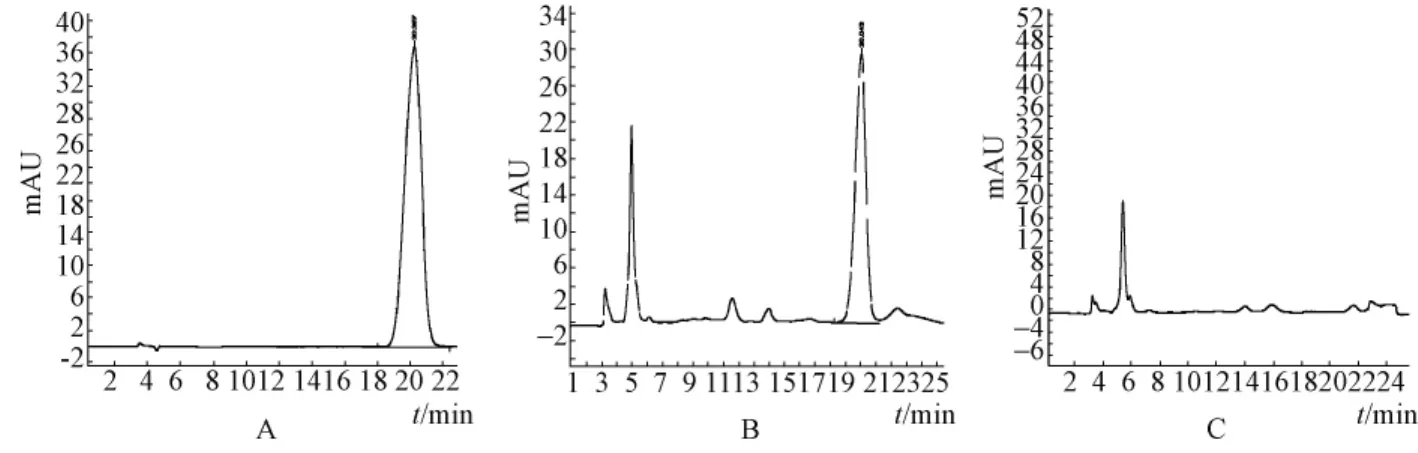
图3 阿魏酸对照品 (A)、供试品 (B)及阴性样品 (C)的HPLC色谱图
3.5 标准曲线与线性范围 精密称取阿魏酸对照品7.68 mg,置25 mL量瓶中,加甲醇溶解并稀释到刻度,作为贮备液 (0.307 2 mg/mL)。精密量取贮备液0.5、1、2、4、8 mL置10 mL量瓶中,加甲醇溶解并稀释到刻度,分别精密吸取20 μL,注入液相色谱仪,按上述色谱条件测定。以阿魏酸的峰面积值为纵坐标,以质量浓度为横坐标,进行线性回归,得出回归方程为:Y=5×107X,r=1,标准曲线为通过原点的一条直线,所以可以用外标一点法测定计算阿魏酸。结果表明阿魏酸在0.015 4~0.245 8 mg/mL质量浓度范围内与峰面积线性关系良好。
3.6 精密度试验 取同一对照品溶液 (质量浓度为51.2 μg/mL)及同一供试品样品 (批号110201)溶液各重复进样5次,每次20 μL,观察其重复性。结果表明,对照品溶液阿魏酸峰面积的RSD为1.52%,供试品阿魏酸峰面积的RSD为0.93%,表明本法精密度好。
3.7 稳定性试验 分别于0、2、4、6、8 h精密吸取阿魏酸对照品溶液 (质量浓度为51.2 μg/mL)及供试品溶液(批号110201)各20 μL注入液相色谱仪测定,对照品溶液峰面积的RSD为0.429%,供试品溶液峰面积的RSD为0.619%。结果表明,对照品及供试品溶液在8 h内稳定。
3.8 重复性试验 取当归调经胶囊 (批号110201)5份,分别精密称定,按供试品溶液的制备方法制成供试品溶液,另取阿魏酸对照品适量,加甲醇制成1 mL含阿魏酸对照品0.048 mg的对照品溶液。
精密吸取供试品、对照品溶液各20 μL注入液相色谱仪,以甲醇-乙腈-1%冰乙酸溶液 (5∶1∶10)为流动相,测定,计算供试品溶液的RSD为1.83%,结果表明,方法重现性良好。
3.9 加样回收率试验 取已测定的当归调经胶囊试制样品3批 (批号:110201、110202、110203),各3份,约0.5 g,精密称定,分别按其含有量的80%、100%、120%加入阿魏酸对照品适量,按供试品溶液的制备方法,制成供试品溶液,依法测定,计算回收率。结果平均回收率为98.10%,RSD为1.37%。见表1。
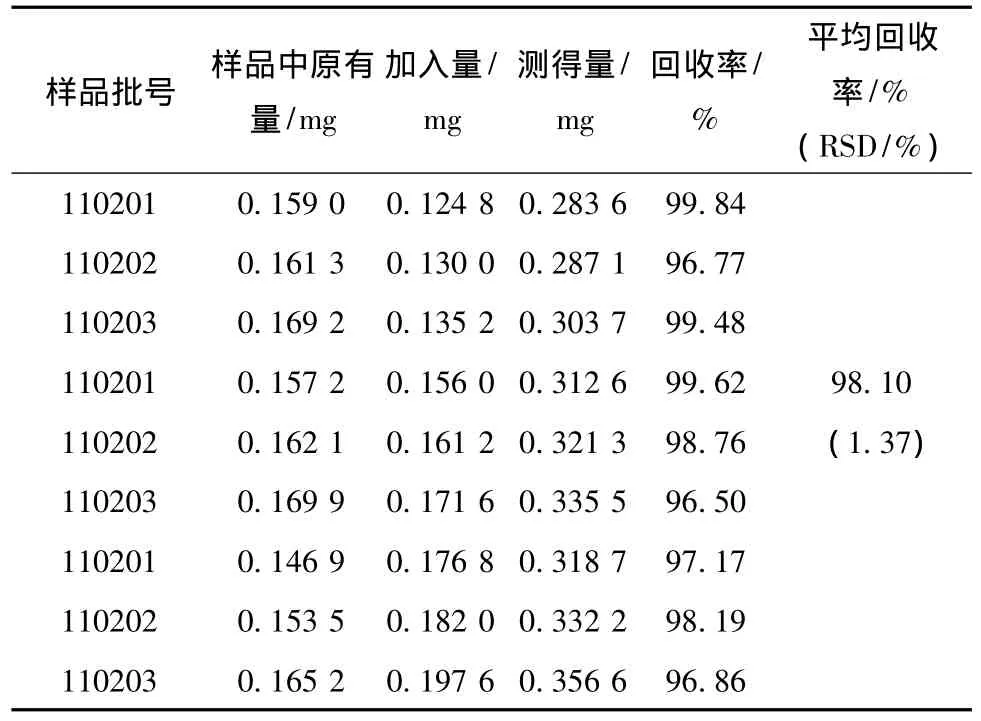
表1 阿魏酸加样回收试验结果
3.10 样品测定 精密称取3批当归调经胶囊样品 (批号:110201、110202、110203,每批制成3份供试品)各5 g,按供试品溶液的制备方法,制成供试品溶液,分别按3.1项下的色谱条件进行测定,结果见表2。
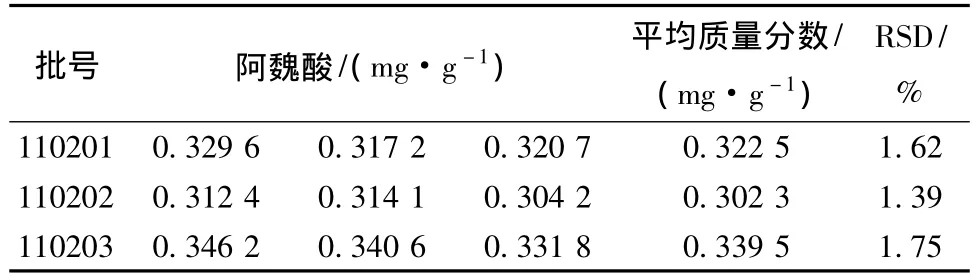
表2 样品中阿魏酸测定结果 (n=3)
根据测定结果,每1 g样品中阿魏酸量最高为:0.346 2 mg,最低为:0.304 2 mg,平均质量分数为0.324 1 mg/g,结合厂方工艺提取率以及药材质量的差异,故本制剂阿魏酸含有量暂定为:每1 g样品含阿魏酸 (C10H10O4)不得少于0.300 0 mg。
4 HPLC测定当归调经胶囊中芍药苷
4.1 色谱条件[8-11]Kromasil-C18色谱柱 (250 mm×4.6 mm,5 μm);流动相为乙腈-水 (18∶82);体积流量1.0 mL/min;柱温为室温;检测波长为280 nm;进样量10 μL;芍药苷出峰时间为23 min;理论板数按阿魏酸计算应不低于2 000。
4.2 对照品溶液的制备 取芍药苷对照品适量,精密称定,加甲醇制成每1 mL含40 μg的溶液,即得。
4.3 供试品溶液的制备 取当归调经胶囊样品 (批号110201)10粒,研细,取粉末5 g,精密称定,置具塞锥形瓶中,精密加入甲醇25 mL,密塞称定质量。超声处理25 min,放冷,再称定质量,用甲醇补足减失质量,摇匀,滤过,取续滤液作为供试品溶液。
4.4 阴性样品溶液的制备 按当归调经胶囊处方和制法,制成缺白芍阴性制剂,精密称取5 g,再按供试品溶液制备方法制备阴性溶液。进样10 μL测定,结果表明阴性样品对芍药苷测定无干扰,见图4。
4.5 标准曲线与线性范围 精密称取芍药苷对照品8.02 mg,置20 mL量瓶中,加甲醇溶解并稀释到刻度,作为贮备液 (0.401 mg/mL)。精密量取贮备液0.5、1、2、4、8 mL置10 mL量瓶中,加甲醇溶解并稀释到刻度,分别精密吸取20 μL,注入液相色谱仪,按上述色谱条件测定。以芍药苷的峰面积值为纵坐标,以质量浓度为横坐标,进行线性回归,得出回归方程为:Y=2×107X,r=0.999 8,标准曲线为通过原点的一条直线,所以可以用外标一点法测定计算芍药苷的量。结果表明芍药苷在0.020 05~0.320 8 mg/mL质量浓度范围内与峰面积线性关系良好。
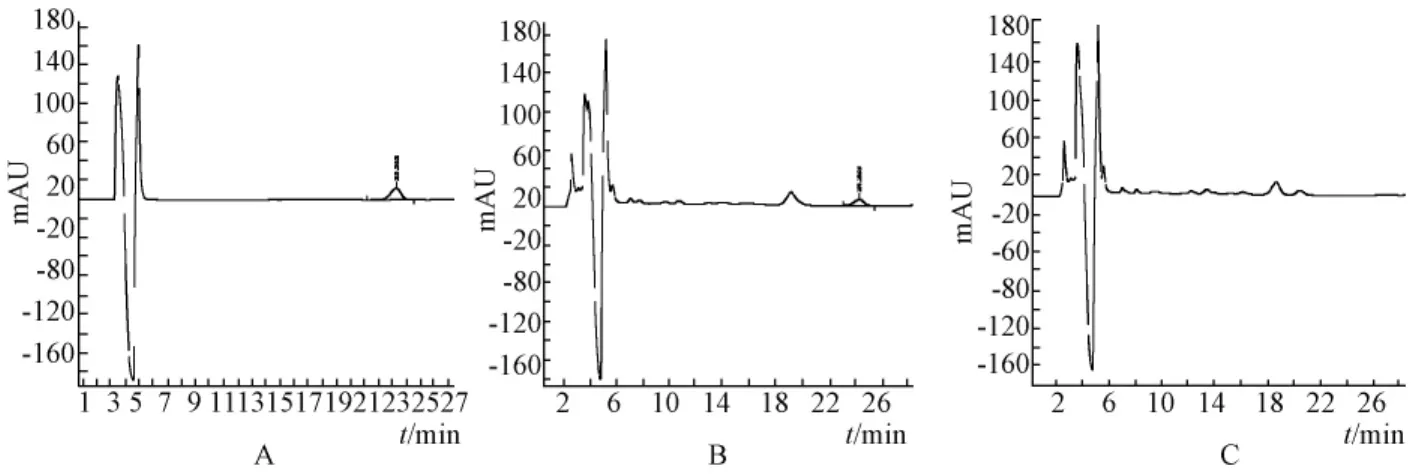
图4 芍药苷对照品 (A)、供试品 (B)及阴性样品 (C)的HPLC色谱图
4.6 精密度试验 取同一对照品溶液 (质量浓度为40.1 μg/mL)及同一供样品 (批号110201)溶液各重复进样5次,每次20 μL,观察其重复性。结果表明,对照品溶液芍药苷峰面积的RSD为1.28%,供试品芍药苷峰面积的RSD为1.53%,表明仪器精密度好。
4.7 稳定性试验 分别于0、2、4、6、8 h精密吸取芍药苷对照品溶液 (质量浓度为40.1 μg/mL)及供试品溶液(批号110201)各20 μL注入液相色谱仪测定,对照品溶液峰面积的RSD为1.68%,供试品溶液峰面积的RSD为1.75%。结果表明,对照品及供试品溶液在8 h内稳定。
4.8 重复性试验 取当归调经胶囊 (批号110201)5份,分别精密称定,按供试品溶液的制备方法制成供试品溶液,另取芍药苷对照品适量,加甲醇制成1 mL含芍药苷对照品40 μg的对照品溶液。
精密吸取供试品、对照品溶液各20 μL注入液相色谱仪,测定,计算供试品中芍药苷的量,其RSD为1.95%,结果表明,本法方法重复性良好。
4.9 加样回收率试验 取已测定的当归调经胶囊试制样品3批 (批号:110201、110202、110203),各3份,约2.5 g,精密称定,分别按其含有量的80%、100%、120%加入芍药苷对照品适量,按供试品溶液的制备方法,制成供试品溶液,依法测定,计算回收率。结果平均回收率为99.05%,RSD为1.02%。见表3。
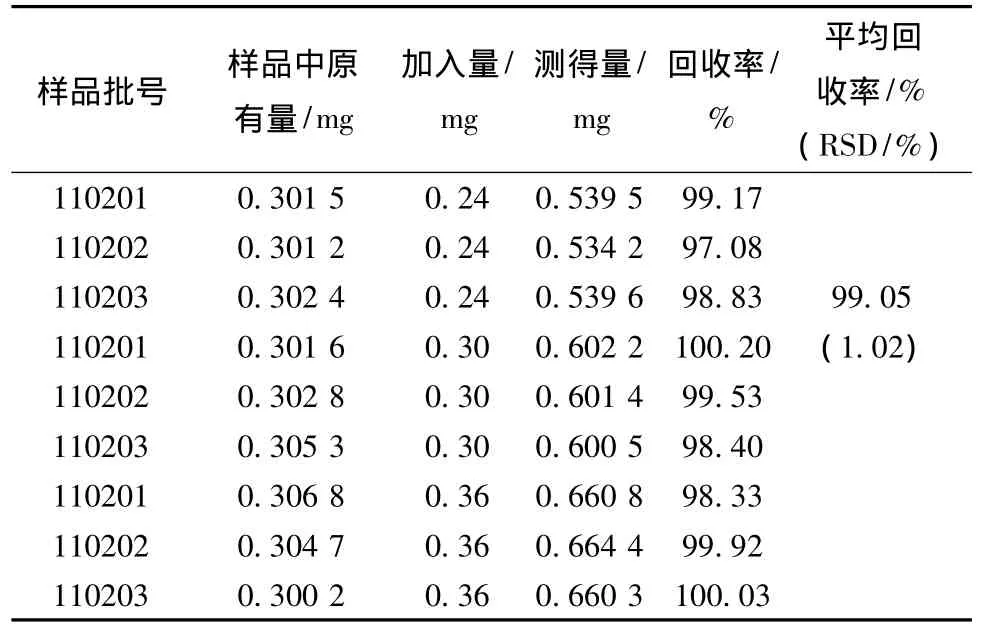
表3 芍药苷加样回收试验结果
4.10 样品测定 精密称取3批当归调经胶囊样品 (批号:110201、110202、110203,每批制成3份供试品)各5 g,按供试品溶液的制备方法,制成供试品溶液,分别按3.1项下的色谱条件进行测定,结果见表4。
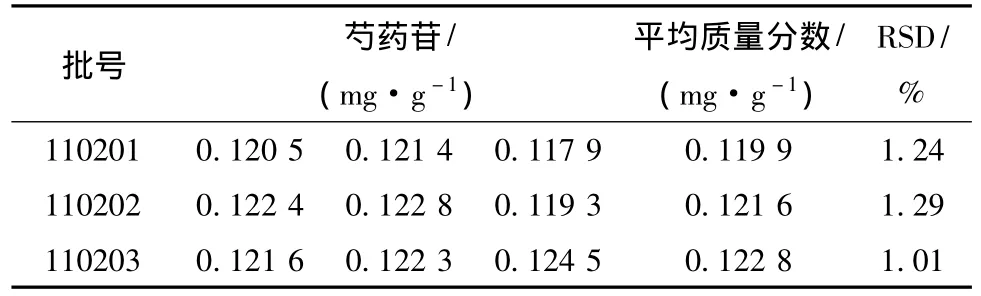
表4 样品芍药苷测定结果 (n=3)
根据测定结果,每1 g样品中芍药苷量最高为0.122 8 mg,最低为0.120 5 mg,平均质量分数为0.121 4 mg/g,结合厂方工艺提取率以及药材质量的差异,故本制剂芍药苷含有量暂定为每1 g样品含芍药苷不得少于0.120 0 mg。
5 讨论
经反复实验,通过优选实验方法和展开剂,对当归调经胶囊中当归、川芎、白芍进行TLC鉴别,其色谱特征斑点清晰、专属性强,所以此3味中药可用于该制剂的定性鉴别。川芎、当归均有活血调经、化瘀止痛的功效,其有效成分均为阿魏酸[12]、芍药苷,对妇女月经不调有很强的药理作用,所以阿魏酸、芍药苷可以作为该制剂的指标性成分。当归调经胶囊每1 g样品中阿魏酸不得低于0.300 0 mg/g和芍药苷不得低于0.120 0 mg,以此作为该制剂定量测定指标。
实验选用甲醇-乙腈-1%冰乙酸溶液作流动相,增加甲醇量可改变峰形,减少拖尾,但甲醇比例过高,分离效果下降,不易与杂质峰分离。另外加入1%冰乙酸主要是调节流动相的pH,缩短分离时间,改善分离度。
[1]国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1999:893.
[2]姚慧娟,胡道德,顾 磊,等.灵杞黄斑胶囊的薄层鉴别研究[J].时珍国医国药,2009,20(11):2795-2796。
[3]黄艳萍,黄勇红.当归调经片的薄层鉴别和阿魏酸的测定[J].中国实验方剂学杂志,2010,16(6):119-121.
[4]叶会呈,叶期馨,王带媚,等.HPLC法测定血府逐瘀汤中阿魏酸的含量[J].中国新药与临床药理,2009,20(4):356-358.
[5]王 健,范文成,叶晓红,等.HPLC法测定妇康片中阿魏酸的含量[J].中国实验方剂学杂志,2008,14(8):15-16.
[6]彭 红,付建武,余日跃.复方当归注射液中羟基红花黄色素A和阿魏酸的含量测定[J].时珍国医国药,2009,20(12):2925-2927.
[7]谭晓虹,郭春燕,李 倩,等.桃红四物汤水提液中没食子酸、芍药苷和红花黄色素含量的测定[J].中成药,2008,30(7):9945-997.
[8]毛晓敏,张小波,陈小清,等.HPLC同时测定十二乌鸡白凤丸中芍药苷、阿魏酸和丹皮酚的含量[J].中成药,2008,30(5):678-681.
[9]凌 明,马安宇.HPLC测定胃肠合剂中芍药苷和黄芩苷的含量[J].中成药,2008,30(9):1311-1313.
[10]贺志伟,贺 庆,林云径,等.RP-HPLC法测定杭白芍及其饮片中芍药内酯苷、芍药苷和苯甲酰芍药苷[J].中草药,2008,39(3):378-380.
[11]张叶萍,黄琴伟,龚 青,等.HPLC测定升血膏中芍药苷的含量[J].中国中药杂志,2008,33(2):200-201.
[12]吕光华,程世琼,陈金泉,等.HPLC测定川芎药材和饮片中游离阿魏酸和总阿魏酸的含量及其质量评价指标[J].中国中药杂志,2010,35(2):194-197.
