盐酸四环素缓释微球对成骨细胞增殖作用的研究
2013-08-27邓媛媛曾富佳
张 珏 邓媛媛 曾富佳
遵义医药高等专科学校,贵州 遵义 563000
四环素及其无抗生素作用的化学异构衍生物 (CMTs)具有特殊的药理活性:抑制基质金属蛋白酶 (MMPs)、抑制骨吸收、恢复成骨细胞结构和功能等[1,2],这些性质在骨科具有潜在临床应用价值。前期研究证实低浓度盐酸四环素,可促进体外培养的人胚成骨细胞活性及增殖,增加和加强细胞合成I型胶原、骨钙素等促进骨生成的物质[3],提示盐酸四环素有较强促成骨潜能。而利用缓释系统控制盐酸四环素在组织中持续稳定的缓慢释放,更能满足骨愈合再生生理学规律的要求。本实验旨在通过对制备的盐酸四环素缓释微球[4]用于成骨细胞增殖作用的研究,确定盐酸四环素缓释微球潜在的应用价值。
1 实验部分
1.1 材料和仪器 3~7d龄健康SD大鼠10只,雌雄不限,体重20~30g(四川大学实验动物中心提供);盐酸四环素缓释微球;胎牛血清 (FBS,美国Gibco);DMEM培养基(美国Gibco);Ⅰ型胶原酶 (美国Sigma);胰蛋白酶 (美国Gibco);二甲亚砜 (DMSO,美国Sigma);MTT(美国Sigma);倒置相差显微镜 (日本Olympus);离心机 (德国eppendorf公司);CO2细胞培养箱 (德国Thermo公司);细胞超净工作台 (德国Thermo);连续光谱测读仪 (美国Bio-Rad)。
1.2 方法和结果
1.2.1 SD大鼠成骨细胞分离培养及鉴定 在无菌条件下剪取10只3~7d龄SD大鼠颅顶骨,用无菌PBS冲洗,并除去骨膜骨缝间结缔组织和血细胞,将颅顶骨剪成约1mmx1mm碎块,加入0.25%胰蛋白酶10ml,37℃条件下消化振荡10 min,弃上清,加入1∶1(V/V)0.25%胰蛋白酶和0.1%Ⅰ型胶原酶的混合酶10ml,37℃消化振荡20 min,并重复消化1次,收集2次消化的消化液,以400G·min-1离心5min。弃上清,加入含10%FBS的DMEM培养基,吹打均匀,进行细胞计数,然后按1x104·cm-2个细胞密度接种于细胞培养瓶中,置于37℃、5%CO2细胞培养箱中。3d后首次换液,以后间隔2天换液。待细胞长满至80%~90%融合后,消化并按1∶2比例传代,倒置相差显微镜下观察成骨细胞的生长情况和形态 (图1),可见成骨细胞贴壁生长,呈长梭形、三角形或多角形。取第2代细胞按1×104·cm-2密度分别接种于有血盖片的6孔培养板中,培养21d,取出血盖片,PBS清洗,行茜素红钙结节染色鉴定 (图2),其结果显示成骨细胞培养21d后有明显的红色钙结节生成。收集第3代细胞进行实验。
1.2.2 实验分组 实验分为二组,A组:空白对照组 (含10%FBS的DMEM培养液);B组:盐酸四环素缓释微球组(含10%FBS和四环素缓释微球的DMEM培养液)。

1.2.3 盐酸四环素缓释微球对成骨细胞生长曲线的影响取生长良好的第3代成骨细胞,制成细胞悬液,镜下计数后,以3X103个细胞/孔接种于24孔板上。用含10%FBS的DMEM培养基进行培养。置于37℃、5%CO2细胞培养箱中培养24小时后,弃去培养液,分别加入实验分组要求的培养液,于培养1d、2d、3d、5d、7d、9d后,每日每组取3孔细胞进行计数,取平均值绘制细胞生长曲线 (图3)。盐酸四环素缓释微球作用于第3代大鼠成骨细胞,细胞计数后绘制生长曲线 (图3)显示:盐酸四环素缓释微球能够促进大鼠成骨细胞持续增殖。

1.2.4 MTT法检测成骨细胞增殖 取生长良好的第3代成骨细胞,以每孔4X103个细胞接种于96孔板上,每孔加入含10%FBS的DMEM培养液200ul,置于37℃、5%CO2细胞培养箱中过夜,弃去培养液,分别加入实验分组要求的培养液,于培养1d、2d、3d、5d、7d、9d后,取实验组细胞各6孔,每孔加入 MTT(5mg·ml-1)20μl,继续培养4h,吸尽上清。加150ul DMSO振荡15min。连续光谱测读仪于490nm处测定吸光度 (A)值,实验重复三次 (表1)。考察盐酸四环素缓释微球对成骨细胞的增殖作用规律。表1结果显示:培养1d后,2组细胞A值无差异。第2、3d时,盐酸四环素缓释微球组A值高于空白对照组,但无显著性差异 (q检验,P>0.05)。第5、7、9d时,盐酸四环素缓释微球组A值明显高于空白对照组,两组间具有统计学显著性差异 (q检验,P<0.01)。
表1 MTT法观察盐酸四环素缓释微球对大鼠成骨细胞的增殖作用 (A值,±s,n=6)
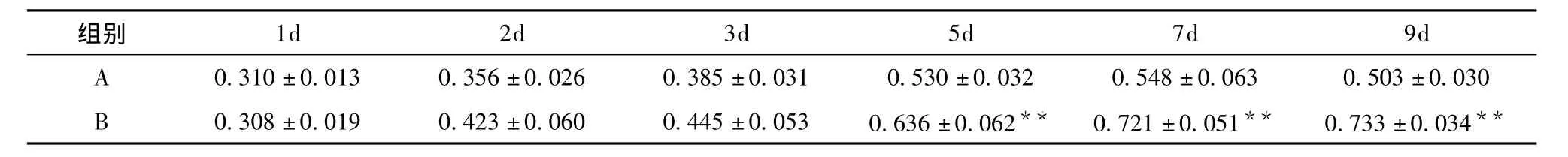
表1 MTT法观察盐酸四环素缓释微球对大鼠成骨细胞的增殖作用 (A值,±s,n=6)
A:空白对照组,B:盐酸四环素缓释微球组。与相同时间点A组比较,**p<0.01
组别1d 2d 3d 5d 7d 9d A 0.310±0.013 0.356±0.026 0.385±0.031 0.530±0.032 0.548±0.063 0.503±0.030 B 0.308±0.019 0.423±0.060 0.445±0.053 0.636±0.062** 0.721±0.051** 0.733±0.034**
2 讨论
四环素的抗菌特性性质用于局部组织中有促进成骨细胞分化和增殖的作用,并有诱导异位成骨的能力[5]。在用复合盐酸四环素的生物衍生骨修复兔桡骨缺损的研究中发现,其血清碱性磷酸酶、骨钙素水平,修复区成骨细胞和胶原纤维的生成均高于没有复合四环素的对照组,而且骨愈合也早于对照组,说明四环素在骨组织再生过程中可能起到重要作用[6]。四环素对成骨细胞的生物学效应研究显示[3]:低浓度四环素可增强成骨细胞的活力,细胞增殖明显加快,细胞的群体倍增时间缩短。四环素促进骨愈合的机制,可能源于初始阶段的抗菌作用;也可能通过抑制胶原酶的活性使骨的形态正常,或通过降低破骨细胞的活性抑制骨吸收,增强成骨细胞的活性刺激胶原的产生,从而促进骨再生[7]。为了避免四环素的突释现象,满足骨愈合再生生理学规律的要求,持续促进骨生长的作用,将盐酸四环素制备成缓释微球可以满足促进骨生长的要求[4]。经研究,盐酸四环素缓释微球能够促进成骨细胞持续增殖比盐酸四环素多5~6天,同时,盐酸四环素缓释微球能显著增加成骨细胞碱性磷酸酶的活性和Ⅰ型胶原的表达[8]。本实验单从细胞增殖的角度研究盐酸四环素缓释微球对成骨细胞的增殖活性,从结果可以看到,盐酸四环素缓释微球对体外培养成骨细胞具有增殖作用,在骨创伤治疗中具有潜在的应用价值。
[1]Golub LM,Goodson JM,Lee HM,et al.Locally and lowdose systemically administered tetracycline inhibitt issue collagenase activity:potential new app roaches in the treatment of periodontal disease [J].J Periodobnrtal Research,1985,20:93-97.
[2]Golub LM,WolfM,Lee HM,et al.Further evidence that Tetracyclines inhibit collagenase activity in human crevicular fluid and from other mammalian source J Periodobnrtal Research,1985,20:12-23.
[3]陈旭,杨志明,解慧琪,等.WO-1对成骨细胞的生物学效应研究[J].中国修复重建外科杂志,2005 19(10):822-825.
[4]李莉,黄永灿,常丽,等.盐酸四环素缓释微球的制备[J].华西药学杂志,2008,23(4):391-393.
[5]康非吾,唐休发,温玉明,等.骨生物衍生材料复合人骨髓间充质干细胞异位成骨的实验研究[J].华西口腔医学杂志,2006,24(4):357-361.
[6]梁军,辛景义,曹红彬.四环素-胶原生物衍生骨缓释材料修复骨缺损[J].中国组织工程研究与临床康复,2008,12(14):2615-2618.
[7]Vernillo AT,Rifkin BR.Effects of tetracyclines on bone metabolism.Adv Dent Res 1998;12(2):56-62.
[8]张珏,陈晓禾,李莉,等.盐酸四环素缓释微球对大鼠成骨细胞活性的影响[J].华西药学杂志,2010,25(1):001-003.
