普伐他汀对酒精性股骨头坏死干预作用的实验研究*
2013-08-24唐毓金
黄 可,唐毓金
(1.桂林医学院研究生学院2010级,广西 桂林 541004;2.右江民族医学院附属医院脊柱骨病外科,广西 百色 533000)
缺血性股骨头坏死分为创伤性和非创伤性,非创伤性股骨头坏死(nontraumatic osteonecrosis of femoral head,NONFH)的主要原因为激素和乙醇诱发多见。国内外对乙醇可引起股骨头坏死报道较多,其发生可能与过量饮酒导致的肝脏细胞损伤、脂质代谢紊乱、血液高凝状态、乙醇所致的骨细胞凋亡及微血管内皮细胞损害有关[1-3]。本研究观察降脂药物普伐他汀,对家兔酒精性股骨头坏死(alcohol-induced osteonecrosis of the femoral head,AOFH)的预防作用,以探索一种对长期饮酒人群有效预防AOFH的方法。
1 材料与方法
1.1 实验动物及材料 健康成年中国家兔30只,体质量1.5~2.0kg(右江民族医学院实验动物中心提供)。采用随机数字表法分为3组。实验组12只,采用灌胃法,给予烈性白酒(乙醇含量50%)10mL·kg-1·d-1,同时给予普伐他汀2mg·kg-1·d-1口服。模型组12只,采用灌胃法,给予烈性白酒(乙醇含量50%)10mL·kg-1·d-1。对照组6只,不予任何处理。各组动物分笼饲养,自由取食、饮水,12周后空气栓塞处死。
1.2 血液学检查 血脂检查:采用日立7600型生化分析仪分别测定血清总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高 密 度 脂 蛋 白 (high-density lipoprotein,HDL)、低密度脂蛋白(low-density lipoprotein,LDL)、极低密度脂蛋白(very low-density lipoprotein,VLDL);血液黏度检查:采用血流变自动检测仪测定血浆黏度、全血高切还原黏度、全血低切还原黏度、红细胞聚集指数、全血高切相对指数、全血低切相对指数、红细胞变形指数、血小板黏附率。
表1 实验前、后各组血脂指标检测结果
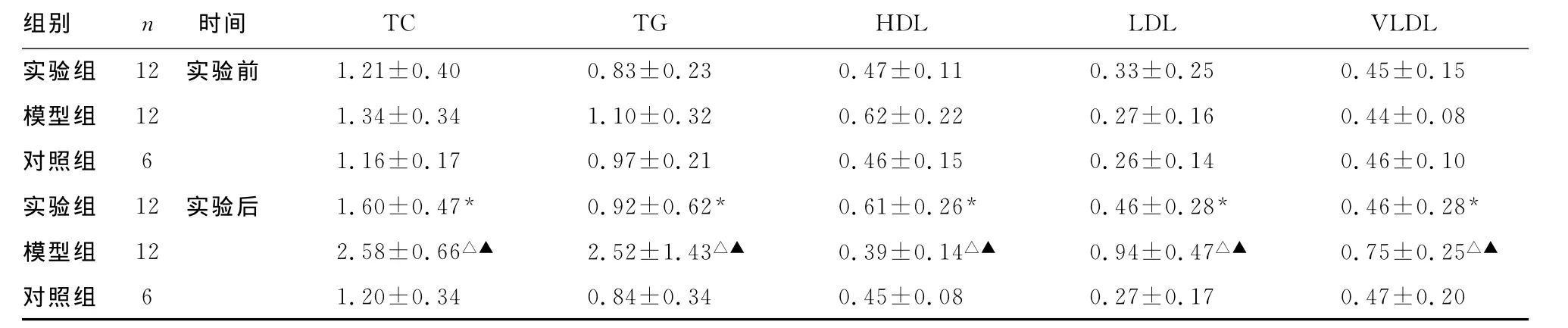
表1 实验前、后各组血脂指标检测结果
*:P<0.05,与同期模型组比较;△:P<0.05,与同期对照组比较;▲:P<0.05,与实验前同组比较。
组别 n 时间TC TG HDL LDL VLDL实验组 12 实验前 1.21±0.40 0.83±0.23 0.47±0.11 0.33±0.25 0.45±0.15模型组 12 1.34±0.34 1.10±0.32 0.62±0.22 0.27±0.16 0.44±0.08对照组 6 1.16±0.17 0.97±0.21 0.46±0.15 0.26±0.14 0.46±0.10实验组 12 实验后 1.60±0.47* 0.92±0.62* 0.61±0.26* 0.46±0.28* 0.46±0.28*模型组 12 2.58±0.66△▲ 2.52±1.43△▲ 0.39±0.14△▲ 0.94±0.47△▲ 0.75±0.25△▲对照组 6 1.20±0.34 0.84±0.34 0.45±0.08 0.27±0.17 0.47±0.20
1.3 组织病理学检查 家兔采用空气栓塞处死,取肝脏标本,置于10%中性甲醛溶液中固定24h,做常规石蜡切片,HE染色观察。取股骨头标本置于10%中性甲醛溶液固定48h,后置于Plank-Rychlo液脱钙2周,常规石蜡包埋,制成厚4μm切片,常规HE染色,置光学显微镜下观察。股骨头坏死发生率计算:根据光学显微镜下HE染色观察,股骨头坏死发生率=各组观察到存在坏死的动物数/本组动物数×100%。
1.4 透射电镜细胞微观察 每组取2只家兔空气栓塞处死,在股骨头软骨下2~3mm处取2mm×2mm×2mm骨块,3%戊二醛4℃环境下固定24h,10%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)4℃环境下脱钙8周,1%锇酸后固定,常规包埋切片,醋酸铀和柠檬酸铅染色,透射电镜观察。
1.5 统计学处理 应用SPSS17.0软件进行统计学数据处理,计量资料以表示,单组样本前、后比较采用配对样本t检验,试验后样本比较采用方差分析,股骨头坏死发生率的比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
试验中因误吸及肺部感染致实验组家兔死亡1只。
2.1 血脂成分分析结果 实验组TC、TG、HDL、LDL、VLDL改变差异无统计学意义(P>0.05);模型组TC、LDL较实验前明显升高(P<0.05)、HDL较实验前明显降低(P<0.05)、TG、VLDL较实验前升高(P<0.05);对照组各项指标与实验组比较,差异无统计学意义(P>0.05)。实验组 TC、TG、HDL、LDL、VLDL与模型组比较,差异有统计学意义(P<0.05),见表1。
2.2 血液流变学分析结果 实验结束后,实验组全血高切还原黏度、全血高切相对指数及全血低切相对指数较实验前升高(P<0.05)。模型组血浆黏度、全血高切还原黏度、全血低切还原黏度、红细胞聚集指数、血小板黏附率、全血低切相对指数较实验前升高(P<0.05)。模型组血浆黏度、全血高切还原黏度、全血低切还原黏度及红细胞聚集指数与实验组和对照组比较,差异有统计学意义(P<0.05),见表2。
2.3 组织病理学观察
2.3.1 肝脏 光学显微镜下模型组家兔肝细胞见明显的脂肪颗粒,在肝细胞内聚集成气球样变性,部分肝细胞发生凝固性坏死,周围炎性细胞浸润。实验组见肝细胞轻度水肿。对照组未见明显的病理学改变。
2.3.2 股骨头 肉眼见模型组家兔股骨头表面失去光泽,未见软骨凹陷及明显的坏死改变,实验组和对照组形态无变化。光学显微镜下,模型组骨髓细胞可见明显凝固性坏死,髓内骨髓细胞减少,脂肪组织增多,脂肪细胞肥大,骨小梁钙质脱失、疏松,部分骨小梁崩裂,空骨陷窝增多;实验组镜下病理改变较模型组轻微;对照组未见镜下改变(图1)。
2.3.3 骨细胞 模型组透射电镜下观察家兔骨细胞细胞膜结构消失,胞质内细胞器溶解,细胞核膜不清、核固缩,仅留下细胞轮廓;实验组骨细胞微观改变不明显,与对照组比较基本无变化(图2)。
2.3.4 股骨头坏死发生率 实验组、模型组及对照组股骨头坏死发生率分别为9.1%(1/11)、83.3%(10/12)和0(0/6)。模型组与实验组、对照组比较,差异有统计学意义(P<0.05)。

图1 光学显微镜下家兔股骨头组织(×200)

图2 透射电镜下3组家兔骨细胞(×15 000)
表2 3组家兔实验前、后血液流变学检测结果

表2 3组家兔实验前、后血液流变学检测结果
*:P<0.05,与同期模型组比较;△:P<0.05,与同期对照组比较;▲:P<0.05,与实验前同组比较。
组别 n 时间 血浆黏度(mPa.s)全血高切还原黏度(mPa.s)全血低切还原黏度(mPa.s)红细胞聚集指数全血高切相对指数全血低切相对指数红细胞变形指数血小板黏附率(%)实验组 12 实验前 1.26±0.13 5.04±1.08 32.96±10.46 4.54±0.60 2.24±0.28 10.09±1.29 0.81±0.15 36.67±0.59模型组 12 1.25±0.12 5.53±1.18 31.09±4.83 4.00±0.29 2.92±0.58 11.65±2.38 0.80±0.09 36.13±0.29对照组 6 1.26±0.11 4.98±0.90 29.93±1.99 4.12±0.13 2.73±0.64 11.25±2.68 0.76±0.06 36.25±0.13实验组 12 实验后 1.26±0.05* 6.07±0.59*▲△ 41.72±3.84*▲△ 4.66±0.24*△ 2.67±0.26▲ 12.47±1.56*▲ 0.87±0.04△ 36.79±0.24△模型组 12 1.43±0.13▲△ 6.84±0.41▲△ 47.58±4.04▲△ 5.07±0.36▲△ 3.00±0.40 14.82±2.34▲△ 0.86±0.05△ 37.07±0.44▲△对照组 6 1.24±0.15 5.36±0.37 29.81±1.33 3.98±0.17 2.93±0.39 11.68±1.62 0.79±0.09 36.11±0.17
3 讨 论
3.1 普伐他汀可以防止乙醇引起的股骨头坏死 酒精性股骨头坏死的发生机制尚不清楚,研究认为是由多种因素综合作用的结果。乙醇可导致高脂血症、脂肪肝和脂质代谢紊乱,股骨头髓内脂肪细胞肥大,骨细胞凋亡[4-6]。本研究发现,模型组家兔TC、TG、LDL较实验前明显升高、HDL较实验前明显降低,VLDL较实验前升高。对照组并无上述改变。此结果与相关学者关于酒精性股骨头坏死,脂代谢紊乱的结果相似[7-8]。另外,病理检查发现模型组有83%(10/12)的家兔发生了不同程度的骨小梁塌陷、崩解、骨细胞死亡等,而同期实验组、对照组比较差异有统计学意义(P<0.05)。说明降脂药普伐他汀对乙醇所致股骨头坏死的发生有预防作用。
3.2 普伐他汀能抑制血小板聚集,防止骨坏死 长期饮酒可出现血液高凝状态、血栓形成,导致骨髓腔内血流减少,引起缺血、坏死。帅波等[9]研究发现,NONFH患者血小板颗粒数量及血小板表面膜糖蛋白GPⅡb/Ⅲa(PAC-1)活化率明显增高。这些物质在介导血小板活化及血栓形成的过程中起重要作用[10]。本研究发现,给予家兔高浓度乙醇灌胃3个月后,其血浆黏度、全血高切还原黏度、全血低切还原黏度、血小板黏附率、红细胞聚集指数明显增加,与实验前比较差异有统计学意义(P<0.05)。说明大量活化的血小板刺激血液高凝状态产生,最终导致血栓形成,引起骨缺血、骨坏死[11]。实验组的家兔预防性口服普伐他汀片,发现其血小板黏附率、红细胞聚集指数、血浆黏度、全血高切还原黏度、全血低切还原黏度稍有升高,但与实验前比较差异有统计学意义。说明普伐他汀可抑制乙醇引起的血小板活化,从而抑制血小板聚集及血栓形成,防止骨坏死。
3.3 普伐他汀可防止乙醇对骨细胞的损害 乙醇对骨组织的毒性作用可直接引起股骨头坏死[12-13]。有研究发现,缺血性股骨头坏死的血管再生和新骨形成的能力明显减弱。乙醇可刺激股骨头局部血管内皮生长因子、碱性成纤维细胞生长因子、骨形态发生蛋白mRNA表达降低,引起股骨头坏死[14]。王维军等[15]研究认为,大量饮酒后可见股骨头内骨细胞减少、骨髓间充质干细胞增殖活性降低及分化方向改变,骨化减少,导致骨坏死。本研究发现,光学显微镜下模型组骨小梁钙质明显脱失、稀疏,部分骨小梁崩解,骨髓内骨细胞密度显著降低,髓内脂肪细胞明显增多。透射电镜下观察见模型组动物骨细胞膜结构消失,胞质内细胞器溶解,细胞核膜不清、核固缩,仅留下细胞轮廓。对照组并无上述改变。说明乙醇可刺激骨细胞凋亡,引起股骨头坏死。同期实验组骨细胞并无明显改变。说明普伐他汀能够在一定程度上预防乙醇引起的骨细胞凋亡、坏死,防止股骨头坏死。
综上所述,本研究采用普伐他汀可有效预防乙醇引起的家兔高脂血症、降低血小板活化及红细胞聚集,防止小血管栓塞,防止乙醇引起的骨细胞凋亡,对酒精性股骨头坏死的发生有一定的预防作用。
[1] Shapiro F,Connolly S,Zurakowski D,et al.Femoral head deformation and repair following induction of ischemic necrosis:a histologic and magnetic resonance imaging study in the piglet[J].J Bone Joint Surg Am,2009,91(12):2903-2914.
[2] 王少华,王义生,李月白.siRNA腺病毒载体预防兔酒精性股骨头坏死的动物实验研究[J].中国骨与关节外科,2010,3(1):62-67.
[3] 王大伟,史宝明,张爽.构建酒精性股骨头坏死动物模型理论依据及造模方法[J].中国组织工程研究与临床康复,2010,14(50):9413-9416.
[4] Wang Y,Yin L,Li Y,et al.Preventive effects of puerarin on alcohol-induced osteonecrosis[J].Clin Orthop Relat Res,2008,466(5):1059-1067.
[5] 孙伟,王佰亮,李子荣,等.酒精性股骨头坏死股骨干骺端骨髓间质干细胞细胞周期的变化[J].中国组织工程研究与临床康复,2008,12(3):469-472.
[6] Suh KT,Kim SW,Roh HL,et al.Decreased osteogenic differentiation of mesenchymal stem cells in alcohol-induced osteonecrosis[J].Clin Orthop Relat Res,2005(431):220-225.
[7] 石少辉,李子荣,孙伟,等.酒精性和激素性股骨头坏死的发病与脂质代谢[J].中国组织工程研究与临床康复,2011,15(17):3217-3220.
[8] Glueck CJ,Freiberg RA,Boppana S,et al.Thrombophilia,hypofibrinolysis,the eNOST-786Cpolymorphism,and multifocal osteonecrosis[J].Bone Joint Surg Am,2008,90(10):2220-2229.
[9] 帅波,沈霖,杨艳萍,等.股骨头缺血性坏死患者血小板微颗粒及血小板膜糖蛋白GPⅡb/Ⅲa、P选择素表达的相关性研究[J].中国矫形外科杂志,2010,18(13):1107-1110.
[10]Kang P,Shen B,Yang J,et al.Circulating platelet-derived microparticles may be a potential cause of microthrombosis in patients with osteonecrosis of the femoral head[J].Thromb Res,2008,123(2):367-373.
[11]Jones JP.Alcoholism,hypercortisonism,fat embolism and osseous avascular necrosis[J].Clin Orthop Relat Res,2001(393):4-12.
[12]Calder JD,Buttery L,Revell PA,et al.Apoptosis--a significant cause of bone cell death in osteonecrosis of the femoral head[J].J Bone Joint Surg Br,2004,86(8):1209-1213.
[13]Segin C,Kassis J,Busque L,et al.Non-traumatic necosis of bone osteonecrosis is associated with endothelial cellactivation but not thrombophilia[J].Rheumatology,2008,47(6):1151-1155.
[14]Gong Z,Wenzeman FH.Inhibitory effect of alcohol on osteogenic differentiation in human bone marrow-derived messenchymal stem cells[J].Alcolhol Clin Exp Res,2004,28(3):468-479.
[15]王维军,李嗣生,牛东生,等.股骨头缺血性坏死骨质含量与 VEGF、bFGF、BMP-2mRNA表达的相关性研究[J].中国修复重建外科杂志,2011,25(8):984-991.
