一个值得高度关注的问题——动物源细菌耐药性
2013-08-24宁宜宝张纯萍曲志娜
宁宜宝,宋 立,张纯萍,曲志娜
(1.中国兽医药品监察所,北京 100081;2.中国动物卫生与流行病学中心,山东青岛 266032)
抗菌药物的发明和应用是20世纪医药领域最伟大的成就,为防控动物细菌传染性疾病,这类抗菌药物的使用越来越普遍。目前,兽医临床上常用的抗菌药物有近百种[1]。抗菌药物在畜禽养殖上大量应用,虽然对治疗和预防动物疾病、促进生长、提高畜牧业产量起到了积极作用,但由于药物的大量、长时间使用,一些细菌为了逃避抗生素作用,通过改变自身的结构和功能逃避药物的杀灭作用而获得了生存,由此便出现了具有生存选择优势的耐药菌[2]。动物细菌耐药性的日益增强与流行,不仅加大了畜禽疫病的防控难度,也给畜牧业养殖造成了巨大损失;而且动物源耐药菌还可通过食物链感染人体或将耐药基因转移至人体病原菌而引发疾病,对人类健康构成潜在危害。近年来,动物源细菌耐药性危害引起了全世界的广泛关注,其风险与控制已成为国内外关注的焦点和研究热点。
1 动物源细菌耐药性的危害
1.1 对人类健康和公共卫生的影响
非人用药导致的公共卫生安全和人类健康已日益受到国际社会的广泛关注。研究表明,非人类抗菌药物的使用量和种类影响动物和食品中耐药菌株的产生,使人类暴露于耐药菌株。据报道[3],人类暴发的Salmonella typhimurium DT104感染都可追踪到动物上,其耐药特点与动物用药背景相符。Kassenborg等在研究氟喹诺酮类耐药弯曲杆菌感染病例时发现,感染者多曾食用鸡肉或火鸡肉。Fey等报道了1例由牛传给人的头孢曲松耐药沙门氏菌感染的病例。中国台湾Chiu采用分子分型方法发现人源氟喹诺酮类耐药猪霍乱沙门氏菌来源于猪。Donabedian在研究庆大霉素高度耐药肠球菌时发现1株人源耐药肠球菌与1株市售鸡肉分离菌的PFGE图谱完全一致。Juhsz-Kaszanyitzky采用分子分型方法首次发现一牛场饲养员分离的MRSA与牛源MRSA的PFGE图谱完全一致,说明动物和人之间发生了耐药菌株的克隆传播。
事实证明,致病菌耐药性的发生和蔓延已构成对人类健康的严重威胁。据统计,50%以上动物源性病原体可以传播并致人感染发病,由此可见,动物源耐药菌,特别是人畜共患病细菌,如结核杆菌、布氏杆菌、沙门氏菌、葡萄球菌等细菌的耐药将会严重威胁到人类健康[4]。为此,WHO发出警告:“新生的、能抵抗所有药物的超级细菌,将把人类带回感染性疾病肆意横行的年代”。
1.2 对动物疾病防治的影响
抗菌药物在畜牧业中广泛滥用的现象十分普遍,WHO称全世界约有50%抗生素用于畜牧业养殖,并且囊括了人类自身使用抗生素的全部种类。据统计,欧洲抗生素总产量的52%用于人类治疗,48%用于动物;美国抗生素总产量中只有9%用于人类自身,6%用于动物治疗,85%用于非治疗目的,其中大多数以亚治疗剂量添加在食品动物饲料中为达到预防疾病或促生长目的来使用[5]。
我国畜牧业生产中兽药使用情况更为严重。目前我国兽药厂接近1700家,已远远超过人药生产厂家数量,且兽药产量仍在不断的增长。由于饲养水平低,饲养数量大,动物疾病多,养殖人员过分依赖药物来控制疾病,同时药物添加到饲料中用于疾病预防和促生长的现象也十分普遍。由此导致了大量耐药菌株的产生,使得药物疗效大大降低或者没有效果,如恩诺沙星1994年刚在我国上市时,一般用0.0025%~0.005%饮水治疗鸡的消化系统和呼吸系统疾病,效果相当好,现在即使用至0.01%~0.02%效果也不明显,致使药物防治动物疾病的难度日趋加大,发病率和病死率明显提高,进而也导致部分养殖者盲目增加药物使用品种和剂量,特别是在饲料中大量加入抗生素,一方面使得养殖成本加大,另一方面导致动物源细菌耐药性问题更为突出和严重。
2 我国动物源细菌的耐药状况
早在20世纪末,我国许多科研院所开始对动物源细菌耐药性进行系统研究,2008年农业部启动了动物源细菌耐药性监测计划,深入了解不同地区和不同动物体内分离的大肠杆菌、沙门氏菌、金黄色葡萄球菌等的耐药情况,综合分析其耐药性发展呈现以下几大特点:
2.1 细菌对抗菌药物的耐药性随时间推移而增强
从药物品种上看,随着临床上新药的投入使用,细菌耐药谱变宽。上世纪60~80年从畜禽体内分离的大肠杆菌菌株仅对链霉素、四环素类耐药;90年代的分离株对青霉素类、氨基糖甙类和磺胺类也出现耐药;而2000年后分离菌株耐药谱继续加大,对氟喹诺酮类、氟苯尼考等药物也产生了明显耐药性。从耐药程度上讲,随着时间推移,细菌耐药程度日趋严重。上世纪60~80年代分离菌株对链霉素、四环素的体外最低抑菌浓度(MIC)在128μg/mL,90年代则上升至256μg/mL以上;90年代分离的大肠杆菌对氟喹诺酮类敏感,MIC值在0.05~1.6μg/mL之间,而2001年以后其MIC值在64μg/mL以上。
2.2 不同种类的细菌对抗菌药物的耐药性不同
2000年后分离的大肠杆菌菌株对萘啶酸、氨苄西林、阿莫西林、四环素、磺胺和复方新诺明高度耐药,耐药率大于75%;对氟喹诺酮类、氯霉素、庆大霉素和卡那霉素中度耐药,耐药率在30%~75%之间,而对氟苯尼考、奥格门丁(阿莫西林和克拉维酸)、头孢曲松、头孢噻吩、阿米卡星耐药率较低,尤其是头孢曲松和阿米卡星的耐药率为0。而2001年分离的沙门氏菌耐药率明显低得多,除了对萘啶酸和四环素存在一定的耐药性以外,对其他抗生素均敏感。猪链球菌、葡萄球菌对抗生素的耐药率也存在明显差异[6]。
2.3 不同地区分离菌对抗菌药物的耐药性不同
2002年在我国北方、中部和南方3个地区分离的鸡大肠杆菌进行耐药性检测,广东和江西地区分离株的耐药性相对较高,而辽宁地区的分离株的耐药性相对要低一些[7]。鸡沙门氏菌耐药情况同样如此,广东分离株的耐药性最高,其次是江西地区分离株,辽宁地区的分离株的耐药性最低。这可能是由于我国南方地区夏天潮湿炎热,冬天潮湿寒冷,鸡群容易发生细菌性疾病,用药相对来说要多一些,而我国北方地区由于气候干燥一些,细菌性疾病也相对少,用药也少一些,从而导致不同地区细菌耐药性存在差异。
2.4 不同动物体内细菌分离株的耐药性不同
通过对我国部分地区猪场和禽场分离的大肠杆菌的耐药率比较分析发现,猪源大肠杆菌的耐药程度在部分药物种类上明显低于禽源大肠杆菌,同时对同种药物的耐药程度也均明显低于鸡体内的大肠杆菌(图1)。
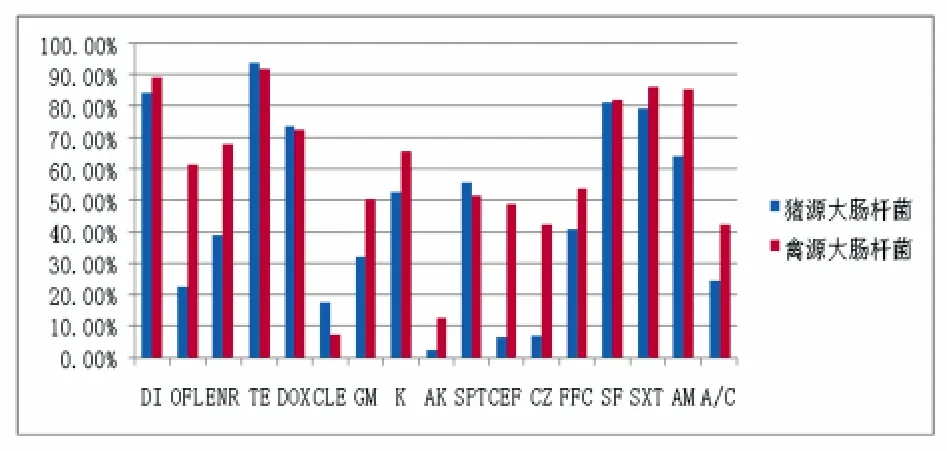
图1 猪禽源大肠杆菌耐药情况比较
2.5 多重耐药现象日趋严重
历史菌株耐药谱简单,多重耐药现象少见。目前分离的菌株耐药谱很广,多重耐药、交叉耐药现象严重。图2显示,禽源大肠杆菌多重耐药整体呈现上升趋势,2010年多重耐药菌株主要集中在8耐~10耐之间,9耐最多;2011年多重耐药菌株主要集中在9耐~12耐之间,10耐最多;到2012年,则已升至11耐~12耐之间,12耐最多,所占比例高达55.38%。
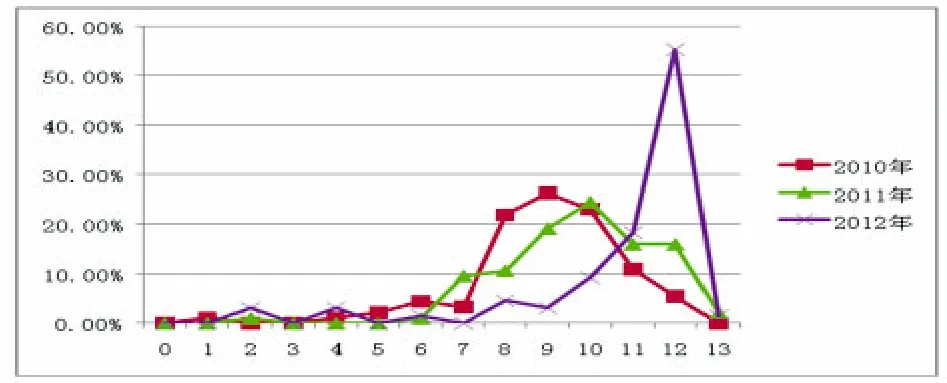
图2 2010~2012年部分地区禽源大肠杆菌分离菌株多重耐药比较
3 国际组织及发达国家的应对策略
3.1 国际组织导则
考虑到细菌耐药性是一个全球性的公共卫生问题,为了防止由于滥用抗生素导致动物源细菌对人用抗生素产生耐药,WHO/OIE/FAO等国际组织联合规定,禁止将用于人类疾病治疗的药物用于动物,并由WHO和OIE分别列出一个对人和动物至关重要的抗生素清单,同时提出和审议了8个方面的工作内容,为各国控制细菌耐药性提供参考。具体包括:(1)建立非人用抗菌药物使用的国家监控计划;(2)建立食品和动物中耐药细菌的国家监测计划;(3)防止耐药菌通过食物链从动物到人体扩散的实施措施;(4)WHO遏制动物源食品中细菌耐药性发生的全球实施准则和OIE负责、谨慎使用抗菌药物的指南;(5)防止对人极为重要的抗菌药物细菌耐药性出现和扩散的实施、管理策略;(6)实施风险评估方法需要风险管理的支持;(7)加强各国监测耐药性的能力,特别是发展中国家,实施遏制细菌耐药性的策略、风险评估和风险管理方法;(8)全球层面上耐药性的风险管理。
OIE的《陆生动物卫生法典》也对抗药性进行了相应的规定:2003年版的《陆生动物卫生法典》规定了兽用抗菌药物监控体系和正确使用兽用抗菌药物的标准和指南。2007年修订的《陆生动物卫生法典》还专设第3.9章为“抗菌药物耐药性”,提出了兽用抗菌药物耐药性监测计划的指导原则[8],并规定各成员国应对耐药性采取主动监测及监控。
3.2 发达国家的做法
3.2.1 美国。1999年,在美国卫生和人类服务部(HHS)的牵头下,由10个联邦局和部组成了一个处理抗微生物药耐药的特别工作组。由美国疾病控制中心、FDA和国立卫生研究院共同主持。
3.2.1.1 建立国家抗菌药物耐药监测系统。美国于1996年成立了国家抗微生物药耐药监测系统(NARMS)。它是在FDA的兽药中心、美国农业部和疾病控制中心合作下成立的。开始的任务是监测17种抗微生物药对人、畜肠道细菌敏感性的变化。后来,抗菌药物的品种和细菌分离株的数量和供应样品的部门都有所扩大。
NARMS的项目分两部分:畜类组和人类组。人类组细菌分离株样品由美国17个州及地方卫生部门提供,由乔治亚州亚特兰大市的国家传染病中心检验。畜类组的肠道分离株的敏感性由位于乔治亚州亚特兰大市的农业研究服务社的Russell研究中心检验。目前提供菌株样品的部门已经扩大。
每年的工作由CDC/NCID和USDA/ARS提供年度NARMS总结报告。另外,定期召开公众会议,报告NARMS监测结果,并为其它抗菌药物耐药性研究提供讲台。
3.2.1.2 畜、禽用药的管理。为减少由于禽牧业使用抗菌药物,导致人用抗菌药物的耐药,FDA正在采取措施,主要是FDA的肉禽、肉禽用抗菌药物的管理办法。要达到的目标为:(1)保证肉禽使用抗菌药物不干扰或不丧失人用抗菌药物的疗效。(2)为肉禽安全使用抗微生物药做准备,因为这类药对肉类生产和保证食品供应安全是有价值的。为此,FDA的兽药中心提出肉禽用药的管理办法。并根据反馈的意见,起草指南,帮助厂家执行。
3.2.2 欧盟。欧盟在动物用药管理比美国更严格,在饲料中不准加入抗菌药物,出售药物只用于发病动物治疗,不准在没有疾病时通过饮水或饲料群体给药,人用药一律不用于动物,严格处方用药。欧盟内大多数国家都有从事动物源细菌耐药性监测的机构,负责国家细菌耐药性监测计划和全面的流行性调查,每年有重点选择以两种细菌有针对性对几种关注的药物进行跟踪调查;如德国除了进行常态的动物源细菌耐药性检测外,还专门设立机构针对临床分离的动物源致病菌进行耐药性检测。
4 对我国控制动物源细菌耐药性的工作启示
细菌耐药性问题目前越来越引起国际社会的高度重视和广泛关注,我国是兽药生产和使用大国,为了减少和克服细菌产生耐药对公共卫生、动物健康和食品安全带来的严重危害,国家高度重视,已着手制定兽药的使用管理办法,建立了动物源细菌监测网,启动了细菌耐药性检测,开展了相关研究。总体来讲,首先的任务是加强宣传,提高认识;其次是强化监管,规范用药;第三是开展监测,及时、全面掌握我国食源动物细菌耐药状况;第四是加强国内外合作交流,提高防控水平;第五是加大投入,开展相关研究。
4.1 加强兽药的管理与应用
WHO、OIE和FAO多年来一直强调加强动物用药的科学管理,严格处方用药,严格将人用药和动物用药分开,并逐渐减少动物用药。根据我国目前动物源细菌严重耐药的情况,作为一个负责任的兽药生产和使用大国,要扭转和改善目前我国动物源细菌严重耐药的局面,我国政府主管部门要加强动物药品审批、生产和使用上的监督管理,把处方与非处方用药分开,把人用药和动物用药分开,建立动物抗菌药物清单,严格加强动物疾病治疗用药和饲料药物添加剂的管理,指导养殖人员严格科学、合理规范的使用兽药。
4.2 强化动物源细菌耐药性监测
由于动物源细菌耐药性与食品安全、公共卫生安全和动物疾病防控有着非常密切的关系,加强动物源细菌耐药性监测对减少细菌耐药性的产生和蔓延十分重要,因此,应从三个方面强化这项工作。一是兽药审批部门在审批新兽药注册和临床使用时,要按照WHO、FAO和OIE的指南,参考发达国家的做法,针对我国实际情况,对新批准使用的各种药物进行包括耐药性在内的安全评价,做好新药耐药性的临床监测;二是在已有国家耐药性监测计划的基础上,继续拓展监测范围和监测种类,深入开展推动耐药性监测工作;三是推动养殖企业自我监测,依据实验结果决定用药种类和剂量,特别是新投放市场的药物,要作跟踪监测,及时了解细菌对药物的耐药性产生情况。
4.3 加强新兽药尤其是动物专用药的研究
近些年来,由于耐药性细菌,特别是超级细菌的出现,动物的药物治疗的有效性受到越来越大的挑战性,高效安全新兽药,特别是动物专用新兽药的研制已成为越来越急迫的问题。化学合成药仍是当前的主导药物,研究出高效、低毒、不易产生耐药和交叉耐药的新兽药是当前十分迫切的任务;另外,作为植物类药物的生产和使用大国,中兽药以其残留低、不易产生耐药性、易获得等优点,在我国有着良好的开发和应用前景,应该加大研究和开发力度。
4.4 深入开展细菌耐药机制研究
尽管导致细菌耐药性产生的原因很多,但总的来说是由细菌和抗菌药物两大因素决定的。如何减轻细菌耐药,提高药物疗效是我们研究细菌耐药机理的主要方向。通过揭示细菌耐药机理,可以指导我们在新药的研究上趋利除弊,研究出对细菌更为有效的药物。
动物源细菌耐药性问题已成为影响人类健康和食品安全的全球性问题,世界卫生组织向全人类发出了“齐心协力减少食品中抗生素使用”的呼吁。“食品中耐药性细菌的危险性”早已成为世界食品法典大会(CAC)的重要议题,说明耐药性细菌作为重要的食品污染在食品的国际贸易中也已经受到重视。欧盟等发达国家正在制定相关的法规和方法,要在进口食品中进行耐药细菌的检测。以往人们认为“无疾病、无污染、无残留”即为安全畜产品的概念中,将增加“无耐药菌”的新观念。相信有政府的重视,随着科技进步和全社会公共卫生意识的普遍提高,人类会有效应对动物源细菌耐药性的挑战,并达到保护人类抗生素医疗资源的预期目标。
[1]马苏,高艳春. 动物源细菌耐药性对动物传染性疾病防治的影响[J]. 中国兽药杂志,2012,46(2):50-52,56.
[2]Lindgren P K,Karlsson A,Hughes D. Mutation rate and evolution of fluoroquinolone resistance in Escherichia coli isolates from patients with urinary tract infections[J].Antimicrobial Agents and Chemotherapy,2003,47(10):3222-3232.
[3]陈杖榴,刘健华. 食品动物源细菌耐药性与公共卫生[J].兽医导刊,2007(9):45-46.
[4]Akiba T,Koyama K,Ishiki Y,et al. On the mechanism of the development of multiple-drug-resistant clones of Shigella[J].Japanese Journal of Microbiology,1960,4:219-227.
[5]高光. 畜禽食源性细菌耐药性与食品安全、现状及对策[J]. 中国禽业导刊,2003,20(4):12-15.
[6]Zhang C P,Ning Y,Zhang Z Q,et al. In vitro antimicrobial susceptibility of streptococcussuis strains isolated from clinically health sows in China[J]. Veterinary Microbiology,2008,131(3/4):286-392.
[7]宋立,宁宜宝. 中国不同地区家禽大肠杆菌血清型分布和耐药性比较研究[J]. 中国农业科学,2005(7):1466-1473.
[8]黄秀梅,赵思俊,曲志娜,等. 兽用抗菌药物耐药性监测计划的指导原则[J]. 中国动物检疫,2011,28(12):48-49.
