青海部分地区藏獒细小病毒感染的流行病学调查
2013-08-24张红见铁忠华钟耀安沈得贵
张红见,铁忠华,赵 静,钟耀安,沈得贵
(1. 青海大学农牧学院,青海西宁 810016;2. 青海畜牧兽医职业技术学院,青海湟源 812100;3. 青海省动物疫病预防控制中心,青海西宁 810001)
犬细小病毒感染(Canine Parvovirus Infection,CPI)是由犬细小病毒(Canine Parvovirus,CPV)引起犬的一种以剧烈呕吐、出血性肠炎、血性水样便、脱水、白细胞显著减少和心肌炎为特征的急性传染病,幼龄犬多发[1],且纯种犬发病率比杂种犬、土种犬高。CPV首先由美国学者Eugster和Nairn于20世纪70年代从患出血性肠炎的犬粪便中分离获得[2]。1982 年梁士哲在我国首次分离到该病毒,随后各地均有大量报道[3-4]。作为当今世界大型犬原始祖先的藏獒是当今犬类中唯一没有被时间和环境因素所改变的活化石,其基因库中汇聚了世界犬种最优良的性状和性能基因,属国家二级保护动物[5]。根据青海省农牧业综合区划所1995年的调查统计,全省有藏獒9万多只,而纯种藏獒仅为600多只,且其种群品质退化极为严重,处于濒临灭绝的地步。随着国内外藏獒协会影响力的逐年增大,特别是自2007年以来藏獒热的持续升温,纯种藏獒已被卖到千万天价。而内地藏獒数量的锐减、品种劣化以及各种疫病的侵袭,许多藏獒贩卖者又把目标转向青海省的玉树、果洛等地。加之2010年玉树地震中许多藏獒因地震死亡或变成流浪獒被扑杀,使这里的藏獒资源遭到灭顶之灾。为了初步摸清CPV在青藏高原部分地区藏獒中的流行现状,为以后有效防控藏獒CPV积淀流行病学资料和保护其种群繁衍提供理论依据,进一步为探索青藏高原的奥秘,探寻生存于世界屋脊的动物适应环境的方式与能力,为全面开展对青藏高原生物多样性保护奠定研究基础。2011年10月至2012年5月,选择较为快速的CPV-ELISA诊断试剂盒和CPV检测试纸条对青海省部分地区藏獒血清与粪便样品进行了血清学与病原检测,现将结果报告如下。
1 材料与方法
1.1 材料
1.1.1 待检血清和粪便来源 随机选取青海省河南县、祁连县、西宁市加旺宠物医院和陶北村獒园的藏獒进行前肢静脉采血,带回实验室后常规方法分离血清,置-20℃冰箱内保存备用。同时用灭菌棉拭子在藏獒直肠深部采取粪便,应用犬细小病毒检测试纸条进行现场CPV的检测。
1.1.2 ELISA检测试剂盒与犬细小病毒检测试纸条 犬细小病毒诊断试剂盒(ELISA),购自上海研招生物技术有限公司(生产批号:20120525)。犬细小病毒检测试纸条,购自上海快灵生物科技有限公司(生产批号:110506)。
1.2 方法
1.2.1 细小病毒(CPV)酶联免疫分析(ELISA)每管加入灭菌生理盐水2mL,在MM-1型微型振荡器上振荡,每支试管振荡15min/次,连续3次。
1.2.1.1 加样 分别在阴、阳性对照孔中加入阴性对照、阳性对照各50μL,然后依次在待测样品孔中加入样品稀释液各40μL,最后再分别加入待测血清各10μL。加样时将样品加入酶标板的孔底部,尽量不触及孔壁,轻轻晃动混匀。
1.2.1.2 温育 用封板膜封板,置37℃温箱温育30min。
1.2.1.3 配液 将30(48T的20倍)倍浓缩的洗涤液加入蒸馏水配制600mL后备用。
1.2.1.4 洗涤 小心揭开封板膜,弃去液体,甩干,每孔加满洗涤液,静置30s后弃去,如此重复5次,拍干。
1.2.1.5 加酶 每孔各加入酶标试剂50μL,空白孔除外。温育(操作同1.2.1.2),洗涤(操作同1.2.1.4)。
1.2.1.6 显色 每孔依次加入显色剂A 和显色剂B各50μL,轻轻震荡混匀,37℃避光显色15min。
1.2.1.7 终止 每孔各加入终止液50μL,终止反应(此时蓝色立即变成黄色)。
1.2.1.8 测定 将空白孔调零,450nm波长依序测量各吸收孔的吸光度(OD值)。测定应在加入终止液后的15min之内进行。
1.2.2 犬细小病毒试纸条检测
1.2.2.1 用灭菌的棉拭子收集藏獒粪便,然后将棉拭子插入含有1mL样品处理液的样品管中,搅动均匀并静置10min,待粪便沉淀于底部后再取样品上清液进行CPV的检测。
1.2.2.2 在犬细小病毒试纸条的加样孔中加入2滴经上述处理的粪便样品,5min后观察结果。
1.2.3 结果判定
1.2.3.1 犬细小病毒(CPV)酶联免疫分析(ELISA) 阳性对照孔平均值≥1.00、阴性对照孔平均值≤0.10时判定试验有效。临界值(CUT OFF) =阴性对照孔平均值+0.15。样品OD值<临界值(CUT OFF)者为犬细小病毒(CPV)抗体阴性,样品OD值≥临界值(CUT OFF)者为犬细小病毒(CPV)抗体阳性。
1.2.3.2 犬细小病毒(CPV)试纸条检测 只有一条线(质控“C”线)出现判定为阴性,出现两条线(“C”和“T”线)判定为阳性,无质控线出现判定为无效。
2 结果
2.1 犬细小病毒(CPV)酶联免疫分析(ELISA)
应用CPV ELISA试剂盒对青海部分地区的60份藏獒血清进行ELISA检测,共检出阳性粪便6份,阳性率为10.00%(6/60),与CPV试纸条检测的阳性符合率为83.33%。在ELISA酶标板上的A1和A2号为样性对照孔;A5和A6号为阴性对照孔;A9为空白孔。下划线数字表示60份待检血清样品中CPV阳性血清的对应OD值。经测定,临界值(CUT OFF)=0.056+0.15=0.206;阳性对照孔平均值=2.581;阴性对照孔平均值=0.056。详细结果见表1、表2。
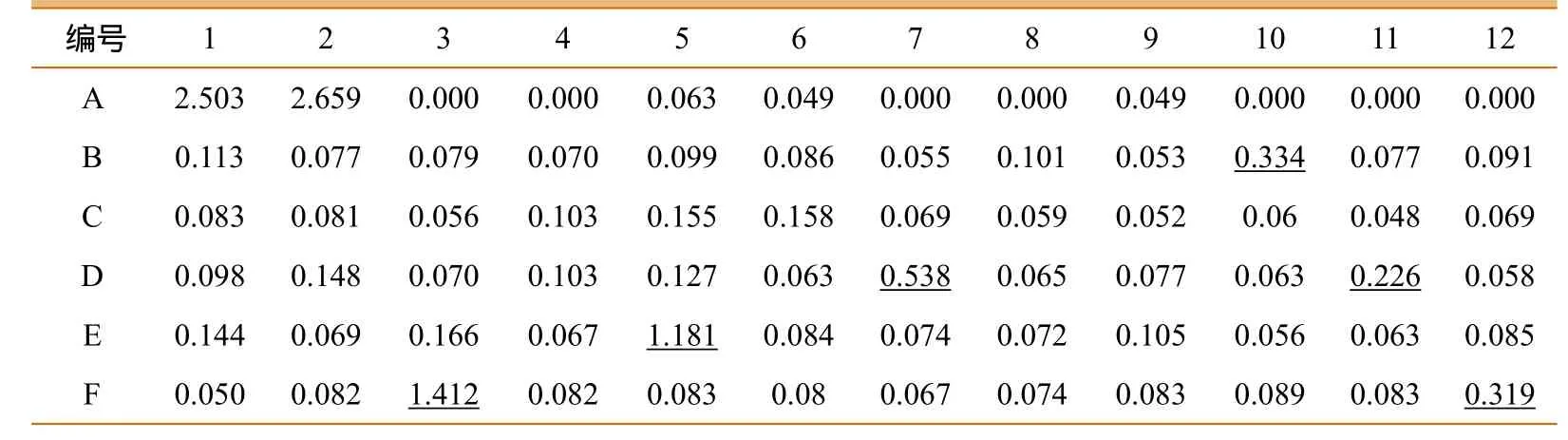
表1 青海省部分地区犬细小病毒的ELISA检测
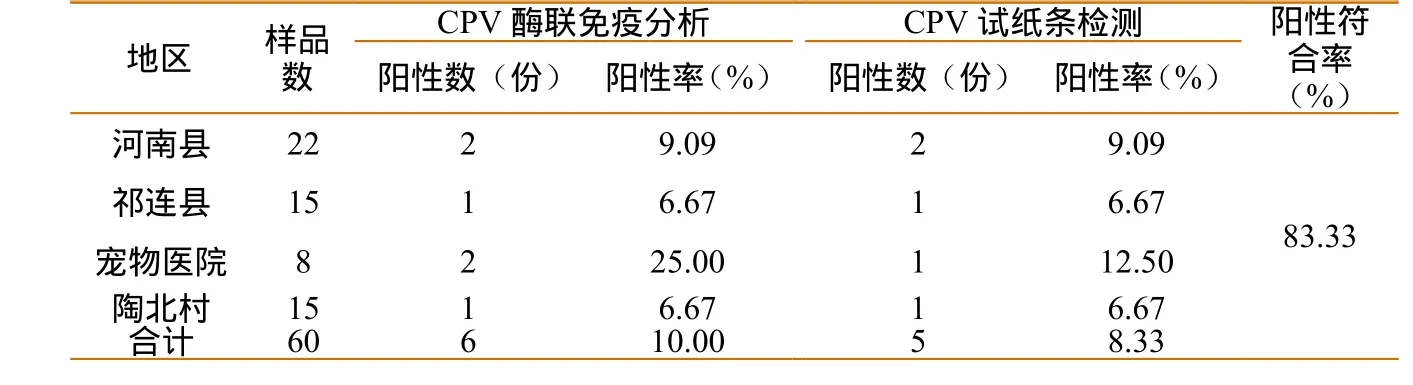
表2 ELISA和试纸条检犬细小病毒测阳性数统计
2.2 CPV试纸条检测
应用CPV检测试纸条对青海部分地区的60份藏獒粪便进行检测,共检出阳性粪便5份,阳性率8.33%(5/60),详细结果见表1、表2。
3 讨论与小结
3.1 CPV作为细小病毒属中的主要成员,对犬科动物具有较强致病作用,其抗原性随时间的迁移而不断发生变化,导致诸如CPV-2a、CPV-2b、CPV-2e(a)及CPV-2C(b)亚型[6]的突变株不断产生,CPV感染的宿主谱也在不断地扩大,并在世界范围内广泛传播流行。各个国家的流行情况存在较大的差异:在意大利以CPV-2c感染为主[7-8];乌拉圭以CPV-2c为主[9];印度主要流行株为CPV-2a和CPV-2c;越南以CPV-2b和CPV-2c感染为主[10-11];美国以CPV-2b和CPV-2c感染为主[12]。苏建青等报道,1982—1996年我国以CPV-2a为主,1997年后逐渐以CPV-2b为主。此外,张国仓对内蒙古大通县境内犬类疫病进行的流行病学调查显示,因传染病死亡的犬只占被调查犬的10.02%,其中因CPV感染死亡的占6.01%。2004—2009年期间兰州市CPV阳性检出率高达25.88%,其中2004—2008年间阳性检出率呈逐渐下降趋势,但2009年又略有上升[13]。2010年吉林市对就诊的4372例疑似CPI病犬的发病情况的调查显示其阳性率高达74.33%[14]。2009 年在南京动物医院就诊的11342 例病例中,CPI占 33.25%[15]。但国内外针对藏獒CPV的报道相对较少,为了初步摸清CPV在青海省部分地区藏獒中的流行现状,为以后有效防控藏獒CPI积累流行病学资料和保护其种群繁衍提供理论依据,本研究选用CPV ELISA试剂盒和CPV检测试纸对青海省河南县、祁连县、西宁市陶北村獒园及嘉旺宠物医院采集的样品进行检测,结果显示阳性检出率分别为10.00%(6/60)和8.33%(5/60),由X2= 0.1000,P>0.05,表明以上两种方法差异不显著,两种方法的阳性符合率为83.33%(5/60)。揭示青海部分地区的藏獒可携带CPV或发生CPI,而此次CPV的检出率远低于兰州、吉林、南京等地的检出率,这可能与长期适应高原恶劣自然环境的藏獒抵抗力比其他犬类较强有关。
3.2 目前,针对CPV的检测方法种类较多,主要有常规病毒分离(VI)、电镜检查(EM)、血凝/血凝抑制试验(HA/HI)、乳胶凝集试验(LAT)、酶联免疫吸附试验( ELISA)、免疫层析试验(ICA)、聚合酶链式反应(PCR)及实时荧光定量PCR(real-time PCR)等。但这些方法各有其优缺点,VI和LAT等方法敏感性和特异性较低。HA /HI虽有较高的特异性,但敏感性较低,而且试验需要新鲜健康的红细胞。EM 、PCR和ICA虽说较其它方法特异性和敏感性强,但需要较精密的仪器设备和较繁琐的的步骤,不适于基层的推广。ELISA的灵敏性很高,甚至高于PCR 的灵敏性,结果的准确性很高,适用于基层的大批量样品的检测,但对没有血凝活性的CPV变异株[16],易造成检验结果的不准确性。由于CPV 抗原检测试纸条也存在假阳性及假阴性现象,在临床应用过程中极易受到操作者的影响,且不同生产厂家的试纸条敏感度和特异性也会有差异[17],但它具有HA /HI和PCR所不具有的独特优点,即操作简便、出示结果快速。为此,本研究选择CPV ELISA诊断试剂盒和CPV检测试纸相结合的方法,分别对青海省部分地区藏獒血清样品中的CPV抗体和藏獒粪便中的CPV进行检测,以期为藏獒CPV感染的流行病学诊断提供理论依据。
3.3 据调查,当前侵害藏獒的主要病毒是CPV和犬瘟热病毒,其中CPV感染是主要影响6 周龄至6月龄藏獒存活率的原因[18]。加之西宁市是全国最大的藏獒集散地,每年约有5000只藏獒被输出到国内外,藏獒的流动性特别强,这也就加大了藏獒感染CPV的机率,使得在实际工作中防控藏獒CPI的难度也随之加大。为了有效预防藏獒CPI的发生,其首要任务就是组织培训养殖户的防病意识;其次对引种的獒犬和新生幼犬加强免疫抗体水平检测工作,幼龄獒断奶后应及时应用CPV灭活苗和犬五联弱毒疫苗进行免疫。在常规免疫之后,再增加1~2次,间隔15~21 d,以增强免疫效果。在治疗CPI的早期,应对病獒禁食,使用CPV高免血清、单克隆抗体或用免疫球蛋白进行治疗,或灌服生理盐水以维持机体内电解质平衡。除了采取综合治疗措施外,良好的护理和科学的饲养管理极为重要,对病獒应注意防寒保暖,饲喂易消化的食物和助消化的药物以促进病犬消化机能的恢复。
[1]蔡宝祥. 家畜传染病学[M ]. 4版. 北京: 中国农业出版社,2001.
[2]夏咸柱. 养犬大全[M].吉林: 吉林人民出版社, 1993.
[3]梁士哲, 梁川玫, 魏喜仁, 等. 狗传染性肠炎的研究[J].上海畜牧兽医通讯, 1982, 2(4): 172-175.
[4]叶俊华, 马长书, 徐玉生, 等. 犬细小病毒病血清学调查[J]. 中国养犬杂志, 1997, 8(1): 7-9.
[5]马生林. 藏獒面临的现状及开发保护[J]. 青海民族学院学报, 2008, 34(2): 110-112.
[6]Ikeda Y, Nakamura K, Miyazawa T, et al. Feline host range of canine parvovirus: Recent emergence of new antigenic type types in cats[J].Emerging infectious Disease, 2002, 8(4):341-346.
[7]Martella N, Decaro G, Buonavogla C, et al. Surveillance activity for canine parvovirus in Italy[J]. Vet Med, 2005, 52(7-8):312-315.
[8]Buonavoglia C, Martella V, Pratelli A, et al. Evidence for evolution of canine parvovirus type 2 in Italy[J]. Gen Virol,2001, 82(Pt 12):3021-3025.
[9]Pérez, R, Francia L, Romero V, et al. First detection of canine parvovirus type 2c in South America[J]. Vet Microbiol,2007, 124(1-2):147-152.
[10]Nakamura M, Tohya Y, Miyazawa T, et al. A novel antigenic variant of Canine parvovirus from a Vietnamese dog[J]. Arch Virol, 2004, 149(11):2261-2269.
[11]Chinchkar S R, Subramanian B M, Rao N H, et al.Analysis of VP2 gene sequences of canine parvovirus isolates in India[J]. Arch Virol, 2006, 151(9):1881-1887.
[12]Kapil S, Cooper E, Lamm C, et al. Canine parvovirus types 2c and 2b circulating in North American dogs in 2006 and 2007[J]. Clin Microbiol, 2007, 45(12):4044-4047.
[13]王俊, 彭程, 卢旺银, 等. 兰州市犬瘟热、犬细小病毒病及犬副流感的感染调查分析[J].畜牧兽医杂志, 2011, 30(2): 24-26.
[14]郝景锋, 袁起伟, 宁良辰, 等. 犬细小病毒病发病情况调查与分析[J].中国畜牧兽医, 2012, 39(3): 211-213.
[15]娄红军, 颜泽清. 南京地区犬病流行情况调查[J]. 养犬,2012, (2): 12-14.
[16]Desario C, Decaro N, Campolo M, et al. Canine parvovirus infection: Which diagnostic test for virus [J]. Virol Methods, 2005, 126(1-2):179-185.
[17]Bon B, Kaplon J, Metzger M H, et al. Evaluation of seven immunochromatographic assays for the rapid detection of human rotaviruses in fecal specimens [J]. Pathologic biologic,2006, 55(3-4): 149-153.
[18]张成图, 杨桂梅. 藏獒犬细小病毒流行病学调查及其防治[J]. 中国动物检疫, 2010, 27(11): 50-51.
