高渗盐水对大鼠肝脏缺血再灌注损伤的保护作用及其机制
2013-08-22毕旭东穆长征王晓梅
赵 晶 毕旭东 穆长征 王晓梅
(辽宁医学院组织胚胎学教研室,辽宁 锦州 121001)
肝脏缺血再灌注损伤(HIRI)是临床肝脏外科常见的病理过程,它可使肝代谢解毒能力降低、微循环阻力升高,严重者可导致肝功能衰竭,直接影响到疾病的预后、手术成功率和病人存活率。因此,采取适宜的干预措施从而减少HIRI是肝脏手术成功的关键所在。导致HIRI的原因很多,确切的发生机制至今仍不十分清楚。为了减轻HIRI,国内外学者做了大量的研究,目前预防HIRI的措施有药物预处理、缺血预处理、局部热应激预处理、热休克预处理、亚低温预处理、臭氧氧化预处理、缺氧预处理、缺血后处理等,在众多处理措施中又以药物预处理的应用前景最为广阔。近年来,高渗盐水的临床作用也受到人们的关注。但是高渗盐水用于治疗HIRI的实验研究报道不是很多。柯庆宏等〔1〕研究发现,高渗盐水预处理明显增强缺血/再灌注后肝脏血红素加氧酶-1(HO-1)mRNA及蛋白表达,明显改善肝脏微循环,对HIRI具有保护作用。本实验通过建立大鼠HIRI模型,应用高渗盐水来保护大鼠HIRI,并探讨其可能作用机制。
1 材料与方法
1.1 实验动物 清洁健康雄性SD大鼠60只,清洁级,体重220~260 g,由辽宁医学院实验动物中心提供。
1.2 主要试剂 一氧化氮(NO)试剂盒购于南京建成生物工程研究所,内皮素-1(ET-1)、白介素-10(IL-10)、血清肿瘤坏死因子-α(TNF-α)测定试剂盒均购自中国人民解放军总医院科技开发中心放免研究所。Bax/Bcl-2购自北京博奥森生物技术有限公司。细胞凋亡试剂盒(POD)购于罗氏公司。
1.3 动物分组及方法 健康SD大鼠随机分为4组,每组15只大鼠,术前禁食12 h,自由饮水。Ⅰ组:假手术组(Sham组),单纯麻醉(10%水合氯醛腹腔注射麻醉,300 mg/kg)和开腹,分离出肝十二指肠韧带,不阻断肝门。Ⅱ组:缺血再灌注组(IR组),麻醉后用无损伤动脉夹夹闭左肝叶、中肝叶肝蒂,40 min后移走动脉夹恢复灌流。开腹前10 min至阴茎背静脉缓慢注射生理盐水(10 ml/kg体重)。Ⅲ组:缺血预处理组(Ⅲ组,IP组),缺血5 min,再灌注 5 min,重复2次后,缺血40 min。Ⅳ组:高渗盐水预处理组(HTS组),开腹前10 min至阴茎背静脉缓慢注射7.5%氯化钠注射液(10 ml/kg体重)。
1.4 取材 各组分别于再灌注1、6、24 h后至腹主动脉取血4 ml室温静置30 min,3 000 r/min离心30 min,提取血清标本-20℃保存待测 NO、ET-1、TNF-α 和 IL-10。取 1.0×1.0×0.5 cm3大小左肝固定部位的组织,置于10%中性甲醛溶液中固定,待做光镜并观察肝组织病理学改变。
1.5 指标测定
1.5.1 血清ALT、AST的测定 采用全自动生化分析仪测定。
1.5.2 NO和ET-1的测定 分别采用硝酸还原酶法和放射免疫法测定,按试剂盒说明书进行。
1.5.3 TNF-α和IL-10的测定 放免法测定,按试剂盒说明书进行。
1.5.4 肝脏组织病理学观察 肝组织置于10%中性甲醛溶液中固定,石蜡包埋、切片,HE染色,光镜下观察组织学变化。
1.5.5 免疫组化Bax/Bcl-2蛋白含量测定 采用免疫组化SP法检测Bax及Bcl-2蛋白的表达。阳性标准为Bax、Bcl-2细胞质染色均呈棕黄色。显微镜下观察,每张片子随机选取5个视野,利用MIAS-2000图像分析阳性区域平均吸光度值(A),以A值的大小表示阳性产物表达的多少。
1.5.6 凋亡指数(AI)检测 采用TUNEL法检测AI。镜下观察凋亡细胞,细胞核中有紫黑色为阳性细胞。每张片子在200倍高倍视野下随机选取5个视野,计算出平均每100个细胞中的凋亡细胞数,并以百分数表示作为AI。
1.6 统计学分析 采用SPSS11.5统计软件进行统计分析,数据以x±s表示,组间比较采用方差分析和q检验。
2 结果
2.1 血清生化酶学的改变 见表1,表2。肝脏缺血40 min再灌注1、6、24 h后Ⅱ、Ⅲ和Ⅳ组血清ALT、AST水平明显高于Ⅰ组(P<0.01);Ⅲ、Ⅳ组明显低于Ⅱ组(P<0.01);Ⅲ和Ⅳ组之间差异无显著性(P>0.05);ALT、AST的含量水平在1、6、24 h之间的变化以6 h最为显著。
2.2 血清NO和ET-1水平 见表3、表4。肝脏缺血40 min再灌注1、6、24 h后血清NO水平Ⅱ、Ⅲ和Ⅳ组明显低于Ⅰ组(P<0.01),而ET-1明显高于Ⅰ组(P<0.01);Ⅲ和Ⅳ组明显高于Ⅱ组(P<0.01),而ET-1明显低于Ⅱ组(P<0.01);Ⅲ和Ⅳ组水平之间差异无显著性(P>0.05);NO和ET-1的含量水平在1、6、24 h之间的变化以6 h最为显著。

表1 不同组血清AST的比较(x ±s,U/L,n=15)

表2 不同组血清ALT的水平(x ±s,U/L,n=15)
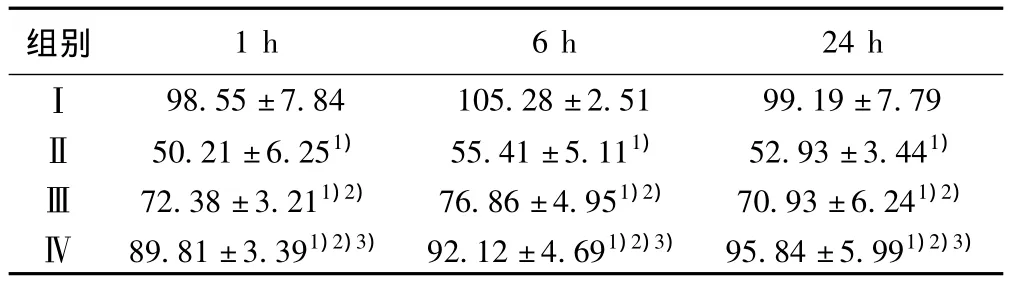
表3 各组血清NO的水平(x ± s,μmol/L,n=15)

表4 不同组血清ET-1水平(x ± s,ng/L,n=15)
2.3 血清 TNF-α和 IL-10水平 见表5、表6。肝脏缺血40 min再灌注1、6、24 h 后血清 TNF-α、IL-10 水平Ⅱ、Ⅲ和Ⅳ组明显高于Ⅰ组(P<0.01);IL-10水平Ⅲ和Ⅳ组明显高于Ⅱ组(P<0.01),而TNF-α明显低于Ⅱ组(P<0.01);Ⅲ和Ⅳ组水平之间差异无显著性(P>0.05);TNF-α和IL-10的含量水平在1、6、24 h之间的变化以6 h最为显著。
2.4 肝脏组织病理学 见图1。光镜下Ⅰ组肝索及肝窦排列规则。Ⅱ组肝组织结构紊乱,大量炎性细胞聚集、浸润,肝小叶中央静脉和肝血窦淤血明显,肝窦狭窄,肝索窦排列不规则,肝细胞不同程度的肿胀及空泡样变性,偶有点状坏死;Ⅲ组肝小叶结构尚可,部分肝细胞肿胀,变性,较Ⅱ组轻;Ⅳ组的肝小叶和肝血窦淤血程度较Ⅲ组轻,肝小叶结构基本正常,细胞变性不明显,炎性细胞浸润少,未见明显肝细胞坏死。
2.5 免疫组化法检测肝组织Bax及Bcl-2的表达 见图2,图3,和表7,表8。Ⅰ组中Bax和Bcl-2表达较多,Ⅱ组Bax和Bcl-2的表达与Ⅰ组相比,差异有统计学意义(P<0.01);Ⅲ组较Ⅱ组Bcl-2的表达水平高,但低于Ⅳ组,差异有统计学意义(P<0.01)。Ⅳ组及Ⅲ组较Ⅱ组Bax的表达水平低,Ⅲ组较Ⅱ组Bax的表达水平低,但高于Ⅳ组,差异有统计学意义(P<0.01)。

表5 不同组血清的TNF-α水平比较(x ± s,pg/ml,n=15)

表6 不同组血清的IL-10水平比较(x ± s,pg/ml,n=15)
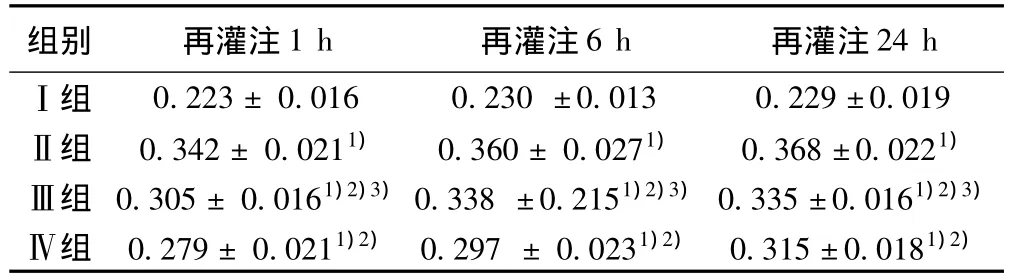
表7 各组肝组织Bax蛋白的A值的变化(x ± s,n=15)
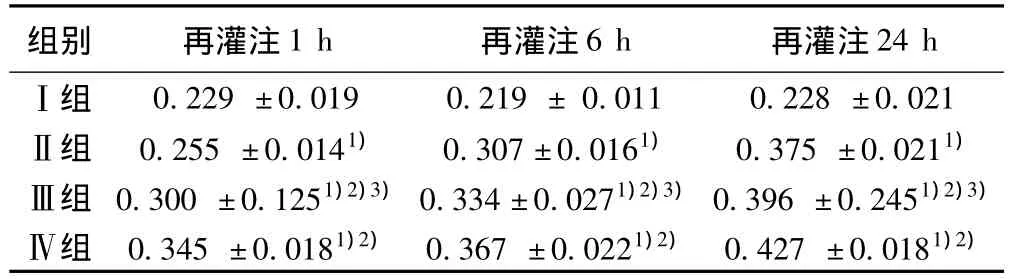
表8 各组肝组织Bcl-2蛋白的A值的变化(x ± s,n=15)
2.6 各组肝细胞凋亡情况 Ⅰ组肝组织仅见少量凋亡细胞,而Ⅱ、Ⅲ组及Ⅳ组凋亡细胞表达明显增多(P<0.01),且AI随再灌注时间的延长呈增加趋势,Ⅳ组AI值较Ⅲ及Ⅱ组低,Ⅲ组AI值较Ⅱ组低,但高于Ⅳ组,差异有统计学意义(P<0.01)。见图4,表9。

图1 各组再灌注6 h肝脏组织病理学表现(HE,×200)
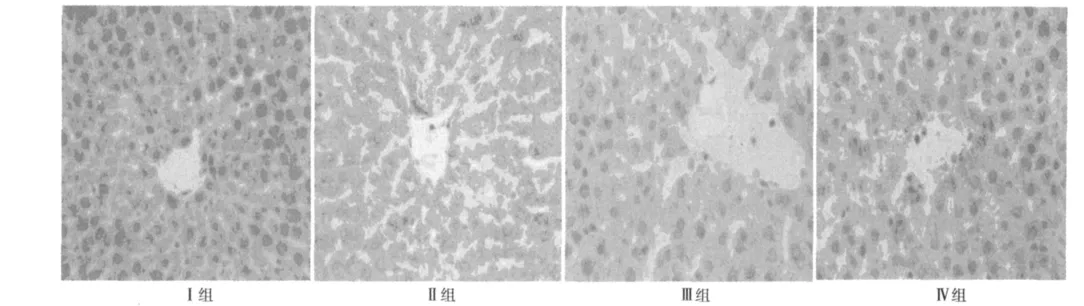
图2 各组再灌注6 h肝脏组织 Bax的表达(DAB,×200)
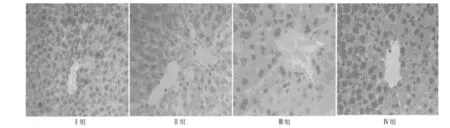
图3 各组肝脏组织再灌注6 h Bcl-2的表达(DAB,×200)
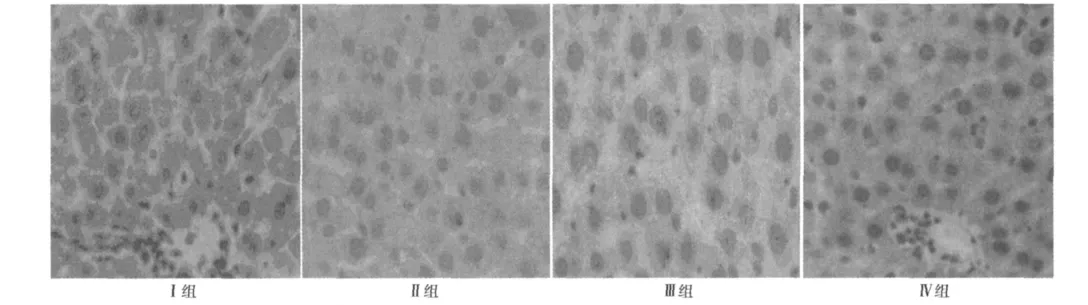
图4 各组肝脏组织凋亡情况(TUNEL,×200)
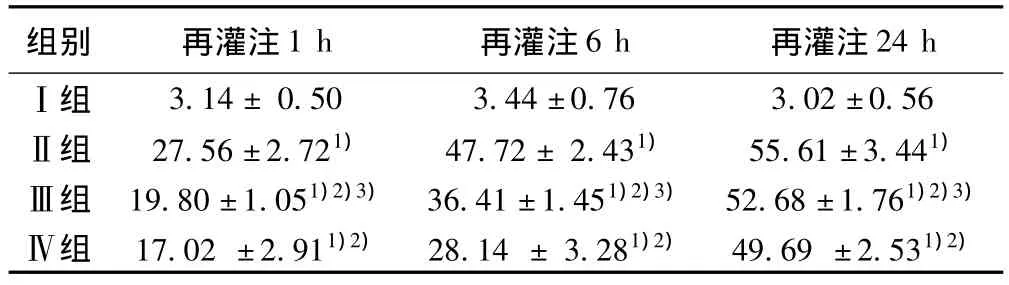
表9 各组再灌注不同时点肝细胞的AI的变化(x ± s,n=15)
3 讨论
HIRI是一个有多种细胞参与、多种介质共同作用、钙离子超载、氧自由基形成、微循环紊乱和能量耗竭等多因素形成的复杂病理生理过程,临床实践中,如原位肝移植,复杂肝切除手术,休克复苏会不可避免地导致肝脏缺血再灌注损伤。有研究表明HIRI后3~6 h,各种炎症因子显著升高,出现明显的肝功能损害〔2,3〕。本实验中以再灌注后 1、6、24 h 作为观察时间点,可确切反映大鼠HIRI后的肝功能变化状况。
小剂量高渗盐水不仅能快速改善各种休克的血流动力学参数〔4〕,提高心肌收缩力和心排出量,增强微血管的反应性,改善微循环,而且还能抑制创伤应激状态下的过度炎症反应。高渗盐水可抑制粒细胞过度激活,抑制促炎细胞因子TNF-α、IL-6及黏附分子的合成、分泌或表达〔4〕,同时,增加抗炎细胞因子IL-10的释放与表达〔5〕,而发挥抗炎作用。高渗盐水调节中性粒细胞的毒性反应与调节中性粒细胞的细胞骨架有关,它能减弱中性粒细胞胞外信息的传递〔6〕。高渗盐水预处理还明显增强缺血/再灌注后肝脏血红素加氧酶-1(HO-1)mRNA及蛋白表达〔1〕,在HIRI前进行高渗盐水预处理,具有明显抑制再灌注后外周血中性粒细胞Mac-1表达和肝内ICAM-1的表达的作用,明显减轻再灌注后肝脏中性粒细胞浸润;同时肝细胞及肝窦内皮细胞浊肿、变性程度减轻,肝脏微循环得到明显改善。
本研究说明高渗盐水预处理对HIRI具有明显的保护作用。IR时,肝细胞受到严重的损害,产生大量的ET-1受ETA受体介导,引起肝血管强烈收缩,使肝脏血流循环阻力增加,加重肝脏瘀血,肝脏缺血缺氧状况更为严重,氧自由基、细胞内钙离子超载及各种炎性因子等大量释放,引起再灌注损伤。ET-1还可激活中性粒细胞,增加内皮细胞黏附分子的表达,促进中性粒细胞与内皮细胞的黏附等。ET缩血管作用所激发的自由基、兴奋性氨基酸毒性、细胞内钙离子超载以及细胞致使平衡失调因子为再灌注损伤的重要原因。
NO是一种具有多种生物活性的小分子物质,是一氧化氮合酶(NOS)的终产物,其结构简单、半衰期短、化学性质活泼,广泛存在于生物体内各组织器官,参与机体内多种生理及病理过程,如血管张力的调节,神经传递,抗微生物及免疫调节。肝脏是具有多种复杂功能的机体重要器官,所有肝脏细胞均可生成NO〔7〕。NO能与肝细胞内细胞色素酶系统结合改变活性来影响肝脏的药物代谢和生物转化。Nishida等〔8〕认为,当内毒素引起肝脏微循环变化时,NO具有稳定微循环、增强肝脏抗缺血和抗氧化的能力。在内毒素水平较低的情况下,肝脏非实质细胞产生大量NO对维持肝脏微循环起重要作用。因此,NO在肝内的作用和影响相当复杂。
NO和ET是体内最强的血管舒张和收缩因子,在生理情况下,两者之间可通过负反馈调节保持动态平衡,ET与血管内皮ETB受体结合,可以促进NO释放,而NO又可以抑制ET释放,相互作用,相互依赖,维持着动态平衡,共同精确调节血管活性〔9〕,但在许多应激状态下,它们的平衡失调可影响疾病的发生和发展。
本实验研究了大鼠肝脏缺血再灌注NO与ET之间平衡关系的改变及其与HIRI的关系。在肝脏缺血再灌注时期,ET浓度明显增高,而NO浓度明显降低。ET浓度增高一方面是因为缺氧及胞质内Ca2+浓度升高促使内皮细胞产生ET,另一方面在再灌注时期内由门静脉进入肝脏内的肠源性内毒素也可刺激内皮细胞产生ET。ET浓度增高将导致微血管收缩,肝脏血流减少而引起肝微循环功能障碍,继而导致肝细胞损伤。再灌注之后,NO生成是减少的。主要原因可能是缺血期肝脏损伤而释放出大量的精氨酸酶,再灌注后精氨酸酶进人体循环,使体内L-精氨酸(NO的供体)大量消耗,NO生成原料不足。NO浓度降低可反馈性促进ET产生而加重其收缩血管效应,同时使NO抑制黏附分子的表达及抑制血小板聚集的功能减弱而导致肝细胞损伤。
TNF-α主要由激活的巨噬细胞、内皮细胞、中性粒细胞及B细胞分泌,是具有多功能的多肽,它在炎症反应过程中起着较为重要的作用。肝脏是体内最大的巨噬细胞池,是产生TNF-α的主要器官〔10〕。肝脏富含TNF-α受体,是 TNF-α作用的主要靶器官。TNF-α通过多种机制诱导肝脏损伤。TNF-α可诱导其他细胞因子的产生及活化中性粒细胞和内皮细胞。灌注细胞因子如TNF-α可由于中性粒细胞、血管内皮细胞相互作用引起肝脏细胞、分子和微循环障碍。大量的研究资料表明,肝脏缺血再灌注后可以通过坏死和凋亡两条途径引起细胞死亡,TNF-α在此过程中起着十分重要的作用〔11〕。缺血时肝细胞受损,引起细胞内Ca超载,再灌注时Ca超载加重。Kupffer细胞因Ca超载而活化,分泌释放大量的TNF-α。TNF-α的过量表达引起大量肝细胞损害,直接导致肝窦内皮细胞肿胀,肝脏微循环功能障碍。TNF-α对肝脏损伤的作用机制表现为:直接对肝细胞损伤;对内皮细胞产生毒性作用,导致肝血窦微循环障碍;活化中性粒细胞和单核巨噬细胞,并诱导IL-1、IL-6等基因表达,活化磷脂酶A2(PLA2),使花生四烯酸分解,产生血小板活化因子(PAF)、白三烯(LT)、血栓素A2(TXA2)等炎症介质,加剧炎症反应;介导脂类介质及其他多肽介质的产生;TNF-α能激活补体系统,通过其细胞毒性作用加剧组织损伤;此外,肝脏是自由基产生的主要部位,TNF-α可以诱导氧自由基的产生;促进中性粒细胞“氧化爆发”,产生氧自由基等活性氧介质并导致肝脏损伤。
IL-10作为体内炎症反应过程中的内生性抗炎细胞因子,可以抑制多种细胞合成炎症介质,具有强有力的抗炎作用,但其具体的抗炎机理尚不清楚。近年来的研究证实IL-10是一个多效性的细胞因子,具有广泛的生物学作用〔12,13〕。它是抑制单核细胞/巨噬细胞功能的细胞素,能抑制许多前炎症相关因子的产生,包括 TNF-α、IL-1、IL-6、MIP-1 和 IL-8;抑制 Th1 淋巴细胞产生IFN-g和IL-2。Ke等〔14〕认为IL-10抑制IL-6的产生对HIRI产生保护作用。IL-10还可以增强血红素加氧酶-1(HO-1)的表达,而发挥强大的抗炎作用。IL-10通过抑制核因子-κB(NF-κB)的活化,导致各种促炎细胞因子(IL-1、IL-6和TNF等)的产生减少。
本研究验证了高渗盐水预处理能够减轻肝细胞的损伤,减轻肝脏的瘀血程度,改善微循环功能障碍,对肝脏缺血再灌注具有保护作用。其保护机制可能是抑制促炎细胞因子TNF-α、增加抗炎细胞因子IL-10的释放与表达,减少中性粒细胞介导的炎性反应所致组织的损伤。
Bcl-2是重要的抗凋亡基因,在缺血再灌注中表现尤为突出〔15,16〕。研究发现〔17〕肝细胞 Bcl-2 基因表达明显抑制了肝脏缺血再灌注时的肝细胞凋亡。Bcl-2家族包括 Bcl-2亚家族、Bax亚家族和BH3亚家族等。在体内,多以二聚体形式发挥作用,并呈现两种不同的作用:Bax二聚体形成时诱导并促进细胞凋亡,随着Bcl-2的表达上升,促进 Bax/Bax分离,形成更稳定的Bax/Bcl-2从而抑制凋亡;当Bcl-x存在时,可先与Bcl-2形成异二聚体,使游离Bax形成二聚体而促进凋亡。Bcl-2与Bax表达水平的平衡决定了凋亡信号刺激后细胞的存活或凋亡。炎症反应是肝脏缺血再灌注损伤的重要组成部分,主要由炎症细胞介导,特别是Kupffer细胞。Kupffer细胞及内皮细胞能在肝脏遭遇缺血再灌注损伤时,释放大量炎性介质及炎性因子。而这些介质及因子均为肝脏缺血再灌注损伤的始动因素,在众多炎症介质及细胞因子中,TNF-α起着十分重要的作用。缺血时肝细胞受损,引起细胞内钙超载,再灌注时钙超载加重。Kupffer细胞因钙超载而活化,释放大量的TNF-α,从而引起大量肝细胞损害〔18〕。本研究发现高渗盐水可以抑制肝细胞的凋亡,其机制可能在于抑制Bax的表达,增加Bcl-2的表达。
缺血预处理是HIRI的保护措施之一〔19〕,肝组织经短暂的重复缺血能增加对缺血的耐受性,减轻随后较长时间的缺血造成的损伤,IP涉及的机制尚不完全清楚,有待更进一步研究。
总之,高渗盐水及缺血预处理均对HIRI有保护作用。且前者的保护作用优于后者。高渗盐水能够减少Bax的表达促进Bcl-2的表达,同时又能抑制TNF-α的产生、增强IL-10的表达水平来增强抗炎作用,抑制HIRI时肝细胞的凋亡。高渗盐水预处理操作方便,适用范围广,为临床肝脏外科减轻HIRI提供有价值的实验依据,具有广泛的临床应用前景和价值。
1 柯庆宏,郑树森,梁廷波,等.高渗盐水预处理可减轻中性粒细胞介导的肝脏缺血再灌注损伤〔J〕.中国病理生理杂志,2007;23(7):1326-30.
2 Scrracion-lnglott F,Habib NA,Mathie RT.Hepatic ischemia-reperfusion injuey〔J〕.Am J Surg,2001;181(1):160-1.
3 Fondevila C,Busuttil RW,Kupiec-Weglinski JW.Hepatic ischemia/reperfusion injury:a fresh look〔J〕.Exp Mol Pathol,2003;74(1):86-93.
4 Ke QH,Zheng SS,Liang TB,et al.Pretreatment of hypertonic saline can increase endogenous interleukin 10 release to attenuate hepatic ischemia reperfusion injury〔J〕.Dig Dis Sc,2006;51(12):2257-63.
5 Oreopoulos GD,Wu H,Szaszi K,et al.Hypertonic preconditioning prevents hepatocellular injury following ischemia/reperfusion in mice:a role for interleukin-10〔J〕.Hepatology,2004;40(1):211-20.
6 Ke QH,Zheng SS,Liang TB,et al.Effects of hypertonic saline on expression of heme oxygenase enzyme-1 in hepatic ischemia/reperfusion injury rats〔J〕.Zhongguo Wei Zhong Bing Ji Jiu Yi Xue,2006;18(1):5-8.
7 袁晟光,董家鸿.一氧化氮在肝脏病变中的作用〔J〕.消化外科,2003;2(3):209-13.
8 Nishida J,Mecuskey RS,Medomaell D.Protective role of nitric oxide in hepatic microcirculatory dysfunction during endotoxemia〔J〕.Am JPhysiol,1994;267:G1135-41.
9 Hanada T,Yoshimura A.Regulation of cytokine signaling and inflammation〔J〕.Cytokine Growth Factor Rev,2002;13(4):413-5.
10 Cutrn JC,Perrelli MC,Cavalieri B,et al.Microvascular dysfunction induced by reperfusion injury and protective effect of ischemic preconditioning〔J〕.Free Radic Biol Med,2002;33(9):1200-8.
11 Colletti LM,Green M.Lung and liver injury following hepatic ischemia/reperfusion in the rat is increased by exogenous lipopolysa-ccharide which also increases hepatic TNF production in vivo and in vitro〔J〕.Shock,2001;16(4):312-9.
12 Buer BJ,Lanoue A,Gercia C,et al.Interleukin-10 secretion and impaired effector function of major histocompatibility complex classⅡ-restricted T cells anergized in vivo〔J〕.Exp Med,1998;187:177-83.
13 许昌泰,李陕区.白细胞介素研究新进展〔J〕.武警医学院学报,2007;16(2):191-4.
14 Ke B,Shen XD,Tsuchihashi S,et al.Viral interleukin-10 gene transfer prevents liver ischemia-reperfusion injury:toll-like receptor-4 and heme oxygenase-1 signaling in innate and adaptive immunity〔J〕.Hum Gene Ther,2007;18(4):355-66.
15 Bilbao G,Douglas JL,Bckhoff DF,et al.Reduction of ischemia reperfusion injury of the liver by in vivo adenovirus mediated gene transfer of the antiapoptotic Bcl-2 gene〔J〕.Ann Surg,1999;203(2):185.
16 Tsuchihashi S,Ke B,Kaldas F,et al.Vascular endothelial growth factor antagonist modulates leukocyte trafficking and protects mouse livers against ischemia/reperfusion injury〔J〕.Am JPathol,2006;168(2):695-705.
17 Buras JA,Reenstra WR.Endothelial-neutrophil interactions during ischemia and reperfusion injury:basic mechanisms of hyperbaric oxygen〔J〕.Neurol Res,2007;29(2):127-31.
18 Bayir A,Kafali ME,Ak A,et al.Effects of hypertonic saline,HAES and dimethylsulphoxide on free oxygen radicals in haemorrhagic shock oxygen radicals in haemorrhagic shock〔J〕.Ulus Travma Acil Cerrahi Derg,2003;9(3):154-9.
19 Gong NQ,Ye QF,Ang HY,et al.Protection of grafts by medicine preconditioning and ischemia preconditioning in liver transplantation〔J〕.Chin J Hepa Surg,2000;6:282-4.
