竹茶酒对D-半乳糖衰老模型小鼠抗衰老作用的研究
2013-08-21李昱鼎叶小辉叶乃兴林志达郑德勇陈兴煌
李昱鼎 叶小辉 叶乃兴,* 林志达 郑德勇 陈兴煌
(1.福建农林大学 茶叶科技与经济研究所,福建 福州 350002;2.福建农林大学 食品科学学院,福建 福州 350002;3.福建农林大学 园艺学院,福建 福州 350002)
茶类酒是以茶叶为主要原料加工而成的新一代风味型酒,该酒酒度低,色泽鲜明透亮,入口软棉,不刺喉,不上头,同时富含功能成分[1]。竹酒是以竹叶或竹节为原料制成的一种竹香浓郁、纯正,清香甘甜,具有药用保健作用的特色酒[2]。兼具二者优点的竹茶酒具有独特而怡人的风味,而且含有较丰富的茶多酚、黄酮类化合物、氨基酸、茶多糖、蛋白质等功能成分,具有良好的抗氧化抗衰老,降低胆固醇,降低心脑血管疾病的发病率,增强免疫功能等作用。本实验观测了竹茶酒对D-半乳糖所致亚急性衰老模型小鼠肝脏及血清中SOD、GSH-Px活性以及MDA含量等指标的影响,对竹茶酒的抗氧化抗衰老功能特性进行验证。
1 材料与方法
1.1 供试材料
ICR小鼠,由吴氏实验动物中心提供;麻竹,由福建农林大学提供;白茶、绿茶由福建谦谦一叶茶业科技有限公司提供;D-半乳糖、抗坏血酸、考马斯亮蓝G250、冰醋酸、无水乙醇,均由国药集团化学试剂有限公司提供;丙二醛(MDA)测定试剂盒、总超氧化物歧化酶(T-SOD)测试盒、谷胱甘肽过氧化物酶(GSHPx)测试盒,均由南京建成生物工程研究所提供。
1.2 主要仪器和设备

1.3 试验方法
1.3.1 竹茶酒的制备
茶叶、竹子、水按照 3:7:100 的比例混合,置于锥形瓶中,沸水浴45min,每隔10min摇一次,过滤后冷却备用。将洗净的糯米加水浸泡120 min,沥干后蒸15~20min,至饭粒内无白芯,松软透明。待蒸好的糯米冷却后,按照酒曲、糯米、竹茶提取液1:50:100的比例混合均匀,加盖后于28℃恒温培养箱中发酵7d。将醪液在85℃下灭菌15min,过滤、冷却后即得到竹茶酒。
1.3.2 动物实验分组和设计
雄性ICR小鼠(清洁级)60只,置于标准鼠饲养笼里,每日光照12h,环境温度25℃,每日添加饲料和水,并更换垫料。
实验开始前,对小鼠进行1周的适应性喂养并观察以确认健康。将适应环境后的小鼠随机分成6组,每组10只,分别为:正常对照组、阳性对照组、衰老模型组、竹茶酒低剂量组、竹茶酒中剂量组、竹茶酒高剂量组。除正常对照组每日腹腔注射0.9%的生理盐水外,其余各组小鼠每日腹腔注射D-半乳糖300mg/(kg·d),持续6周。正常对照组、衰老模型组每日灌胃0.9%生理盐水8mL/(kg·d);竹茶酒低剂量组、中剂量组、高剂量组每日分别灌胃 4mL/(kg·d)、8mL/(kg·d),16mL/(kg·d)竹茶酒;阳性对照组灌胃 10mg/(kg·d)维生素C溶液。连续灌胃6周后,摘眼球取血,将取血后的小鼠处死,解剖并摘取脾脏和肝脏。取出的脾脏和肝脏用0.9%的生理盐水冲洗,洗净表面残留血液,用滤纸吸干后称重。
1.3.3 血清、肝脏匀浆的制备
血清的制备:对小鼠摘眼球取得的血液,在3000r/min下离心15min得血清,4℃保存待用。
肝脏匀浆的制备:将用生理盐水洗净并用滤纸吸干的肝脏剪碎,精确称重,放入玻璃匀浆器中,加入9倍体积的生理盐水进行匀浆。
1.3.4 检测指标
(1)小鼠血清、肝脏组织中丙二醛(MDA)含量、总超氧化物歧化酶(T-SOD)活性以及谷胱甘肽过氧化物酶(GSH-Px)活性的测定均按照试剂盒中的说明书进行操作。
(2)肝脏组织中的蛋白质含量根据考马斯亮蓝法进行测定。
(3)脏器指数的计算公式:

1.3.5 统计分析
所测得结果均用平均值±标准差表示。数据均采用SPSSV19.0完成统计处理,组间差异性采用t检验,以P<0.05为统计学显著意义。
2 结果与分析
2.1 竹茶酒对小鼠脏器指数的影响
采用竹茶酒灌胃D-半乳糖衰老模型小鼠,6周后测定小鼠脏器指数,结果如表1所示。正常对照组与阳性对照组的肝脏指数存在显著性差异(P<0.05),与衰老模型组、竹茶酒高中低剂量组之间无显著差异;阳性对照组与衰老模型组、竹茶酒高中低剂量组之间无显著差异。在脾脏指数中,竹茶酒低剂量组、中剂量组之间存在显著差异,而竹茶酒低剂量组与正常对照组、衰老模型组、阳性对照组、竹茶酒高剂量组之间无显著差异;竹茶酒中剂量组与正常对照组、衰老模型组、阳性对照组、竹茶酒高剂量组之间无显著差异。
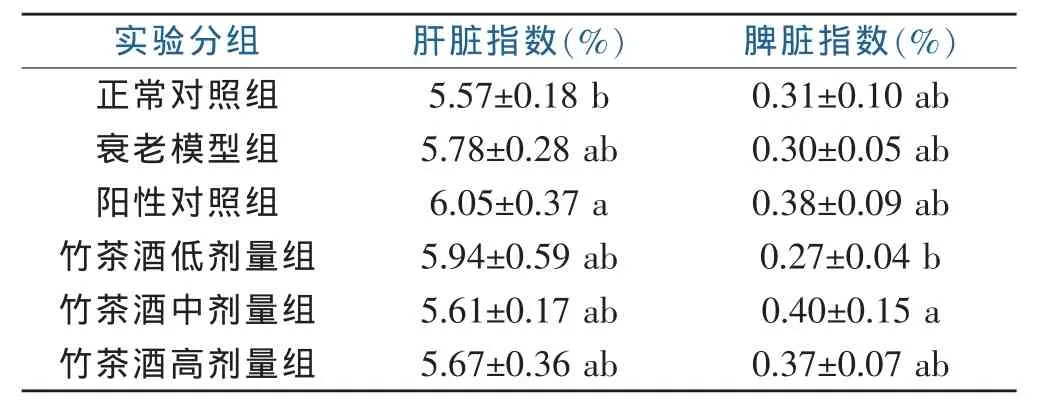
表1竹茶酒对小鼠脏器指数的影响
2.2 竹茶酒对小鼠肝脏组织中MDA含量及TSOD、GSH-Px活性的影响
采用竹茶酒灌胃D-半乳糖衰老模型小鼠,6周后测定小鼠肝脏组织中MDA含量及T-SOD、GSH-Px活性,结果如表2所示。与衰老模型组相比,各组均能显著降低肝脏组织中的丙二醛含量(P<0.05),表明维生素C(阳性对照组)、高中低三个剂量的竹茶酒均能抑制MDA的产生。正常对照组与阳性对照组、竹茶酒中低剂量组之间无显著差异。MDA的含量随着竹茶酒灌胃剂量的增加而降低,其中高低剂量组之间的MDA含量差异达到显著水平。与正常对照组相比,竹茶酒高剂量组MDA含量显著降低,降低率达到35.4%。与衰老模型组相比,除了阳性对照组外,其他各组均能显著提高肝脏中SOD的活性。正常对照组与竹茶酒低剂量组之间无显著性差异,但竹茶酒高、中剂量组SOD活性与正常对照组相比显著提高,提高率达15.9%、25.8%。对于GSH-Px活性的提高,与衰老模型组相比,其他各组均有显著性的效果,表明维生素C、高中低剂量的竹茶酒均能显著提高肝脏中GSH-Px的活性。正常对照组与阳性对照组以及高低剂量组之间无显著差异,而竹茶酒中剂量组相较于正常对照组GSH-Px活性显著提高,提高率为11.7%。可以看出,竹茶酒高中低剂量组均能显著提高衰老模型小鼠肝脏组织中SOD、GSH-Px的活性,并显著降低MDA的含量,而维生素C只能显著降低MDA含量以及提高GSH-Px活性。

表2 小鼠肝脏组织中MDA含量及T-SOD、GSH-Px活性
2.3 竹茶酒对小鼠血清中MDA含量及T-SOD、GSH-Px活性的影响
采用竹茶酒灌胃D-半乳糖衰老模型小鼠,6周后测定小鼠血清中MDA含量及T-SOD、GSH-Px活性,结果如表3所示。与衰老模型组相比,除了竹茶酒低剂量组外,其他各组均能显著性的降低血清中MDA的含量,阳性对照组与高中剂量的竹茶酒效果无显著差异。与正常对照组相比,竹茶酒中剂量组MDA含量显著降低,降低率达到19.4%。与衰老模型组相比,除了阳性对照组外,其他各组血清中SOD的活性均能显著提高,表明高中低剂量的竹茶酒均对提高SOD活性有显著效果。正常对照组与竹茶酒高中低剂量组无显著性差异。随着竹茶酒剂量的增加,SOD的活性不断增加,但无统计学意义。而对于GSH-Px活性的提高,与衰老模型组相比,其他各组均有显著效果。正常对照组与阳性对照组、竹茶酒低中剂量组之间无显著差异,高剂量组较正常对照组GSH-Px活性显著提高,提高率为9.7%。结果表明,高中低剂量的竹茶酒均能显著提高衰老模型小鼠血清中SOD、GSH-Px的活性,维生素C只能提高GSH-Px活性;而高中剂量的竹茶酒和维生素C(阳性对照组)均能显著降低MDA的含量。

表3 小鼠血清中MDA含量及T-SOD、GSH-Px活性
3 讨论
机体代谢过程中会产生氧自由基(包括·O2-、·OH 、1O2、H2O2),生理正常情况下,能够被体内的抗氧化酶(如SOD、GSH-Px等)或抗氧化剂迅速清除,使体内自由基的产生和清除处于平衡状态,一般不会对细胞产生损伤作用。随着年龄的增长,机体内抗氧化酶的活性会下降,使体内清除自由基的能力下降,以至大量具有高度化学活性的氧自由基与机体内DNA、蛋白质、氨基酸、脂质等发生过氧化变性、交联或断裂等反应[3-4]。当氧自由基与生物膜中的不饱和脂肪酸发生过氧化反应时,生物膜的结构和功能被破坏,从而引起细胞的衰老和死亡。脂质氧化的最终产物丙二醛(MDA)还可与蛋白质、氨基酸等大分子物质发生交联作用,交联聚合物(脂褐素)不溶于水,会在脑、肝、肾、心肌、骨骼肌、肾上腺、皮肤等部位的细胞内大量堆积,最终导致细胞代谢紊乱,从而加速机体的衰老进程[5]。
衰老模型的建立是评价抗衰老药物以及研究抗衰老机制的关键。衰老动物模型主要有D-半乳糖所致衰老模型、SAMP小鼠衰老模型、臭氧损伤衰老模型、去胸腺衰老模型、自然衰老模型等[6]。其中D-半乳糖所致亚急性衰老模型因为其操作简便、成本低廉、结果稳定等特点,被大量学者运用。在一段时间内,连续对动物进行皮下注射或腹腔注射大量的D-半乳糖,而D-半乳糖在还原酶作用下生成的半乳糖醇不能被细胞代谢,而沉积在细胞内,会增大细胞渗透压,破坏细胞的正常代谢,最终导致衰老的发生[7-8]。
本试验连续42d对小鼠腹腔注射300mg/(kg·d)的D-半乳糖,由实验结果可知,衰老模型组的小鼠血清及肝脏中SOD、GSH-Px的活性明显高于正常对照组,而MDA的含量明显低于正常对照组,说明本实验建模成功。本研究结果表明,竹茶酒能降低衰老小鼠肝脏、血清中MDA的含量,提高SOD、GSH-Px的活性,说明竹茶酒可提高自由基的清除率,减少自由基对机体产生的损伤,具有抗衰老作用。
[1]邬龄盛,叶乃兴,王振康.浅析茶类酒生产的现状及展望[J].茶叶科学技术,2005(1):27-28.
[2]孙世中,高旭红,刘剑虹,等.版纳甜龙竹发酵酒的制作[J].云南师范大学学报,2008,28(1):34-36.
[3]刘斌,齐云,李蒙,等.分光光度法与荧光法测定肝组织丙二醛含量的比较研究[J].中国药理学通报,2010,26(12):1674-1677.
[4] Serranoa F,Klann E.Reactive oxygen species and synaptic plasticity in the aging hippocampus [J].Ageing Res Rev,2004,3(4):431-433.
[5]凌关庭.抗氧化食品与健康[M].北京:化学工业出版社,2004.
[6]秦红兵,杨朝晔,范忆江,等.D-半乳糖诱导衰老小鼠模型的建立与评价[J].中国组织工程研究与临床康复,2009,13(7):1275-1278.
[7]石根勇,吕中明,陈新霞,等.建立衰老模型的实验研究[J].江苏预防医学,2003,14(2):63-64.
[8]许扬,吴涛,顾佳黎,等.D-半乳糖诱导衰老动物模型研究进展[J].中国老年学杂志,2009(29):1710-1712.
