肺黏液表皮样癌的诊断与治疗体会
2013-08-21ExperienceofDiagnosisandTreatmentofMucoepidermoidCarcinomaofLung
Experience of Diagnosis and Treatment of Mucoepidermoid Carcinoma of Lung
巩书磊,钟欣文,张曙光,李文雅,刘相利,张林
(中国医科大学附属第一医院胸外科,沈阳 110001)
黏液表皮样癌(mucoepidermoid carcinoma,MEC)多发生于口腔颌面部涎腺,很少发生于肺,仅占肺原发肿瘤的0.1%~0.2%。肺MEC发病率居儿童肺原发肿瘤的第3位,约占10%[1]。虽然肺与涎腺MEC相似,但仍有其独特的临床特点。我院于2008年4月至2012年4月期间共收治了20例肺MEC患者,现将其诊治经过进行分析,并结合国内外文献讨论该病的诊治方法。
1 材料与方法
1.1 临床资料
本组20例患者均经病理诊断为MEC,其中男17例,女3例;年龄31~80岁,中位年龄52岁。体检发现3例,首发症状为胸闷气短、胸痛4例,咯血5例,刺激性干咳3例,咳嗽发热3例,咳嗽咯痰1例,关节肿胀杵状指1例。查体:患侧呼吸音减弱4例,患侧闻及哮鸣音1例,其余无明显阳性体征。11例有吸烟史。
1.2 方法
1.2.1 术前检查和诊断:实验室检查:1例血清癌胚抗原(CEA)为225.7 ng/mL,明显高于正常,1例血清神经元特异性烯醇化酶(NSE)为25.78 ng/mL,1例CEA与NSE分别为15.96及17.22 ng/mL。其余指标未见明显异常。影像学检查(CT):12例为周围型,8例为中心型。病变形态大多不规则。直径7~60 mm,边界形态大多光整,个别肿物周边胸膜增厚且增强后有强化,需警惕胸膜侵犯或转移。病变大多为软组织密度增高影,增强后强化程度不一致,3例肿物存在空洞及钙化,需与结核鉴别,特别是位于肺尖的病变。本组7例存在支气管狭窄或肺不张,提示肿瘤腔内生长。2例行PET-CT检查示SUV值增高,高度怀疑恶性肿瘤。
术前临床诊断:9例术前行纤维支气管镜取病理检查,其中6例镜下见结节样或菜花样肿物,大多覆白苔,无蒂广基,活动度差,可有黏液堵塞管腔;3例镜下只见管壁突起,外压性改变,黏膜肿胀充血。4例行CT引导下穿刺取病理检查。2例以上2项均做。5例术前明确诊断为MEC,3例考虑为腺癌,1例考虑为间叶源性肿瘤,1例考虑为多形性腺瘤,1例为阴性结果,确诊率为45%。
1.2.2 手术方法:18例肿物完整切除且行规范纵隔淋巴结廓清,1例转移淋巴结侵袭周围血管,无法根治切除,1例左肺下叶癌转移至上叶,第8肋骨骨质破坏,仅行原发灶及上叶转移灶姑息切除。术中肉眼观察肿物直径2~7 cm,平均3.85 cm。均无完整包膜。4例存在少量淡黄色胸水,除3例胸腔内粘连广泛外,其余均局部粘连。
1.2.3 术后病理回报:高级别11例,中等级别1例,低级别8例;TNM分期:ⅠA期5例,ⅠB期1例,ⅡA期6例,ⅡB期3例,ⅢA期4例,Ⅳ期1例。
2 结果
2.1 治疗效果
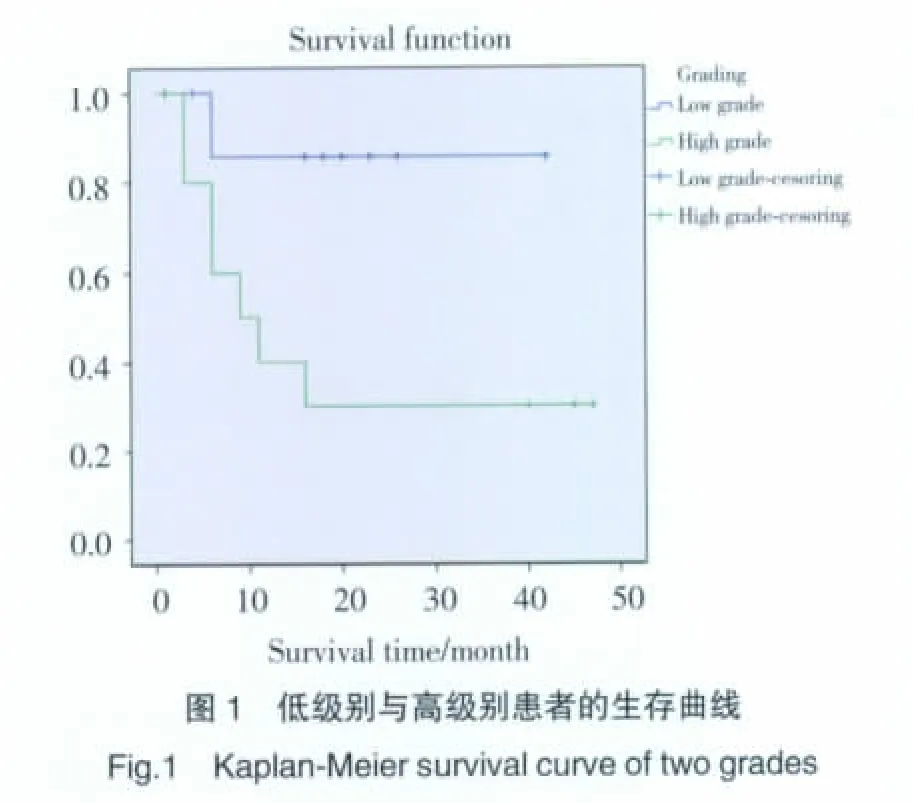
全组患者围手术期无死亡,无术后并发症,术后住院时间10~31 d,中位时间13 d。术后1个月复查CT,无异常者每3个月复查1次,1年后改为每半年复查1次,中高级别患者及ⅡA期以上低级别患者术后规律行放化疗,通过门诊或电话随访。2例失访,18例规律复查随访,术后随访3~47个月,中位随访时间16个月,10例复查CT无复发征象,恢复良好,8例死亡,其中7例为高级别,1例虽为低级别但上纵隔部分淋巴结侵及上腔静脉及肺主动脉干难以切除,有癌残留,提示低级别也有复发转移可能,一旦发生预后不佳,2例于术后3个月,3例于术后6个月,1例于术后9个月,1例于术后11个月,1例于术后16个月,发生复发转移死亡。生存分析Kaplan-Meier法得到生存曲线,见图1。
2.2 术后病理诊断结果
全组20例均经术后病理确诊为肺MEC,肿瘤多呈灰白色,质脆,与周围组织界限不清,镜下癌细胞多由黏液细胞、鳞状细胞及中间型细胞组成,呈腺样或巢状分布,细胞呈立方形或多角形,胞质丰富,嗜酸,间质或腺腔中可见黏液及蛋白分布。高级别病变往往存在坏死、核大,异型性明显,或病理性核分裂相,而低级别则罕见。免疫组化检查结果为:16例CK(H)阳性,14 例 CK(L)阳性,8例 TTF-1阳性,7例 Ki-67阳性。
3 讨论
肺MEC罕见,起源于气管、支气管黏膜下腺体的Kulchitsky细胞,由鳞状细胞、黏液细胞、中间型细胞组成。依据镜下结构及组织学类型将其分为高级和低级,高级别可见组织的坏死与局部侵袭、核大深染、异型性明显及病理核分裂相,低级别则少见[2]。肺MEC可以发生于任何年龄段,且无性别差异[3]。目前尚无证据表明肺MEC与长期吸烟有关,亦罕有肺MEC家族性患病的报道[4]。但儿童肺MEC发病率较高,并可合并单侧肺发育不良等畸形[5]。
肺MEC临床表现缺乏特异性,由于其多发于支气管远端,引起支气管狭窄甚至肺不张。必要时可行气管镜取病理检查明确诊断[3]。关节肿胀杵状指较少见[5]。MEC可发生淋巴及血行转移,除了肺恶性肿瘤所嗜部位外,尚可转移至皮肤及骨骼肌[6,7],本组1例Ⅳ期患者出现不同肺叶及肋骨转移。
现代细胞遗传学发现肺MEC细胞系多个染色体易位,其中最常见的为t(11;19)(q21;p13),其染色体涉及的2个基因MECT1、MAML2分别位于19p13和11q21,易位形成的新融合物MECT1-MAML2可通过干扰正常Notch信号转导机制,诱导肿瘤形成,并能上调EGFR配体双调蛋白[5]。
肺MEC的CT示厚壁空洞与钙化多于其他肺肿瘤,原因可能为MEC更易坏死,尤其是高级别病变,瘤体内散在钙化点可作为诊断MEC的特点。关于增强后影像尚存争议。有报道称PET-CT检查中,低级别MEC最大SUV值为0~6.2,高级别为2.86~23.4,提示PET-CT可预见MEC的组织病理情况[8]。本组行PET-CT检查2例,1例最大SUV为1.5,符合低级别,而另一例为31.3,超出报道的最大范围,最终诊断为高级别。
肺MEC的诊断主要依据病理结果,如鉴别困难可行免疫组化进一步鉴别。有报道称6例低级别肺MEC免疫组化结果,4例检测CK7均为阳性,5例TTF-1、4例CK20均为阴性,3例CK5/6 2例阳性[9]。通过染色体原位杂交及RT-PCR技术可检测出融合物MECT1-MAML2,有助于诊断及判断预后[10]。
手术完整切除是治疗肺MEC的首要手段,MEC对放化疗不敏感,低级别病变即使姑息切除,患者仍能带瘤存活较长时间。放化疗可作为高级别MEC术后辅助治疗。有报道质子束较光子束对患者副作用小,4个疗程过后仅有2度的皮肤反应和轻度的淋巴水肿[11]。传统化疗效果较差。分子靶向治疗为研究热点,吉非替尼为表皮生长因子受体酪氨酸激酶抑制剂。已有报道称吉非替尼治疗肺MEC临床反应良好。
肺MEC预后与多种因素有关,但肿瘤分期为独立影响因素,肿瘤组织分型虽然是重要因素,但并非独立因素,提示低级别中晚期患者需辅助治疗,年龄越大越易患高级别肿瘤,所以儿童一般预后良好[12]。
肺MEC现被认为低级别肿瘤肉眼根治后可不再施加辅助治疗,高级别需按照非小细胞肺癌行综合治疗,本组病例结合国内外报道分析结果显示低级别中晚期患者仍有施加辅助治疗的必要,高级别MEC患病率有逐年增高趋势,且3年、5年生存率明显低于相同TNM分期其他非小细胞肺癌,提示应重新定位肺MEC的恶性度,并不应按一般非小细胞肺癌治疗,急需针对肺MEC制定一套新的治疗方案。
[1]Brassesco M,Valera E,Lira R,et al.Mucoepidermoid carcinoma of the lung arising at the primary site of a bronchogenic cyst:clinical,cytogenetic,and molecular findings[J].Pediatr Blood Cancer,2011,56(2):311-313.
[2]Ishizumi T,Tateishi U,Watanabe S,et al.Mucoepidermoid carcinoma of the lung:high-resolution CT and histopathologic findings in five cases[J].Lung Cancer,2008,60(1):125-131.
[3]Lei J.Successful treatment of bronchial mucoepidermoid carcinoma in a longstanding collapsed lung[J].Ann Thorac Surg,2010,90(2):655-657.
[4]Giusti R,Flores R.Mucoepidermoid carcinoma of the bronchus presenting with a negative chest X-ray and normal pulmonary function in two teenagers:two case reports and review of the literature[J].Pediatr Pulmonol,2004,37(1):81-84.
[5]Liu X,Adams A.Mucoepidermoid carcinoma of the bronchus:a review[J].Arch Pathol Lab Med,2007,131(9):1400-1404.
[6]Abbas O,Reddy K,Demierre M,et al.Epidermotropic metastatic mucoepidermoid carcinoma[J].Am J Dermatopathol,2010,32(5):505-508.
[7]Singh A,Pandey K,Pant N.Cavitary mucoepidermoid carcinoma of lung with metastases in skeletal muscles as presenting features:a case report and review of the literature[J].J Cancer Res Ther,2010,6(3):350-352.
[8]Jindal T,Kumar A,Kumar R,et al.Role of positron emission tomography-computed tomography in bronchial mucoepidermoid carcinomas:a case series and review of the literature [J].J Med Case Reports,2010,4:277.
[9]Shilo K,Foss R,Franks T,et al.Pulmonary mucoepidermoid carcinoma with prominent tumor-associated lymphoid proliferation[J].Am J Surg Pathol,2005,29(3):407-411.
[10]Behboudi A,Enlund F,Winnes M,et al.Molecular classification of mucoepidermoid carcinomas-prognostic significance of the MECT1-MAML2 fusion oncogene[J].Genes Chromosomes Cancer,2006,45(5):470-481.
[11]Kanemoto A,Oshiro Y,Sugahara S,et al.Proton beam therapy for inoperable recurrence of bronchial high-grade mucoepidermoid carcinoma[J].Jpn J Clin Oncol,2012,42(6):552-555.
[12]Chin C,Huang C,Lin M,et al.Prognostic factors of tracheobronchial mucoepidermoid carcinoma 15 years experience[J].Respirology,2008,13(2):275-280.
