植物染料分子状态与其上染关系
2013-08-16刘祥霞杜文琴
刘祥霞, 杜文琴, 吴 翠
(五邑大学 纺织服装学院, 广东 江门 529020)
植物染料分子状态与其上染关系
刘祥霞, 杜文琴, 吴 翠
(五邑大学 纺织服装学院, 广东 江门 529020)
针对植物染料上染率低的问题,选择姜黄、茜草和大黄作为研究对象,采用膜分离技术分离植物染料的各个成分,研究植物染料在溶液中的分子状态及其对蚕丝的上染率,染色深度和染色牢度的关系。结果表明:色素的分子状态与其上染率有密切的关系,分子质量大于10 000的色素与杂质的结合体上染率只有10%左右;当分子质量小于5 000时,上染率可达30%以上;当分子质量小于1 000时,上染率提高到50%以上。生物酶可破坏色素和杂质的结合,用淀粉酶与果胶酶复合处理色素提取液,分子质量在5 000以下的色素溶出率可提高30%以上。
植物染料; 膜分离; 酶处理; 上染率
随着国民经济的发展以及人们对生活品质要求的提高,印染行业中合成染料的制造和应用对环境造成的污染正日益受到重视。进入21世纪,在全球呼唤生态、环保的大潮下,天然植物染料因其无毒、无害、环境友好、生物降解性良好等特性,再度被世人关注[1-2]。虽然天然植物染料具有合成染料无可比拟的优点,但在纺织品上还没有得到广泛的应用,其原因是多方面的,其中的原因之一是与合成染料相比绝大多数植物染料的上染率很低,染色重现性差,这在很大程度上制约了植物染料的推广和应用[3-4]。造成植物染料上染率低,重现性差的主要原因与植物染料在染液中的状态有关。染料溶液组成非常复杂,不仅含有游离的色素分子、色素分子聚集而成的胶团或胶粒,还有一部分色素和杂质的结合体以及其他杂质如纤维素、果胶、淀粉和多糖等。在这些成分中,色素分子和色素分子聚集而成的胶团或胶粒在适合的工艺条件下可以吸附、扩散并固着到纤维上,但大部分色素和杂质的结合体由于在水中的溶解度差难以上染,或者即使溶解,但由于分子较大,难以扩散到纤维内部与纤维结合而成为“无效”色素(不能或难以上染的色素),这是造成植物染料上染率低、色牢度差和染色后颜色重现性差的主要原因。本文针对这个问题,选择姜黄、茜草和大黄作为研究对象,采用膜分离技术分离植物染料的各个成分。膜分离工作原理是根据混合物的质量、体积、大小和几何形态的不同,用不同孔径的陶瓷膜分离色素和杂质[5],通过对滤出液色素成分的分析,研究植物染料在溶液中的分子状态以及其与上染率、染色深度和染色牢度的关系。在此基础上,运用生物酶技术破坏色素和杂质的结合,研究生物酶种类和组合对有效色素溶出率的影响。为提高植物染料的利用率、解决植物染料上染率低的问题奠定理论基础。
1 试验部分
1.1 试验材料
蚕丝双绉机织物,姜黄、大黄、茜草(市售),淀粉酶、果胶酶(山东大学),醋酸(A.R)等。
1.2 试验仪器与设备
WTM-1812D膜分离机,XH-KG55B 染色机, JA5003A型电子天平,HH-4恒温水浴锅,BZGY908A标准光源,PHS-3C型酸度计,V-5000型72系列可见分光光度仪,Coloreye 7000A测色配色系统,SW28型耐洗色牢度仪。
1.3 工艺与方法
1.3.1 植物染料提取液的制备
将原料粉碎,取500 g,按1∶10的比例用水提取,提取温度为90 ℃,时间为60 min。反复提取2次。取混合液,真空抽滤,取滤液,混合后浓缩成5 L染料提取液,待用。
1.3.2 膜分离流程与方法
陶瓷膜分离装置的流程如图1所示。
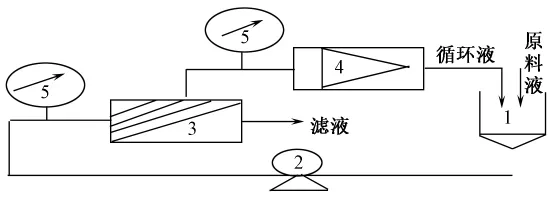
注:1—贮罐; 2—泵; 3—膜组件; 4—流量计; 5—压力计。图1 试验装置流程图Fig 1 Process of experimental instrument
膜材质:中空纤维膜,卷式超滤膜。截留分子质量分别为100 000 Da、10 000 Da、5 000 Da、3 000 Da、1 000 Da。
在温度为35 ℃、压力为0.5~1.5 MPa,时间为15~30 min的条件下[5],对染料提取液用不同截留分子质量的微滤和超滤膜过滤,得到滤出液,待用。
1.3.3 染 色
染液用量为100 mL,浴比为1∶50,温度为80 ℃,染色时间为30 min,pH值:姜黄与大黄染液为4,茜草染液为3[7-8]。
1.3.4 酶处理色素溶液
果胶酶和淀粉酶处理:酶用量为0.5 mg/mL, pH值为4.5,温度为50 ℃,搅拌酶解2 h。
复合酶处理:将果胶酶和淀粉酶等比例混合,用量与处理条件同上。
1.4 测试方法
1.4.1 色素滤出率
滤出液定容至5 L,用分光光度计测定滤出前后色素溶液的吸光度,色素滤出率为通过膜的滤出液吸光度与膜滤前原液吸光度的百分比。
1.4.2 上染率
吸光度用分光光度(残液)法测定[9]。将染色前后的染液稀释定容,用分光光度计在最大吸收波长处测量残液和染前染液的吸光度分别为A1和A0,计算上染率。

1.4.3K/S值
用X-rite测色配色系统测试试样的K/S值,在每个试样不同部位测试5次,取平均值。
1.4.4 水洗牢度
耐水洗色牢度按GB/T 3921.2—1997《纺织品 色牢度试验 耐洗色牢度:试验2》测试。
2 结果与讨论
2.1 植物染料在溶液中的分子质量分布
用水或有机溶剂提取出来的色素成分比较复杂,染液内不仅有染料及其聚集体,还有染料分子与淀粉、多糖、果胶和脂类物质等杂质的结合体。用不同膜孔径的陶瓷膜分离植物染料提取液,可以了解植物染料在溶液中的分子质量分布情况。在姜黄、茜草和大黄的提取液中,游离状态的色素分子及其胶粒的分子质量在100~1 000之间,而色素与杂质的结合体大多是与多糖、果胶以及淀粉和纤维素的结合体,目标分子质量为1×103~1×106。为此分别配置分子质量为100 000、10 000、5 000、3 000和1 000的陶瓷膜,通过对滤出液中色素滤出率的对比,分析姜黄、茜草和大黄在溶液中的分子质量分布,结果见表1。
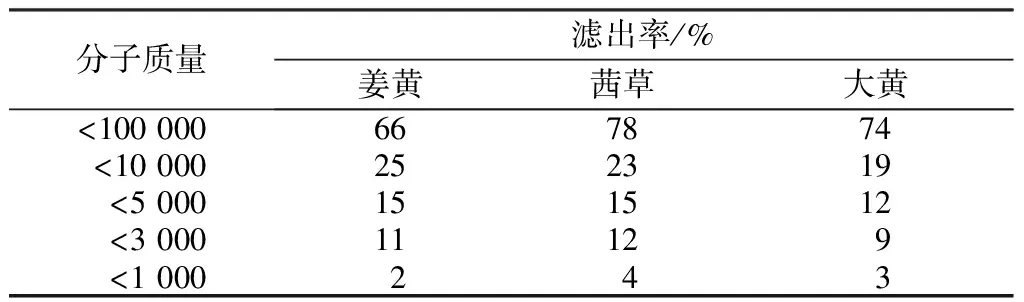
表1 姜黄、茜草和大黄溶液中不同分子质量色素的滤出率Tab.1 Dissolution rate of plant dyes of different molecular weights in solutions of tunmeric, rhubarb and gamene
注:分子质量为色素与杂质结合体的分子质量,下同。
分子质量大于5 000的可认为是色素与杂质的结合体,小于3 000的多为染料聚集体,小于1 000的可以认为是以游离状态存在的色素分子及较小的胶粒。从表1数据可看到,微滤后姜黄、茜草和大黄提取液中分子质量大于10 000的占70%以上,小于5 000的只有15%左右,小于1 000的在4%以下。可见在植物染料溶液中色素与杂质的结合体占大部分。
2.2 不同分子状态植物染料的上染性能
通过稀释或浓缩的方法调整染液的浓度,使不同分子状态的植物染料在同一浓度下染色,测定染料的上染率、得色深度和水洗牢度,结果见表2。

表2 姜黄、茜草和大黄在不同分子状态下的染色性能Tab.2 Dyeing performance of tunmeric, rhubarb and gamene of different molecuar statuses
由表2可见,姜黄、茜草和大黄的染色有一个共同的规律:分子质量大于100 000时,上染率很低(2%以下),随着分子质量的减小,上染率有不同程度的提高。在分子质量小于10 000的染液里,上染率提高到12%~15%;当分子质量在5 000以下时,上染率提高到30%~41%;当分子质量在3 000以下时,上染率提高幅度不大(38%~48%);但当分子质量小于1 000时,上染率又有一个较明显的提升(52%~65%)。可见植物染料的分子质量与其上染率有密切的关系。在分子质量大于10 000的截留液中,染料多以与杂质的结合体形式存在,分子质量比较大,难以渗透扩散到纤维中,染料上染率低,得色深度低。当分子质量小于5 000时,能够渗透扩散到纤维中的染料大大增加,上染率和得色深度都有较明显的提高。特别是在分子质量小于1 000时,染料主要以游离或者较小的胶粒状态存在,大多数染料都能上染到纤维中。由于染料能够较好地扩散和渗透,水洗牢度也比较高,达到3~4级。影响水洗牢度的因素比较复杂,与染料在纤维中的扩散渗透有关,也与得色深度有关。一般情况下,颜色越深,褪色牢度会下降。分子质量小于5 000以后,颜色加深,而褪色牢度并未下降,说明小分子质量色素的扩散渗透对牢度有贡献。
2.3 酶对植物染料分子状态的影响
由以上分析可知,植物染料上染率与其分子状态有很大的关系,提高植物染料上染率的关键是如何破坏色素与杂质之间的结合,将不能上染的“无效”色素转变成可上染的“有效”色素。采用不同种类和配比的生物酶处理姜黄、茜草和大黄的提取液[10],再用不同膜孔径的陶瓷膜分离处理后的提取液,比较处理前后截留液和滤出液中色素数量的变化,结果见表3。分析表中的数据可见:随着酶的加入,不同分子质量段的色素数量均有不同程度的变化。淀粉酶和果胶酶的加入,分子质量在5 000以上的色素量可提高10%,但对分子质量小于5 000的色素影响不明显。说明经过单一淀粉酶或果胶酶的处理,有部分色素分子质量可降解到5 000,但很难降解到5 000以下。
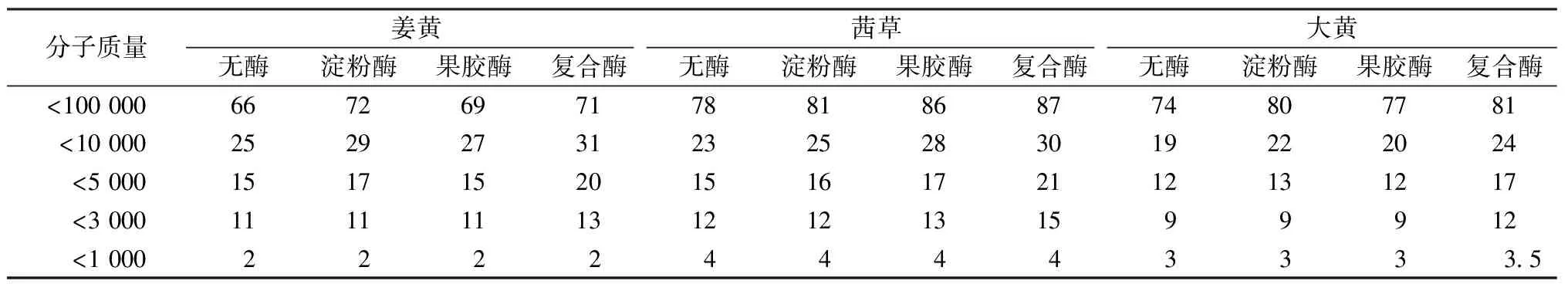
表3 酶处理后不同分子状态姜黄、茜草和大黄色素滤出率
从处理效果来看,淀粉酶对姜黄和大黄的处理效果较果胶酶明显,而果胶酶对茜草的处理效果更显著些。这说明姜黄和大黄色素与淀粉结合较多,而茜草与果胶质结合更多。
与单一酶相比,用淀粉酶与果胶酶复合处理色素提取液,各个分子质量段的色素数量都有增加,尤其是分子质量在5 000以下的色素量提高较为明显,可提高30%以上。这可能是由于淀粉酶与果胶酶的协同效应,使得更多分子质量在10 000以上的色素与杂质的结合体被破坏。但无论是单一酶还是复合酶处理,对分子质量小于1 000的色素量影响不大,说明酶处理较难将色素与杂质的结合体降解成单分子或者较小的色素胶粒。
2.4 酶处理对植物染料染色的影响
用酶处理前后的色素提取液进行染色,研究酶处理对植物染料上染性能的影响,结果见表4。
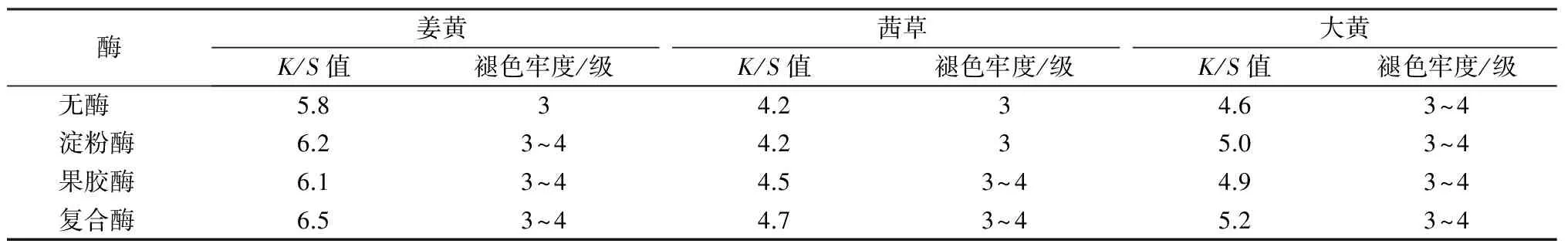
表4 酶处理对姜黄、茜草和大黄染色性能的影响Tab.4 Effect of enzyme treatment on dyeing performance of tunmeric, rhubarb and gamene
由于酶处理可破坏色素与杂质的结合,因而会影响植物染料的上染。从表4数据可见:酶处理后织物的染色深度有不同程度的提高,尤其是用复合酶处理后得色深度提高较为显著(10%以上)。这是由于复合酶处理后有更多分子质量在5 000以下的色素结合体游离出来,从而更好地提升植物染料的上染率。从水洗牢度来看,提取液经过酶处理后织物的水洗牢度有一定提高,这可能是因为酶处理后色素分子变小,更利于渗透和扩散,对提高水洗牢度有一定帮助。
3 结 论
1)姜黄、茜草和大黄提取液中,分子质量大于10 000的色素与杂质的结合体占70%以上,这是造成植物染料上染率低的主要原因。
2)姜黄、茜草和大黄色素的分子质量与其上染率有密切的关系。当分子质量小于5 000时,能够渗透扩散到纤维中的染料大大增加,上染率提高到30%以上,得色率和水洗牢度也相应提高。特别是在分子质量小于1 000时,染料主要以游离或者较小的胶粒状态存在,大多数染料都能上染到纤维中去,上染率可达到50%以上。
3)生物酶可以分解破坏色素与杂质的结合,有助于植物染料的染色。不同种类的酶对不同种类的植物染料分解效果有所不同。淀粉酶对姜黄和大黄的处理效果较果胶酶明显,而果胶酶对茜草的效果更为显著。与单一酶相比,用淀粉酶与果胶酶复合处理色素提取液,分子质量在5 000以下的色素溶出率可提高30%以上,得色深度可提高10%以上。
FZXB
[1] BECHTOLD T,TURCANU A. Natural dyes in modern textile dye houses-how to combine experiences of two centuries to meet the demands of the future[J]. Journal of Cleaner Production, 2003(11):19-23.
[2] GUPTA S. Natural dyes: a real alternative[J]. International Dyer. 2002 (3):20-22.
[3] 邰文峰,石红, 姚琦华. 天然染料染色现状及其理论[J].印染助剂,2006(3):10-14. TAI Wenfeng,SHI Hong,YAO Yihua. Status quo and theory of dyeing with natural dyes[J]. Textile Auxiliaries, 2006(3):10-14.
[4] 梁菊红.植物染色研究[J].丝绸,2001(8):22-23. LIANG Juhong. Study of plant dyeing[J]. Silk Monthly, 2001(8): 22-23.
[5] RAUTENBAC R, ALBRACHT R. Membrane Process [M].New York:Wiley, 1989: 9-10.
[6] WANG D,WANG Y, TOMI, et al. Modeling the separation performance of nanofiltration membranes for the mixed salts solution[J].Journal of Membrane Science. 2006 (280 ): 734-743.
[7] 程万里.天然染料姜黄对真丝织物的染色性能研究[J].印染助剂,2002(1):31-34. CHENG Wanli. Study of dyeing performance of natural dyes on silk fabric [J]. Textile Auxiliaries, 2002(1) :31-34.
[8] 杨东洁,郑光洪.茜草在天然纤维染色中的应用[J].丝绸,2000(12):19-21. YANG Dongjie,ZHENG Guanghong.The application of gamene on nature fiber[J]. Silk Monthly, 2000(12): 19-21.
[9] 蔡再生,闵洁.染整概论[M].北京:中国纺织出版社,2008:109-110. CAI Zaisheng, MIN Jie. Generality of Dyeing and Finishing [M].Beijing:China Textile & Apparel Press,2008:109-110.
[10] 张磊,李英富,崔永珠.复合酶法紫草天然染料的提取及其染色性能[J].大连工业大学学报,2011(30):69-73. ZHANG Lei, LI Yingfu, CUI Yongzhu. Extraction of natural dyestuff from Radix Lithospermi by complex enzyme and its dyeing ability [J]. Journal of Dalian Polytechnic University, 2011(30): 69-73.
Vegetable dyes: molecular status vs dyeing ability
LIU Xiangxia, DU Wenqin, WU Cui
(CollegeofTextileandClothing,WuyiUniversity,Jiangmen,Guangdong529020,China)
Aiming at the problem of low dye uptake of vegetable dyes, tunmeric, madder, and rhubarb were selected and their dye components were separated by membrane technology. The molecular status of vegetable dyes in the solution was investigated as well as its relationship with the dye uptake, color depth and color fastness on silk. The results showed that close relationship exists between the molecular status of coloring material and the dye uptake. The dye uptake is only around 10% as showed by the bonding of coloring material with the impurities when the molecular weight is more than 10 000; and while the dye uptake can be up to 30% and 50% when the molecular weight is lower than 5 000 and 1 000, respectively.Bio-enzymes can break the bonding of coloring material with the impurities. The dissolution rate of vegetable coloring material with the molecular weight lower than 5 000 can be increased by more than 30% if the coloring material extract is treated by amylase and pectinase.
vegetable dye; membrane separation; enzymatic treatment; dye uptake
0253- 9721(2013)09- 0084- 05
2012-09-15
2013-05-14
广东省自然科学基金资助项目(S2011010004726)
刘祥霞(1965—),女,副教授,硕士。主要研究方向为绿色染整新技术。E-mail:susanliu103@hotmail.com。
TS 193.631
A
