类人胶原蛋白-铜螯合物的制备及相关性质研究
2013-08-16俞园园
俞园园
(1.西北大学化工学院陕西省可降解生物医用材料重点实验室,陕西西安710069; 2.陕西学前师范学院化学与化工系,陕西西安710100)
类人胶原蛋白-铜螯合物的制备及相关性质研究
俞园园1,2
(1.西北大学化工学院陕西省可降解生物医用材料重点实验室,陕西西安710069; 2.陕西学前师范学院化学与化工系,陕西西安710100)
采用水体系合成法,以类人胶原蛋白为有机配体制备了类人胶原蛋白-铜螯合物,重点考察了反应体系的p H值和质量配位比对铜螯合率的影响,并利用紫外可见吸收光谱和傅立叶红外光谱对铜螯合物进行分析检测。确定优化的合成条件为:体系p H值11.0,类人胶原蛋白与硫酸铜的质量比10∶1。分析结果表明:类人胶原蛋白和无机Cu2+之间存在相互作用,生成的铜螯合物是一种不同于类人胶原蛋白的新化合物;羰基(C=O)和亚氨基(N-H)均与蛋白质-金属螯合物的形成有关,且该螯合物保持了类人胶原蛋白分子本身的α-螺旋结构。为类人胶原蛋白-铜螯合物的进一步研究开发奠定了基础。
类人胶原蛋白;铜;螯合
蛋白质在机体的生长和发育过程中承担着基础性的生物学功能,铜是蛋白质氧化还原反应中重要的催化辅因子。铜也是生物体内必需的一种微量元素[1],机体保持铜元素内稳态十分重要[2]。另外,铜还与哺乳动物体内有效的铁吸收和转运密切相关[3]。
传统的补铜制剂为无机盐,但其生物利用率通常较低,近年来,人们对补铜制剂进行了大量研究,特别是铜的氨基酸、短肽以及低分子量蛋白质螯合物,其中铜螯合物不仅生物利用率较高[4]、对机体无毒副作用,同时还具有一些重要的药理学效应,包括抗炎、抗菌、抗溃疡、抗惊厥甚至抗肿瘤活性[5]。
类人胶原蛋白(Human-like collagen,HLC)是一种利用基因工程技术生产的重组蛋白质,与传统的动物源胶原蛋白相比具有无病毒隐患、化学结构明确、生物相容性良好、免疫原性低、可加工性高等优点[6,7]。在科研人员对氨基酸/多肽-铜螯合物进行研究的基础之上[8,9],作者采用水体系合成法,以类人胶原蛋白为有机配体制备铜螯合物,考察了体系p H值和质量配位比对铜螯合率的影响,并通过紫外可见吸收光谱和傅立叶红外光谱对类人胶原蛋白-铜(HLC-Cu)螯合物进行分析检测,为HLC-Cu螯合物的进一步研究奠定了基础。
1 实验
1.1 试剂与仪器
类人胶原蛋白,西安巨子生物基因技术有限公司;其余试剂均为国产分析纯。
So LAARM6型原子吸收分光光度计,Thermo Scientific;2802pcs型紫外可见分光光度计,Unico;EQUINOX-55型傅立叶红外光谱仪,Bruker;FE 20型精密p H计,Mettler Toledo;1200型磁力搅拌器,Jenway;FD5-8型真空冷冻干燥机,Sim。
1.2 方法
称取一定量HLC溶于蒸馏水中,室温下搅拌20 min使其完全溶解,再向其中加入一定量的CuSO4溶液,用1.0 mol·L-1的NaOH溶液调节p H值至一定值,反应30 min,将反应混合液置于透析袋中,每隔4 h换水一次,过夜透析,以除去其中未参与反应的游离Cu2+。将透析后的溶液真空冷冻干燥36 h,得到HLC-Cu螯合物,置于密封袋中保藏。
1.3 分析检测
(1)采用硫化钠法对HLC-Cu螯合物进行定性检测[10]。
(2)准确移取HLC-CuSO4混合溶液10 m L于100 m L容量瓶中,定容,摇匀,用原子吸收分光光度计测定铜元素总量。另取透析后的HLC-Cu螯合物溶液10 m L,同法测定螯合态铜元素的含量。HLC对Cu2+的螯合率(简称螯合率)按下式计算:

(3)用双蒸水将制备的HLC-Cu螯合物配制成浓度为1 mg·m L-1的样品溶液。室温下测定样品溶液的紫外可见吸收光谱。
(4)称取HLC-Cu螯合物冻干品2 mg,与100 mg固体KBr混合研磨,压片。室温干燥条件下测定样品的FTIR光谱。
2 结果与讨论
2.1 类人胶原蛋白-铜螯合物合成工艺的优化
本实验采用水体系合成法[11,12]制备HLC-Cu螯合物。研究认为,水体系中生成金属螯合物的反应本质是SN2取代反应,即游离配体分子的进攻螯合与配位水分子的离去是该反应过程中的速率决定步骤,一般情况下金属离子在水体系中的配位反应是一个室温下的快速反应过程,时间和温度对其影响较小。因此,本研究重点考察反应体系的p H值和质量配位比(即配体分子与CuSO4的质量之比,RHLC/Cu)对HLC-Cu螯合物制备的影响。
2.1.1 p H值的选择
设定p H值分别为10.0、10.5、11.0、11.5、12.0,探讨其对形成HLC-Cu螯合物的影响,结果见图1。
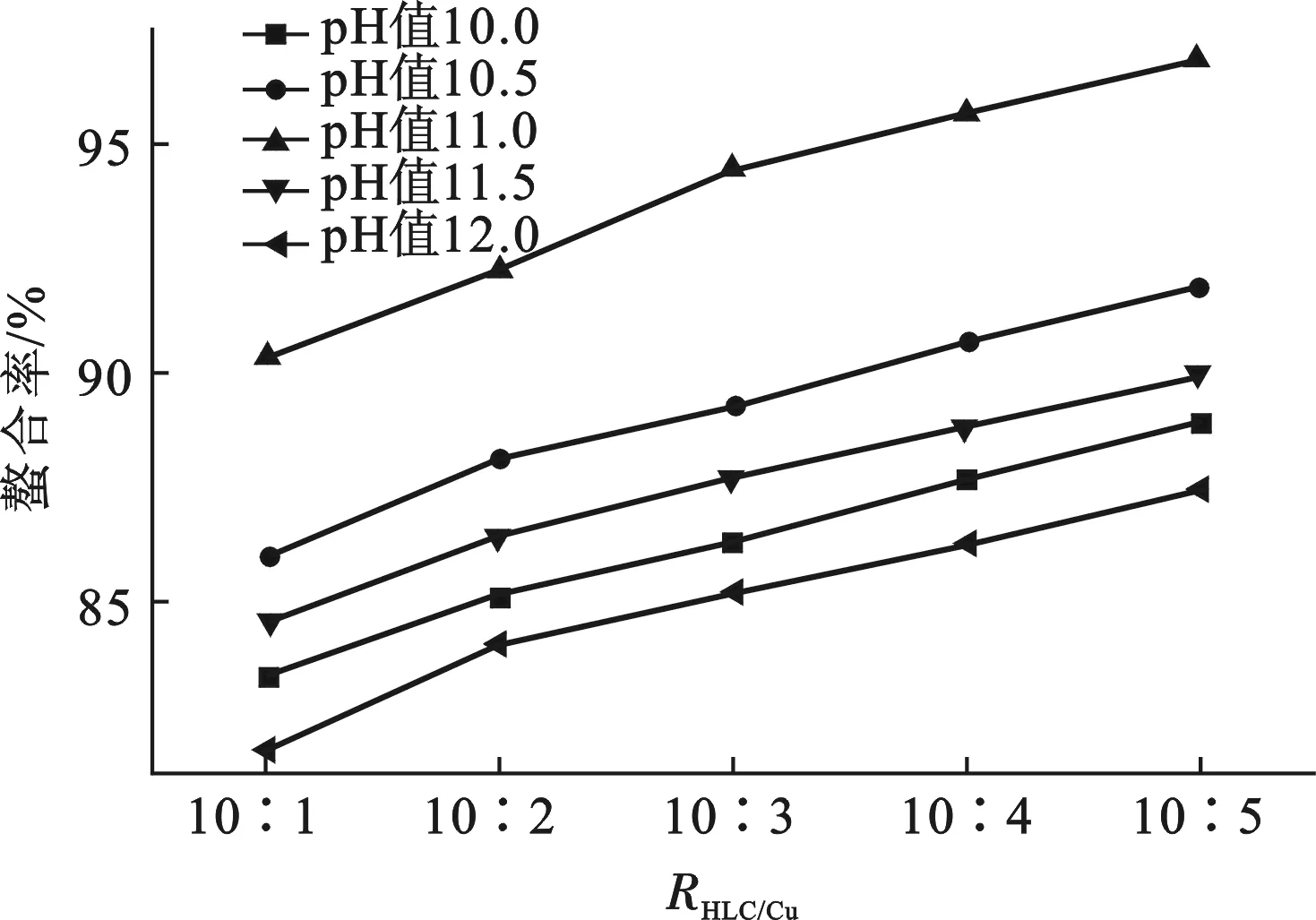
图1 p H值和质量配位比对螯合率的影响Fig.1 The effects of p H value and chelating mass ratio on chelating rate of Cu2+by HLC
由图1可知,p H值过高或过低均不利于金属螯合物的生成,当p H值为11.0时,螯合率最高。这是因为,p H值较低时,反应体系呈酸性,此时体系中存在的H+将会与Cu2+竞争配体(供电子基团);p H值较高时,反应体系呈碱性,此时体系中存在的OH-将与配体争夺Cu2+(电子受体),导致生成Cu(OH)2。因此,确定适宜的反应体系p H值为11.0。
2.1.2 质量配位比的选择
质量配位比过小,形成的螯合结构不稳定,导致生成的螯合物稳定性较差;质量配位比过大,则造成HLC不必要的浪费。设定质量配位比RHLC/Cu分别为10∶1、10∶2、10∶3、10∶4和10∶5,探讨其对形成HLC-Cu螯合物的影响,结果见图1。
由图1可知,随着质量配位比的减小即Cu2+浓度的增大,螯合率相应提高。由于铜是一种重金属元素, Cu2+浓度过大会使蛋白质发生沉淀变性,导致其生物活性丧失。鉴于此,对不同质量配位比下制备的HLC-Cu螯合物冻干品进行复水实验,结果见表1。

表1 类人胶原蛋白-铜螯合物的复水实验结果Tab.1 The result of redissolution of HLC-Cu complexes
由表1可知,只有当RHLC/Cu为10∶1时,螯合物冻干品才能复溶于水。因此,确定适宜的质量配位比为10∶1。
2.2 定性检测(表2)

表2 类人胶原蛋白-铜螯合物的定性检测结果Tab.2 The qualitation result of HLC-Cu complex
由表2可知,最终溶液变为蓝紫色,说明其中存在游离的HLC。这些游离的蛋白质分子是在Na+置换出Cu2+后才出现的,即最终溶液中的HLC分子原来是与Cu2+相结合的。由此证明制备得到的产物为HLC-Cu螯合物,既不同于以离子状态在水中存在的盐,也与不溶于水的铜盐沉淀不同,其稳定性介于铜盐沉淀和可溶性铜盐之间。
2.3 紫外可见吸收光谱分析(图2)
由图2可知,HLC的特征吸收峰在220 nm附近,这是由蛋白质分子中肽键上羰基(C=O)的n→π*跃迁引起的。酪氨酸(Tyr)和苯丙氨酸(Phe)是蛋白质分子中敏感的生色团,分别在283 nm和251 nm处有吸收,其主要来源于Tyr酚基和Phe苯基对光的吸收[13]。HLC在283 nm和251 nm附近均无吸收,与动物胶原蛋白在220~230 nm处有吸收、而在280 nm附近几乎没有吸收的结论一致。
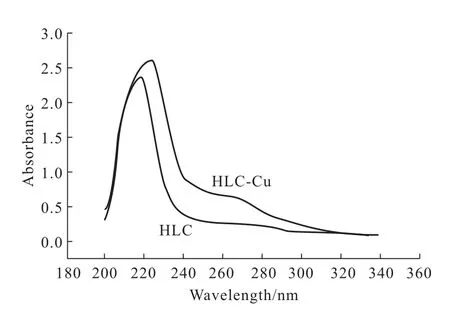
图2 类人胶原蛋白及其铜螯合物的紫外可见吸收光谱Fig.2 The UV-visible absorption spectra of HLC and HLC-Cu complex
由图2还可知,与纯HLC相比,HLC-Cu螯合物的紫外可见吸收光谱的最大吸收峰的位置发生红移,且强度增加。表明,HLC分子和Cu2+之间存在相互作用,且生成的铜螯合物是一种不同于HLC的新化合物。
2.4 傅立叶红外光谱分析(图3)

图3 类人胶原蛋白及其铜螯合物的傅立叶红外光谱Fig.3 Fourier transform infrared spectra of HLC and HLC-Cu complex
对图3进行分析:
(1)酰胺Ⅰ带主要来源于羰基的伸缩振动(νC=O),同时伴随N-H的面内弯曲振动、CN的伸缩振动以及CCN的变形振动[14,15]。研究表明,酰胺Ⅰ带与二级结构类型之间具有下列指认关系:β-转角,1660~1700 cm-1;α-螺旋,1645~1659 cm-1;无规卷曲,1640~1644 cm-1;β-折叠,1620~1640 cm-1[16]。Cu2+与HLC间的相互作用使HLC分子中酰胺Ⅰ带的位置由1651.41 cm-1移至1658.07 cm-1,表明羰基参与了该螯合物的形成过程,且Cu2+并未对HLC配体的二级结构产生影响,所形成的螯合物仍保持HLC配体相同的α-螺旋结构。
(2)酰胺Ⅱ带主要代表N-H键的弯曲振动[15,17]。与Cu2+作用后,HLC分子中酰胺Ⅱ带的位置由1549.14 cm-1偏移至1560.96 cm-1,表明HLC中的N-H基团与Cu2+发生了螯合配位作用。
(3)酰胺Ⅲ带是C-N基团伸缩振动和酰胺键中N-H基团变形振动的联合峰,同时包括来自甘氨酸骨架和脯氨酸侧链的CH2基团的非平面振动[18]。HLC-Cu螯合物的酰胺Ⅲ带分别出现在1240.76 cm-1和1243.58 cm-1处。有研究表明,IR比例(指酰胺Ⅲ带所处位置与1455.63 cm-1处的比例)约等于1意味着螺旋结构的存在[19]。HLC及其铜螯合物的IR比例分别为0.852和0.854,表明Cu2+与HLC发生相互作用时,Cu2+对HLC分子的螺旋结构未产生显著影响,这与酰胺Ⅰ带处的结论一致。
(4)酰胺A带主要来自于自由N-H基团的伸缩振动(νN-H)[20,21]。νN-H的位置受氢键和与Cu2+发生配位的N原子的影响。配位作用发生后,亚氨基的N-H伸缩振动频率较配位前低,同时峰强增大。HLC及其铜螯合物中的酰胺A带分别出现在3419.84 cm-1和3395.15 cm-1处,证明N-H基团与螯合物的形成有关,这与酰胺Ⅱ带处的结论一致。
(5)酰胺B带对应于CH2的非对称伸缩振动[22,23]。HLC及其铜螯合物的酰胺B带分别位于2931.43 cm-1和2932.61 cm-1处,二者位置极其接近,表明CH2基团未参与HLC与Cu2+的螯合过程。
综上所述,与纯HLC分子的FTIR光谱相比, HLC-Cu螯合物在功能基团的吸收峰位置和强度方面均有所不同,羰基(C=O)和亚氨基(N-H)均与该螯合物的形成有关,而且所得到的螯合物依然保持了HLC分子本身的α-螺旋结构。
3 结论
(1)采用HLC为有机配体制备HLC-Cu螯合物,优化的合成条件为:体系p H值11.0、HLC与CuSO4的质量比10∶1,在此条件下HLC对Cu2+的螯合率达90%。
(2)分析表明,待测样品以HLC-Cu螯合物的形式存在;HLC和Cu2+之间存在相互作用,生成的HLC-Cu螯合物是一种不同于纯蛋白质的新化合物;羰基(C=O)和亚氨基(N-H)均参与HLC-Cu螯合物的形成过程,且引进Cu2+并未破坏HLC分子本身的α-螺旋结构。
[1] Linder M C.Biochemistry of Copper[M].New York:PlenumPress,1991:165-178.
[2] Bull P C,Thomas G R,Rommens J M,et al.The Wilson disease gene is a putative copper transporting P-type ATPase similar to the Menkes gene[J].Nature Genetics,1993,5(4):327-337.
[3] Vulpe C D,Kuo Y M,Murphy T L,et al.Hephaestin,a ceruloplasmin homologue implicated in intestinal iron transport,is defective in the sla mouse[J].Nature Genetics,1999,21(2):195-199.
[4] Apines-Amar M J S,Satoh S,Caipang C M A,et al.Amino acidchelate:A better source of Zn,Mn and Cu for rainbow trout,Oncorhynchus mykiss[J].Aquaculture,2004,240(1-4):345-358.
[5] Baran E J.Trace elements supplementation:Recent advances and perspectives[J].Mini Reviews in Medicinal Chemistry,2004,4 (1):1-9.
[6] Li X,Ma X X,Fan D D,et al.New suitable for tissue reconstruction injectable chitosan/collagen-based hydrogels[J].Soft Matter, 2012,8:3781-3790.
[7] Jia L P,Duan Z G,Fan D D,et al.Human-like collagen/nanohydroxyapatite scaffolds for the culture of chondrocytes[J].Materials Science and Engineering C,2013,33:727-734.
[8] Stanila A,Marcu A,Rusu D,et al.Spectroscopic studies of some copper(Ⅱ)complexes with amino acids[J].Journal of Molecular Structure,2007,834-836:364-368.
[9] Viera I,Torre M H,Piro O E,et al.Structural and spectroscopic characterization of aqua-diargininate-copper(Ⅱ)-carbonate monohydrate[J].Journal of Inorganic Biochemistry,2005,99(5):1250-1254.
[10] 何照范,张迪清.保健食品化学及其检测技术[M].北京:中国轻工业出版社,1999:141-143.
[11] 巴索洛F,皮尔逊R G.无机反应机理——溶液中金属络合物的研究[M].北京:科学出版社,2001:357-364.
[12] 张祥麟.络合物化学[M].北京:冶金工业出版社,1980:43-48.
[13] Ren S W,Li J,Guan H S.The antioxidant effects of complexes of tilapia fish skin collagen and different marine oligosaccharides [J].Journal of Ocean University of China,2010,9(4):399-407.
[14] Lavialle F,Adams R G,Levin I W.Infrared spectroscopic study of the secondary structure of melittin in water,2-chloroethanol, and phospholipid bilayer dispersions[J].Biochemistry,1982,21 (10):2305-2312.
[15] Payne K J,Veis A.Fourier transform IR spectroscopy of collagen and gelatin solutions:Deconvolution of the amide I band for conformational studies[J].Biopolymers,1988,27(11):1749-1760.
[16] Hoaqland P D,Unruh J J,Wickham E D,et al.Secondary structure of bovineαS2-casein:Theoretical and experimental approaches[J].Journal of Dairy Science,2001,84(9):1944-1949.
[17] Krimm S,Bandekar J.Vibrational spectroscopy and conformation of peptides,polypeptides,and proteins[J].Advances in Protein Chemistry,1986,38:181-364.
[18] Jackson M,Mantsch H H.The use and misuse of FTIR spectroscopy in the determination of protein structure[J].Critical Reviews in Biochemistry and Molecular Biology,1995,30(2):95-120.
[19] Plepis A M D G,Goissis G,Das-Gupta D K.Dielectric and pyroelectric characterization of anionic and native collagen[J].Polymer Engineering and Science,1996,36(24):2932-2938.
[20] Doyle B B,Bendit E G,Blout E R.Infrared spectroscopy of collagen and collagen-like polypeptides[J].Biopolymers,1975,14 (5):937-957.
[21] Sai K P,Babu M.Studies on Rana tigerina skin collagen[J]. Comparative Biochemistry and Physiology B:Biochemistry and Molecular Biology,2001,128(1):81-90.
[22] Muyonga J H,Cole C G B,Duodu K G.Characterisation of acid soluble collagen from skins of young and adult Nile perch(Lates niloticus)[J].Food Chemistry,2004,85(1):81-89.
[23] Abe Y,Krimm S.Normal vibrations of crystalline polyglycine I [J].Biopolymers,1972,11(9):1817-1839.
Study on Preparation and Properties of the Complex of Human-Like Collagen with Copper
YU Yuan-yuan1,2
(1.Shaanxi Key Laboratory of Degradable Biomedical Materials,School of Chemical Engineering, Northwest University,Xi'an 710069,China;2.Department of Chemistry and Chemical Engineering, Shaanxi Xueqian Normal University,Xi'an 710100,China)
In this paper,the complex of human-like collagen(HLC)with copper is prepared in aqueous solution and is analyzed by UV-vis absorption spectroscopy and FTIR.The effects of p H value and chelating mass ratio on the coordination efficiency are investigated,and the optimum synthetic conditions are as follows:the p H value of 11.0 and the mass ratio of HLC to copper sulfate of 10∶1.Moreover,it can be concluded from UV-vis absorption spectra that there exists interaction between HLC and copper ions,and the complex is a new chemical compound different from pure protein.In the complex of copper,HLC acts as ligand,linking the copper ions via both groups of C=O and N-H,and the complex retains theα-helical structure of HLC.The results provide theoretical evidence for the further study of the complex of HLC with copper.
human-like collagen(HLC);copper;coordination
Q 816
A
1672-5425(2013)07-0029-04
10.3969/j.issn.1672-5425.2013.07.008
陕西省教育厅自然科学专项项目(2013JK0703),陕西学前师范学院科研基金项目(2013KJ082)
2013-05-03
俞园园(1983-),女,浙江绍兴人,博士后,讲师,研究方向:蛋白质化学,E-mail:yuyuanyuan0317@163.com。
