桂西北岩溶地区桑科榕属植物果实多糖含量比较
2013-08-15刘旭辉陆李露林盛华李秋明
刘旭辉,陆李露,林盛华,李秋明
(河池学院 化学与生物工程学院,广西 宜州 546300)
多糖(polysaccharides)又称多聚糖,是聚合度大于10 的糖类。自然界90%以上的碳水化合物以多糖形式存在,多糖是构成生命有机体的重要组分,在控制细胞分裂、调节细胞生长、免疫、抗癌及维持机体正常代谢等方面具有重要作用[1]。
多糖的提取、纯化及药理作用是当前研究的热点问题[2]。植物多糖的提取方法主要有溶剂提取法、酸提法、碱提法、酶解法、超滤法、超声波强化法、微波法等[3],其中超声波辅助提取法因其简便可行而比较受人关注。王桓等在喀什小枣多糖提取工艺研究中发现,超声波辅助提取多糖具有明显降低提取温度、缩短提取时间、提高多糖产率、便于产品纯化、对提取产物的结构和理化性质无影响等优点[4];徐春龙等人指出,超声波法提取植物活性成分具有快速、溶剂用量少、提取率高、成本低、质量好等优点,是一种极有发展潜力的天然产物提取新技术[5];陆娟在香菇多糖的研究中比较了多种提取方法,证实了使用超声波辅助提取法比常规的水浸提取法提取率高[6]。
榕树是桑科(Moraceae)榕属(Ficus)植物的总称,全世界有800 多种,我国有98 种,主要分布于两广、海南、福建等地。榕树是热带、亚热带森林生态系统的重要成员,许多种类具有较高的经济利用价值[7-9]。榕树资源丰富,挂果期长,果实数量多。林淑玲等对榕树的分布、花序特点、开花物候及协同进化问题进行了较深入的研究[10];黄锁义等对大叶榕气生根(榕树须)总黄酮进行提取、鉴别及对羟自由基清除作用进行了研究[11];赵庭周等对聚果榕、鸡嗉果榕成熟果实的成分进行了分析[12]。
目前,榕树在园林绿化方面的应用研究较多,对榕树在医药方面的应用研究相对较少,对榕树果实多糖的研究报道甚少。为充分开发与利用丰富的桑科植物资源,笔者对桂西北岩溶地区常见的桑科榕属植物果实多糖含量进行研究,采用超声波辅助法提取榕树果实多糖,通过正交试验优化多糖提取的工艺条件,并对14 种不同的桑科榕属植物果实多糖含量进行比较,以便为合理开发桑科榕属植物资源提供理论依据。
1 材料与方法
1.1 研究区域自然地理概况
本研究的区域主要选择在广西宜州市。宜州地处桂西北,地理坐标为东经108°4′11″~109°2′44″,北纬24°0′10″~24°52′5″,东西宽101.5 km,南北长95.64 km,总面积3 869 km2,属于亚热带季风气候区,境内主要为喀斯特地形地貌,属半山、半丘陵地区,最高峰古伦山海拔873 m,年均日照时数为1 696.9 h,总积温为7 361.8℃,>10℃的有效积温为6 579.8℃,年均降雨量为1 300~1 330 mm,年均气温为19.6~20.2℃,极端最高气温为39.9℃,极端最低气温为-2.9℃,无霜期327 d[13]。
1.2 样品采集及预处理
本研究的实验材料为桂西北岩溶地区常见的桑科榕属植物果实。2011年12月至2013年5月,选择晴朗的天气分别在河池学院校园、宜州市城区附近以及东兰县兰阳村等地采集对叶榕(F.hispida)、高山榕(F.altissimi)、台湾榕(F.formosana)、五指毛桃(F.simplicissima)、薜荔(F.pumila)、黄毛榕(F.esquiroliona)、舶梨榕(F.millettii)、石山榕(F.sublanceolata)、无花果(F.carica)、大叶榕(F.virens)、小叶榕(F.microcarpa)、斜叶榕(F.gibbosa)、垂叶榕(F.benjamina)、笔管榕(F.subpisocarpa)等14 种桑科榕属植物果实。每一种桑科榕属植物采集3 份成熟度相当的果实样品(每份样品约500 g 左右),用塑料封口袋封装,尽快带回实验室,置60℃电热恒温鼓风干燥箱中烘干,用微型植物粉碎机粉碎,过20 目筛,用塑料封口袋封装,置阴凉干燥处保存,备用。
1.3 主要试剂
葡萄糖、苯酚、铝片、NaHCO3、H2SO4(广东汕头市西陇化工股份有限公司)、无水乙醇(广州新建精细化工厂),以上试剂均为分析纯(AR),实验用水为去离子水。
1.4 实验仪器
UV765PC 紫外可见分光光度计(上海精密科学仪器有限公司);101 -2 -BS 电热恒温鼓风干燥箱(上海跃进医疗器械厂),FZ102型微型植物粉碎机(天津市泰斯特仪器有限公司),AL204 电子天平(上海梅特勒—托利多仪器有限公司),CFA-160型微电脑(光波)电热炉(茂名市恒声电器有限公司),KQ5200DA型数控超声波清洗器(江苏昆山市超声仪有限公司),SHB -Ⅲ型循环水多用真空泵(郑州长城科工贸有限公司)。
1.5 实验方法
多糖提取采用超声波辅助溶剂浸提法,通过单因素试验和正交试验分析不同影响因素(提取温度、料液比、提取时间、提取功率)对多糖提取率的影响,综合考虑成本核算及正交试验结果确定最佳的榕属果实多糖提取工艺[14]。多糖含量的测定采用苯酚—硫酸法[6]。实验所得的葡萄糖含量测定标准曲线为:Y=11.03x +0.039 5,R2=0.999 6。多糖提取率(%)=[(A-0.039 5)/11.03* N* V/M/1 000]* 100%,式中:A 为吸光度,N 为稀释倍数,V 为浸提液体积(mL),M 为样品质量(g)。
因为黄毛榕果大、量多,采集方便,所以榕属果实多糖提取的单因素试验、正交试验及最佳工艺条件优化均选用未成熟的黄毛榕果实样品进行。
1.6 数据处理
数据处理用Microsoft Excel2003 和SPSS16.0 软件进行,实验均设3 个重复(平行),结果取平均值。
2 结果与分析
2.1 单因素实验
2.1.1 超声波功率对多糖提取率的影响
准确称取经过预处理的未成熟黄毛榕果实样品0.500 0 g,在料液比为1∶30、温度为80℃、提取时间50 min 的条件下,分别按功率为80 W、100 W、120 W、140 W、160 W 进行超声波处理。按参考文献[6]的方法测定其多糖含量,结果见图1。随着超声波功率的增大,多糖提取率逐渐增高,超声波功率达到140 W时,多糖的提取率最高,功率超过140 W 之后,多糖提取率反而逐渐下降,考虑到能量消耗的问题,将功率定为120~160 W 作为进一步优化提取工艺条件的范围。
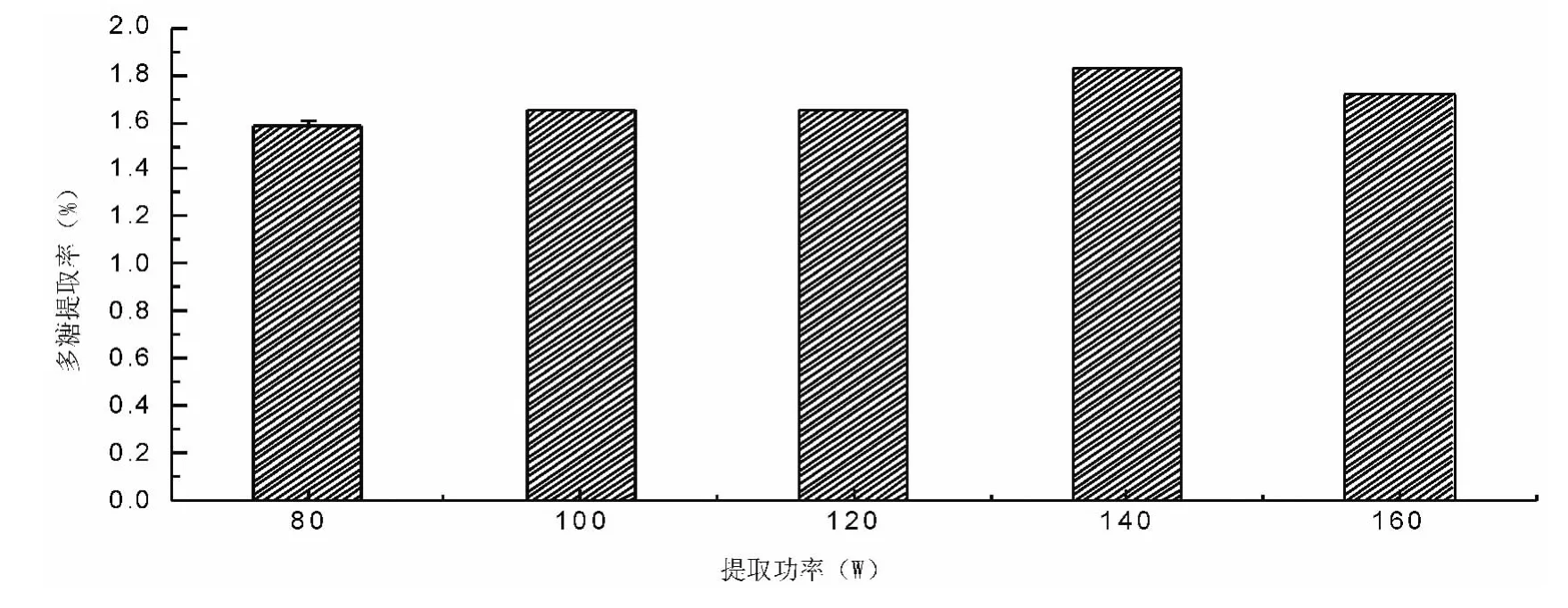
图1 超声波功率对多糖提取率的影响
2.1.2 料液比对多糖提取率的影响
准确称取经过预处理的未成熟黄毛榕果实样品0.500 0 g,在提取功率为140 W、温度为80℃、提取时间为50 min 的条件下,分别按料液比为1∶10、1∶20、1∶30、1∶40、1∶50、1∶60 进行超声波处理,按参考文献[6]的方法测定其多糖含量,结果见图2。开始时,多糖的提取率随着料液比的增大而增大,当料液比超过1∶20时,多糖提取率开始逐渐下降。所以,从提取效果及减少溶剂用量角度考虑,将料液比定为1∶20~1∶40 作为进一步优化的提取工艺条件范围。
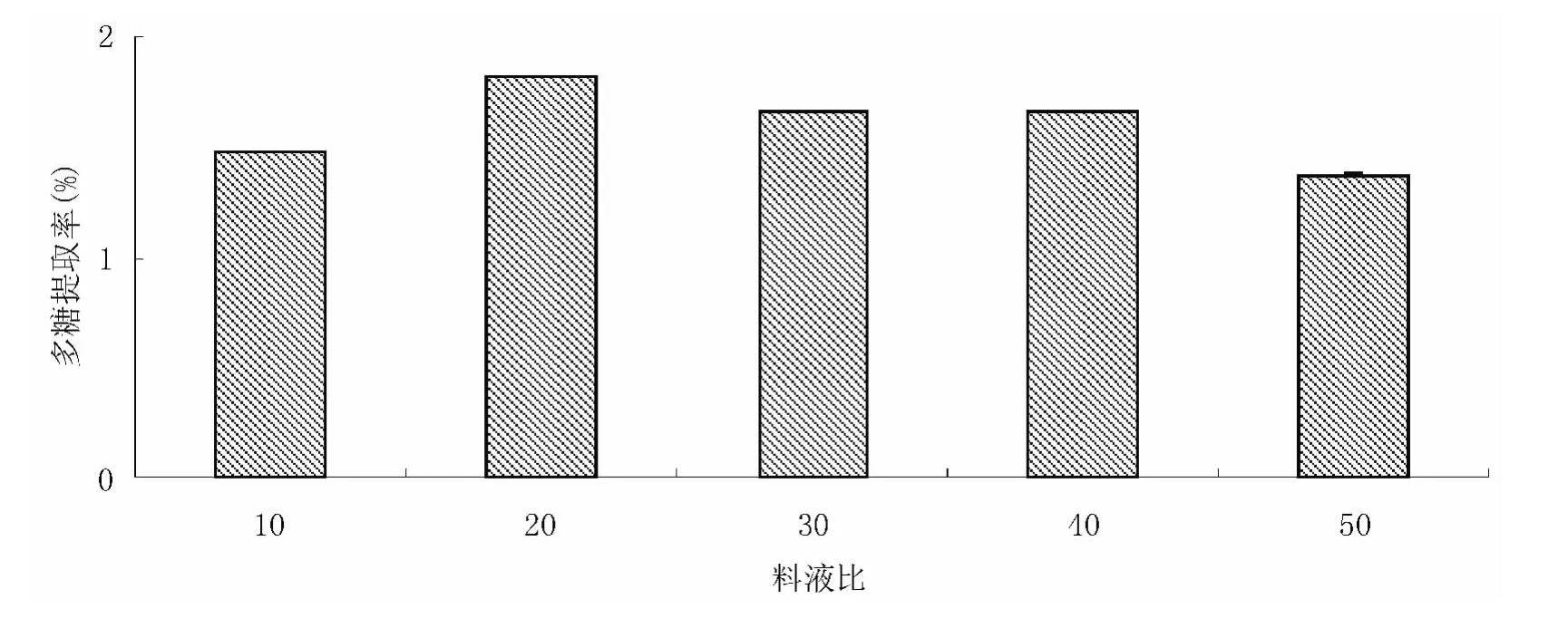
图2 料液比对多糖提取率的影响
2.1.3 超声波处理时间对多糖提取率的影响
准确称取经过预处理的未成熟黄毛榕果实样品0.500 0 g,在料液比为1∶30、提取功率为140 W、温度为80℃条件下,分别按10 min、20 min、30 min、40 min、50 min、60 min 进行超声波处理。按参考文献[6]的方法测定其多糖含量,结果见图3。随着超声波辅助提取时间的延长,多糖提取率逐渐增加,当提取时间超过50 min时,多糖的提取量反而降低。故选择40~60 min 作为进一步优化提取工艺条件的时间范围。

图3 提取时间对多糖提取率的影响
2.1.4 温度对多糖提取率的影响
准确称取经过预处理的未成熟黄毛榕果实样品0.500 0 g,在料液比为1∶30、提取功率为140 W、提取时间为50 min 条件下,分别按提取温度为50℃、60℃、70℃、80℃、90℃进行超声波处理。按参考文献[6]的方法测定其多糖含量,结果见图4。随着提取温度的增加,多糖提取率逐渐增加,当温度超过80℃时,多糖提取率有下降的趋势。故选择70℃~90℃作为进一步优化提取工艺条件的温度范围。
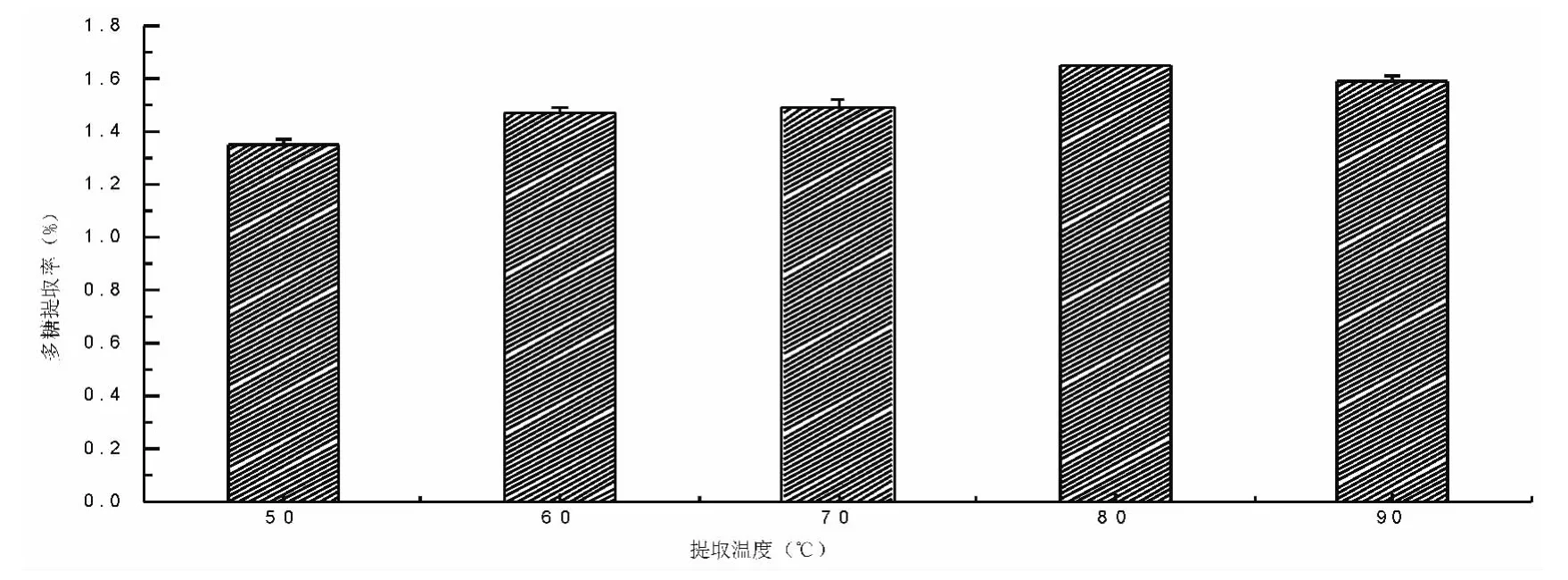
图4 提取温度对多糖提取率的影响
2.2 正交实验
为全面考查多糖提取率的影响因素,选择L9(34)正交表进行实验设计。以多糖含量为指标,以提取时间、料液比、提取温度、超声波功率为4 因素3 水平的正交试验见表1、表2。
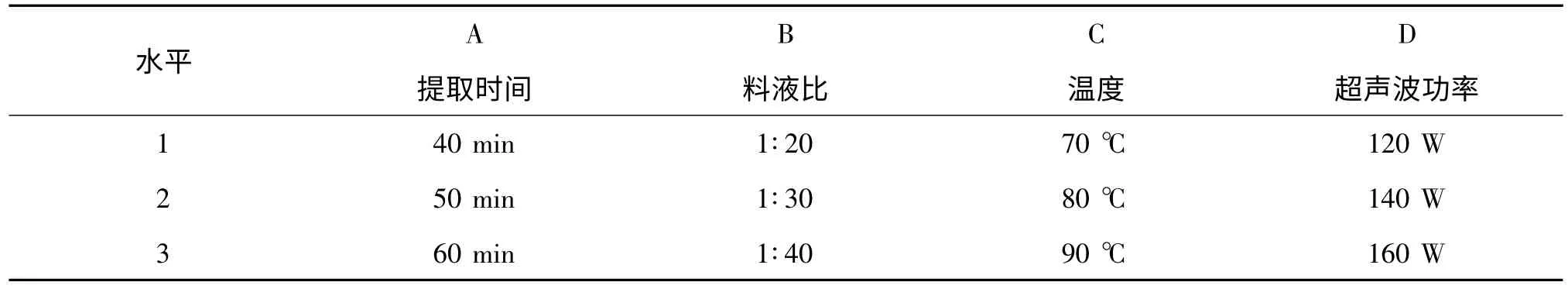
表1 正交试验因素水平表

表2 提取工艺条件优化正交试验设计与结果
由正交试验结果可知,实验9(即在提取时间为60 min,料液比为1∶40,温度为80℃,超声波功率为120 W条件下)的多糖提取率最高(1.50%)。通过比较极差值R 可知,料液比是影响多糖提取率的最主要因素,即B(料液比)>A(提取时间)>C(温度)>D(超声波功率)。所以,未成熟黄毛榕果实多糖提取的最佳工艺条件为:提取时间60 min,料液比1∶40,温度80℃,提取功率160 W。
2.3 最优工艺验证实验
为了考察工艺的稳定性,按最优条件B3A3C2D3,即在提取时间为60 min、料液比为1∶40、温度为80℃、功率为160 W 的条件下,按照实验步骤进行5 次重复性实验,实验结果见表3。
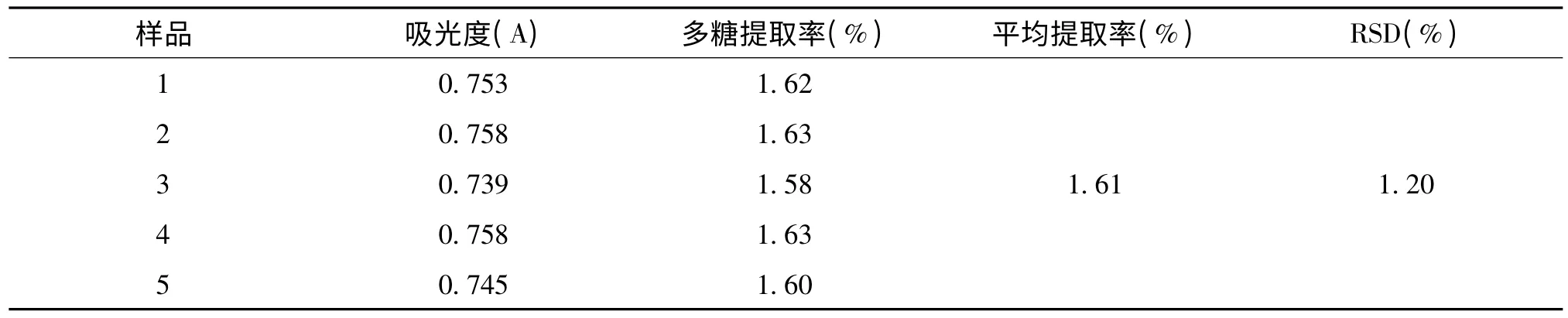
表3 验证实验结果
2.4 稳定性实验
精确吸取验证试验中的第5 份样品溶液1 mL 置于50 mL 比色管中。按照葡萄糖标准曲线测定方法测定吸光度,每20 min 记录吸光度,重复测定5 次。结果见表4。此样品溶液放置100 min时间内性质稳定,RSD=0.29%。

表4 稳定性实验结果
2.5 精密度实验
精确吸取验证试验中的第1 份样品溶液1 mL 置于50 mL 比色管中,平行5 份。按照葡萄糖标准曲线测定方法测定吸光度,重复5 次。结果见表5,RSD 为0.38%,说明该实验的精密度良好。
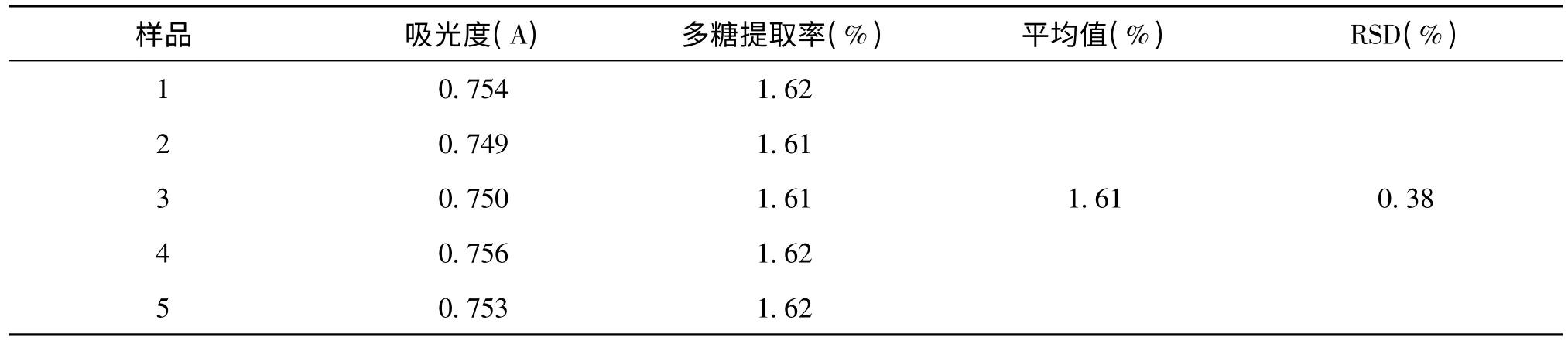
表5 精密度实验结果
2.6 不同桑科榕属植物果实的多糖含量
根据最优工艺提取所得的桑科榕属植物果实多糖含量测定结果见表6。由此可知,舶梨榕果实的多糖含量最高(3.63%),斜叶榕果实的多糖含量最低(0.39%)。多糖含量的高低排序为:舶梨榕>无花果>小叶榕>石山榕>黄毛榕(成熟)>薜荔>垂叶榕>黄毛榕(未熟)>台湾榕>笔管榕>高山榕>五指毛桃>大叶榕>对叶榕(成熟)>对叶榕(未熟)>斜叶榕。从黄毛榕及对叶榕成熟果实与未成熟果实多糖含量的比较可知,成熟果实的多糖含量略高于未成熟果实。

表6 不同桑科榕属植物果实多糖含量
3 小结与讨论
影响多糖提取率的因素比较多,提取剂、原料的颗粒度、提取次数等对提取率也有一定的影响。龚钢明等人发现,原料颗粒度对红景天多糖的提取率有明显影响,粒度越细,提取率越高[15];周泉城等在实验研究中发现,乙醇浓度对桔梗多糖得率的影响较大,乙醇浓度过高或者过低都会影响多糖提取率,提取次数也会影响多糖提取率[16]。关于乙醇浓度、提取次数及原料颗粒度对榕属植物果实多糖提取率的影响,有待后续研究。
榕属植物果实多糖含量较低,可能与其总糖含量较低有一定的关系,陆海南等人在榕属植物营养成分的研究中,测得其总糖含量为1.676%[17]。本研究的桑科榕属果实多糖含量为0.39%~3.63%,其中,舶梨榕果实的多糖含量最高,具有较好的开发和利用前景,如有必要,可对其进行相关的后续研究。
因为时间和工作量的关系,本试验没有逐一对不同植物果实多糖的最佳提取工艺条件进行研究,而是以未成熟黄毛榕的最佳提取工艺条件对14 种不同的榕属植物果实多糖进行提取,然后按经典方法测定其多糖含量,由于不同植物果实的理化性质有一定的差异,所以,其多糖提取的最佳工艺条件可能存在差异,因此,所测得的多糖含量可能不一定能够反映其真实水平,其差异大小也有待深入研究。
采用超声波辅助提取、正交试验优化的黄毛榕果实多糖提取的最佳工艺条件是:料液比1∶40,提取时间60 min,提取温度80℃,提取功率160 W。此提取工艺精密度、稳定性、重复性良好。在诸因素中,料液比对多糖提取率的影响最大,提取时间次之,温度第三,提取功率影响最小。舶梨榕果实的多糖含量最高,斜叶榕果实多糖含量最低;本研究的14 种桑科榕属植物果实的多糖含量都比较低。
[1]肖锡湘,上官新晨.多糖的应用研究[J].中国食物与营养,2006(5):21 -23.
[2]朱晓霞,罗学刚.多糖提取与纯化技术应用进展[J].食品研究与开发,2007(3):186 -188.
[3]许燕燕.植物多糖的提取方法和工艺[J].福建水产,2006(3):32 -35.
[4]王桓,潘杨,敬思群.超声强化提取喀什小枣多糖的工艺研究[J].食品研究与开发,2009,30(11):40 -43.
[5]徐春龙,林书玉.超声提取中草药成分研究进展[J].药物分析杂志,2007,27(6):9.
[6]陆娟,武哲斌,屈长青.超声波辅助提取香菇多糖的研究[J].安徽农业科学,2010,38(33):18 625 -18 626,18 663.
[7]许再富,刘宏茂,陈贵清.西双版纳榕树的民族植物文化[J].植物资源与环境,1996,5(4):48 -52.
[8]张玲.西双版纳榕树资源利用现状与开发前景[J].中国野生植物资源,2002,21(1):15 -17.
[9]许再富.榕树——滇南热带雨林生态系统中的一类关键植物[J].生物多样性,1994,2(1):21 -23.
[10]林淑玲,赵南先,陈贻竹,等.榕树(Ficus)在中国的分布及其在协同进化研究上的意义[J].生态学报,2007(10):4 278 -4 288.
[11]黄锁义,蒋丽芳,刘海花,等.大叶榕榕树须总黄酮提取及对羟自由基清除作用[J].生态学报,2006(11):689 -691.
[12]赵庭周,杨大荣,许继宏.榕树在西双版纳热带雨林中的地位和综合利用价值[J].林业科学研究,2001,14(4):441 -445.
[13]覃勇荣,潘振兴,黄江滨.桂西北岩溶地区11 种常见桑科植物生理特性比较[J].生态学杂志,2012,31(2):292 -298.
[14]刘旭辉,覃勇荣,刘宗琼,等.豆梨多糖提取工艺条件的初步研究[J].食品科技,2011,36(3):159 -163.
[15]龚钢明,王化田,韩娜.超声波法提取红景天多糖[J].工艺技术,2005,26(10):127 -130.
[16]周泉城,孙军凤.超声波辅助提取桔梗多糖研究[J].工艺技术,2007,28(7):111 -116.
[17]陆海南,吴强,麦进琳.榕树果营养成分研究[J].安徽农业科学,2012,40(8):4 618 -4 620.