响应曲面法优化刺山柑水溶性多糖提取工艺及其抗氧化性能研究
2013-08-14陈燕勤陈德军
陈燕勤,陈德军,张 玲,李 祥
(1.新疆农业大学化学工程学院,新疆 乌鲁木齐830052;2.新疆大学化学化工学院,新疆 乌鲁木齐830046)
刺山柑(Capparis spinosa L.)为白花菜科山柑属植物,又名野西瓜、老鼠瓜、槌果藤、瓜儿菜或抗旱草,维吾尔语称“波里克果”或“卡盘”等。刺山柑原产于地中海地区,现常见于法国南部、意大利和阿尔及利亚等地区,在我国主要分布于新疆、甘肃、西藏等地的荒漠戈壁和低山坡石质沙土地处。刺山柑是维吾尔医药常用药材,其果实中含有黄酮、多糖、生物碱以及挥发性脂肪酸等多类有效成分,具有清除体内异常体液、消肿止痛、祛风、散寒、除湿、畅通阻滞等功效,临床主要用于痛风、风湿性关节炎等骨关节疾病的治疗。在土耳其、印度及中东地区,刺山柑作为一种传统草药用于滋补、抗炎、降血压、降血糖、化痰、驱虫、利尿、通便等[1-3]。
从天然产物中提取的多糖能参与体内细胞中的各种活动,具有重要的特殊生理活性,在提高人体免疫力、抗氧化、抑制癌细胞、降血糖、抗感染、抗凝血、调血脂等方面都表现出显著的药理作用与药用功效[4-7]。植物多糖的传统提取方法为加热煮沸法,该方法耗时较长,且有效成分容易损失。超声波辅助提取植物多糖具有提取效率高、耗时短、溶剂用量少、活性组分损失小等优点,近年来受到人们的关注[8-10],但关于刺山柑水溶性多糖的超声提取研究鲜有报道。
作者在单因素实验的基础上,应用响应曲面法对刺山柑水溶性多糖的超声辅助提取工艺进行优化,同时考察提取的刺山柑水溶性多糖的抗氧化性能,拟为刺山柑的进一步开发利用提供参考。
1 实验
1.1 材料、试剂与仪器
刺山柑(Capparis spinosa L.)果实,产自新疆吐鲁番。
无水乙醇、丙酮、乙醚,天津市化学试剂三厂;石油醚(沸程60~90℃)、水杨酸、七水合硫酸亚铁、过氧化氢,天津福晨化学试剂厂;苯酚、浓硫酸,天津科盟化工工贸有限公司;葡萄糖,上海山浦化工有限公司;氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钾、邻苯三酚,天津光复化学研究所。所用试剂均为分析纯。
TU1810型紫外可见分光光度计,北京普析通用有限责任公司;KQ-400KDE型超声波清洗器,昆山舒美超声仪器有限公司;DHG-9101A型电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;RE-52A型旋转蒸发仪,上海亚荣生化仪器厂;SHB(Ⅲ)型循环水式真空泵,郑州长城科工贸有限公司。
1.2 方法
1.2.1 预处理
将制干刺山柑果实用重物碾碎过筛(10#筛,方孔2.0mm),用滤纸包住,放入索氏提取器中,用电热套加热回流,先用95%乙醇回流至无色,再用石油醚回流3h,除去色素及脂类物质,然后将刺山柑粉末烘干备用。
1.2.2 刺山柑水溶性多糖超声辅助提取工艺
流程:刺山柑粉末→蒸馏水超声提取→过滤→离心→减压浓缩→去蛋白→离心→洗涤沉淀→干燥→粗多糖。
具体操作:取经过预处理的刺山柑粉末4.0g,加入100mL蒸馏水,在80℃超声辅助提取85min,合并滤液减压浓缩至适当体积,用Sevage法除去蛋白质,离心,取上清液减压浓缩,得刺山柑水溶性多糖糖浆,依次用乙醇、乙醚、丙酮淋洗,真空干燥,得刺山柑水溶性粗多糖。
1.2.3 刺山柑水溶性多糖含量及提取率的测定
多糖含量的测定采用苯酚-硫酸法[11]。准确移取一定浓度刺山柑水溶性粗多糖溶液1mL,分别加入1mL 6%苯酚和5mL浓硫酸,沸水浴5min后立即冷却,在波长495nm处测定吸光度。以葡萄糖含量(x)为横坐标、吸光度(y)为纵坐标绘制标准曲线,回归方程为:y=0.0726x+0.1321(R2=0.9911),据此测得刺山柑水溶性多糖的含量,依下式计算提取率:

1.2.4 刺山柑水溶性多糖提取单因素实验设计
在保持其它条件不变的情况下,分别考察提取温度、提取时间和液料比[V(蒸馏水)∶m(刺山柑粉末),mL∶g,下同]3个因素对刺山柑水溶性多糖提取率的影响。单因素实验的因素与水平如表1所示。

表1 单因素实验因素和水平Tab.1Factors and levels of single factor experiment
1.2.5 刺山柑水溶性多糖提取的响应曲面法优化实验设计
选取提取温度(℃)、提取时间(min)、液料比(mL∶g)为影响因素,应用Box-Behnken的中心组合方法设计3因素3水平实验。利用 Design Expert 7.1.6软件对实验结果进行数据处理和回归分析。Box-Behnken实验的因素和水平见表2。

表2 Box-Behnken实验因素和水平Tab.2Factors and levels of Box-Behnken experiment
1.2.6 刺山柑水溶性多糖抗氧化性能研究
1.2.6.1 对羟基自由基(·OH)清除作用的测定
在试管中依次加入0.5mL 9mmol·L-1水杨酸-乙醇溶液、9mmol·L-1Fe2+溶液(现配)、0.5mL不同浓度的待测样品和3.5mL蒸馏水,最后加入5 mL 8.8mmol·L-1H2O2使体系发生 Fenton反应,反应一定时间后摇匀,在波长510nm处测定吸光度A1。重复测定3次,取平均值。多糖样品对羟基自由基的清除率(K)按下式计算:
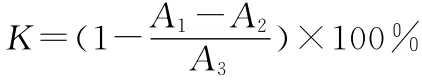
式中:A1为加入Fe2+溶液的吸光度;A2为加入蒸馏水代替Fe2+溶液的吸光度;A3为加入蒸馏水代替待测样品的吸光度。
1.2.6.2 对超氧阴离子自由基(·O-2)清除作用的测定
采用邻苯三酚自氧化法测定。取100μL不同浓度的待测样品与4.5mL 10mmol·L-1PBS缓冲溶液(pH值8.3)混合,将混合液在25℃下恒温15min,取出3mL加入到100μL 45mmol·L-1邻苯三酚溶液中,反复振荡3min后,在波长420nm处测定吸光度A′1。重复测定3次,取平均值。多糖样品对超氧阴离子自由基的清除率(K′)按下式计算:
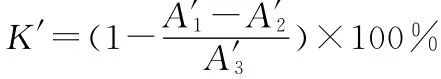
2 结果与讨论
2.1 单因素实验结果与分析
2.1.1 提取温度对刺山柑水溶性多糖提取率的影响(图1)
BOTDR是布里渊散射光时域反射测量技术(Brillouin Optical Time Domain Reflectometry)的缩写,是一种分布式应变监测技术,属于滑坡地表位移测线型监测技术。其基本原理是利用光纤中的自然布里渊散射光的频移变化量与光纤所受的轴向应变和温度的线性关系,得到光纤的轴向应变,进而求出轴向位移[21],根据BOTDR接收到的布里渊散射光频率,即可完成光纤上各点的定位和测量。布里渊散射光频率的漂移量与光纤的轴向应变和温度的关系与可用下式表示:

图1 提取温度对多糖提取率的影响Fig.1 Effect of extraction temperature on polysaccharides extraction rate
由图1可以看出,刺山柑水溶性多糖提取率随提取温度的升高逐渐上升,这是由于温度升高使得多糖分子的动能增加、扩散作用加强,提取率上升;当温度为80℃时,提取率达到最大值;随着温度的继续升高,提取率有下降趋势,这可能是由于高温对水溶性多糖的结构和活性有影响,使得水溶性多糖加速降解,从而导致提取率下降。因此,在响应曲面法的中心组合实验中选择70℃、80℃和90℃作为提取温度的3个水平参数。
2.1.2 提取时间对刺山柑水溶性多糖提取率的影响(图2)
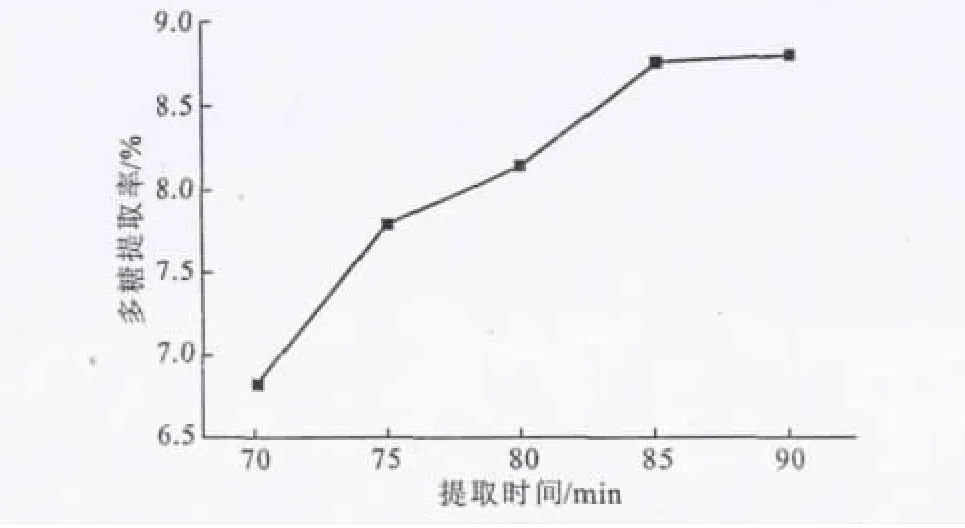
图2 提取时间对多糖提取率的影响Fig.2 Effect of extraction time on polysaccharides extraction rate
由图2可以看出,刺山柑水溶性多糖提取率随提取时间的延长逐渐上升,在提取85min之后升幅趋缓,可能是由于提取一定时间后溶液体系渗透压趋于平衡所致。因此,在响应曲面法的中心组合实验中选择80min、85min和90min作为提取时间的3个水平参数。
2.1.3 液料比对刺山柑水溶性多糖提取率的影响(图3)
由图3可以看出,刺山柑水溶性多糖提取率随液料比的增大逐渐上升,这主要是因为增加水量使得多糖的溶出率增大;当液料比达25∶1之后,由于溶液体系渗透压趋于平衡,提取率基本保持不变。因此,在响应曲面法的中心组合实验中选择20∶1、25∶1和30∶1作为液料比的3个水平参数。
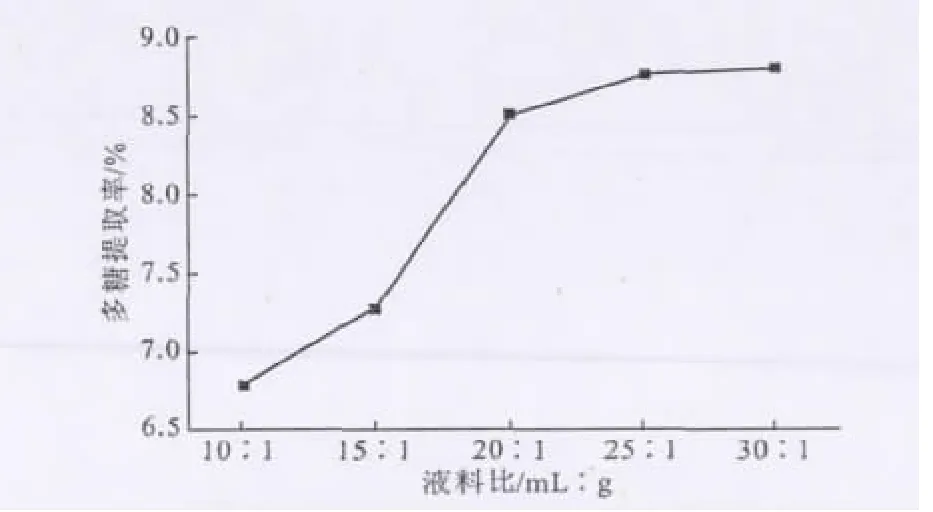
图3 液料比对多糖提取率的影响Fig.3 Effect of liquid-solid ratio on polysaccharides extraction rate
2.2 响应曲面优化实验结果与分析
2.2.1 模型方程的建立及实验结果
在单因素实验的基础上,采用Box-Behnken中心组合法,设计刺山柑水溶性多糖的超声辅助提取工艺优化实验[12]。通过最小二乘法拟合出该实验模型的二次多项式方程:
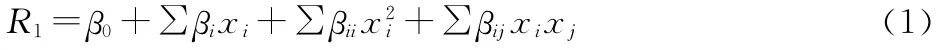
式中:R1为预测响应值(刺山柑水溶性多糖提取率);β0为常数项;βi为线性系数;βii为二次项系数;βij为交互项系数;xi、xj(i≠j)为自变量编码值。
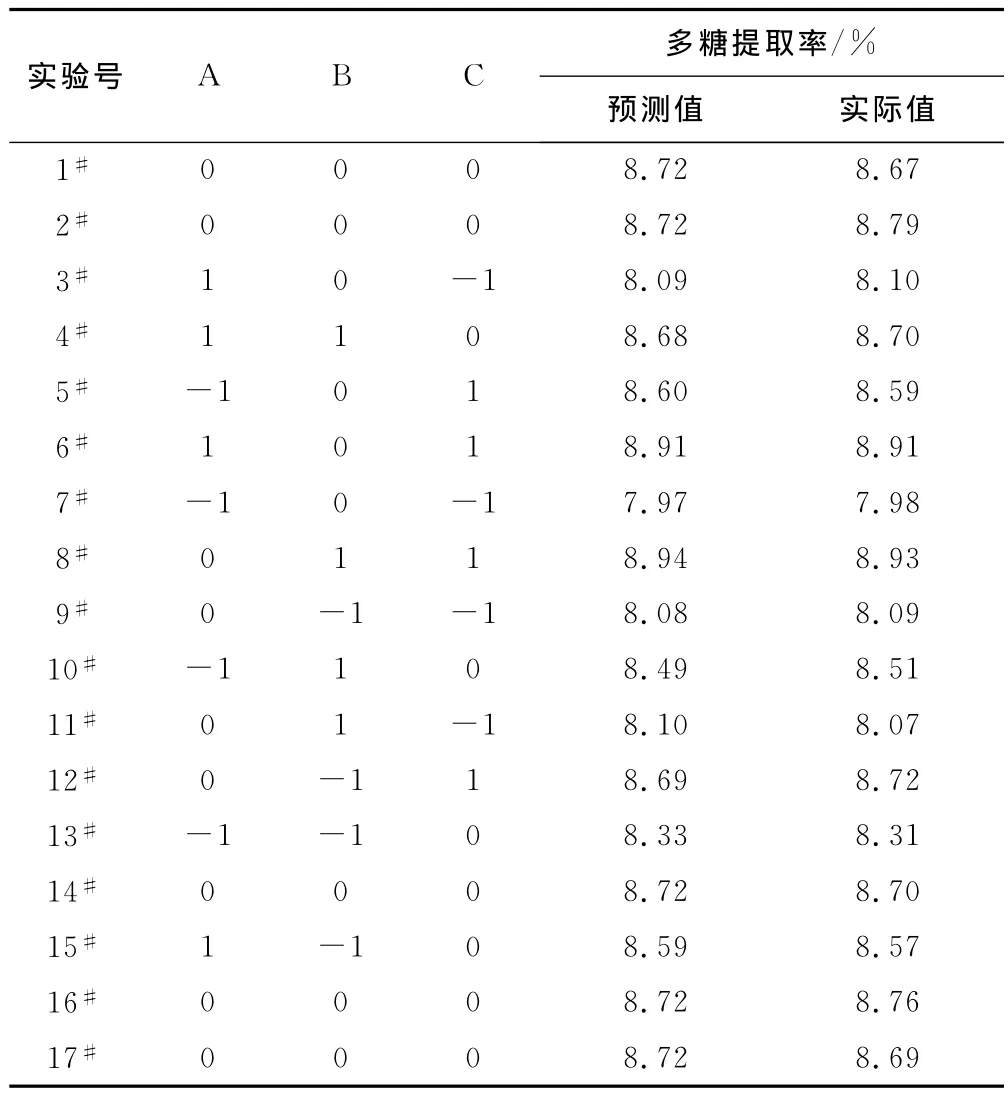
表3 Box-Behnken实验设计及结果Tab.3Design and result of Box-Behnken experiment
2.2.2 模型的显著性检验
根据方程(1),采用 Design Expert 7.1.6软件对表3的数据进行模拟回归分析,得到二次多项式回归方程:
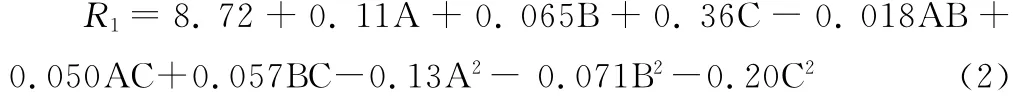
对该回归模型进行方差分析,结果见表4。对该回归模型系数显著性进行检验,结果见表5。

表4回归模型的方差分析Tab.4 Variance analysis of regression model
由表4可以看出,该实验所选模型的P值小于0.0001,说明模型的显著性为极其显著,符合实验的要求。模型失拟项的P值为0.7619,显著性判定为没有显著性意义,说明实验设计中没有异常实验,模型的回归方程不需要引入更高次数的项。模型校正后的复相关系数为0.9798,表明模型的响应值(多糖提取率)中97.98%的变化来自于所选变量,实验变量的选择在响应值影响的范围内。方差分析表明模型与实验的拟合情况较好,可以用于分析和预测刺山柑水溶性多糖超声辅助提取工艺的优化[13]。
由表5可以看出,模型的一次项A、B、C的P值均小于0.01,说明实验选择的影响因素的3个水平对刺山柑水溶性多糖提取率的影响显著,即实验选择的条件范围符合刺山柑水溶性多糖提取工艺条件选择的需要。模型的二次项A2、C2的P值小于0.01,说明提取温度和液料比对多糖提取率的影响较为显著,这与单因素实验结果吻合。对于模型的交互项来说,BC的P值小于0.05,说明提取时间和液料比之间有一定的交互作用,在选择刺山柑水溶性多糖的提取工艺条件时要考虑两者之间的关系。
通过上述分析,对模型中影响不够显著的项进行优化,得到修正后的刺山柑水溶性多糖提取率(R1)对提取温度(A)、提取时间(B)和液料比(C)的二次多项式回归方程为:

2.2.3 响应面分析
根据模型的二次多项式回归方程,绘制相应的响应面曲线图和等高线图,以考察相应因素之间对于结果的交互影响程度的强弱。R1=f(A,B,C=25∶1)的响应面及等高线见图4,R1=f(A,C,B=85min)的响应面及等高线见图5,R1=f(B,C,A=80℃)的响应面及等高线见图6。
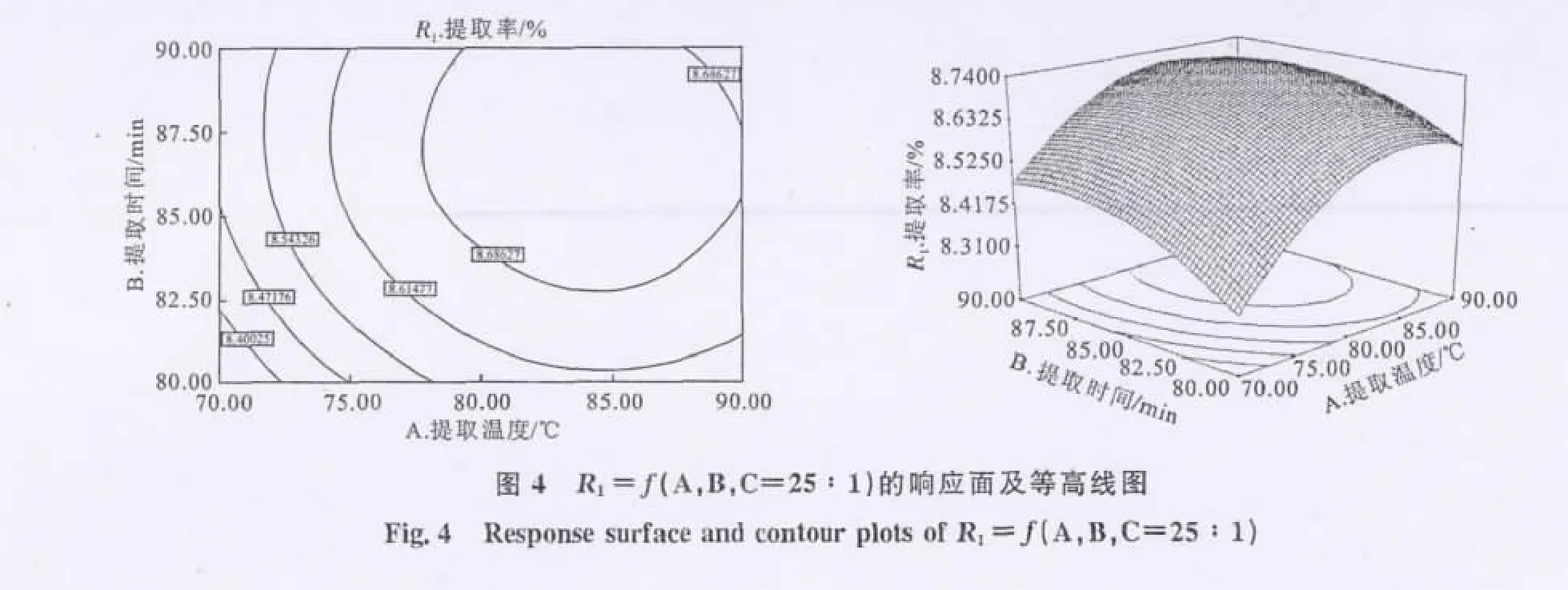
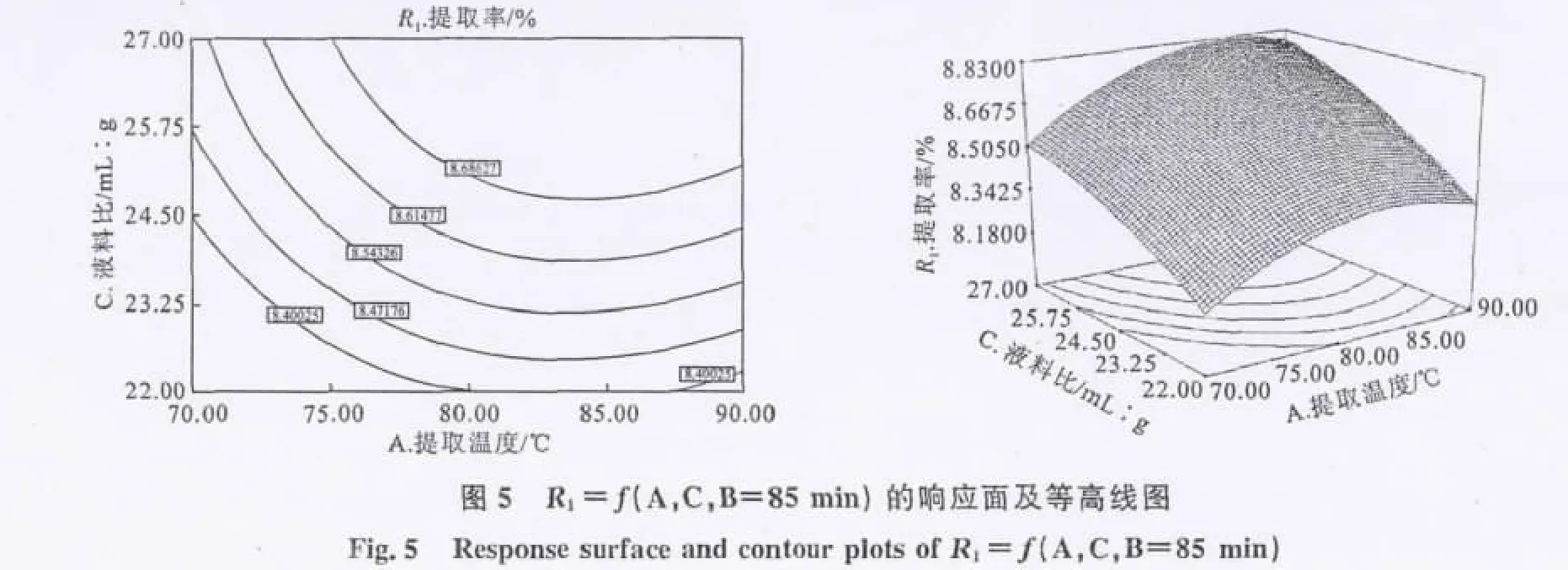
在等高线图中,等高线的形状可以反映两种因素对于结果的交互效应的影响,椭圆形表示两因素交互影响显著,圆形则相反。由图4和图5可以看出,其等高线曲线接近圆形,说明相对应的因素提取温度与提取时间、提取温度与液料比之间的交互作用不够显著,为较独立的影响因素。而由图6可以看出,其等高线曲线接近椭圆形,说明提取时间和液料比两因素之间交互作用较为显著,这与回归模型系数显著性检验结果相吻合。
综合回归模型和响应面分析结果,本实验中各因素对刺山柑水溶性多糖提取率的影响程度依次为:液料比>提取温度>提取时间,其中液料比、提取温度对提取率影响较大,而提取时间的影响较小。
2.2.4 刺山柑水溶性多糖提取工艺条件模型计算
利用修正后的回归模型计算得到刺山柑水溶性多糖的最佳提取工艺条件为:提取温度85.74℃,提取时间88.95min,液料比30∶1,预测最高多糖提取率为8.98%。
2.2.5 模型验证实验
为了验证响应曲面法模型的可靠性,在模型计算得到的优化工艺条件下提取刺山柑水溶性多糖,分别进行3次重复性实验,刺山柑水溶性多糖的提取率分别为8.92%、8.85%、8.89%,平均值为8.89%。实验结果与计算结果吻合较好,表明该模型对刺山柑水溶性多糖的提取具有良好的预测性。因此,确定基于响应曲面法优化的刺山柑水溶性多糖超声辅助提取工艺条件为:提取温度85℃,提取时间89min,液料比30∶1。
2.3 刺山柑水溶性多糖的抗氧化性能
对提取得到的刺山柑水溶性多糖粗提物进行抗氧化实验,考察其对羟基自由基(·OH)和超氧阴离子自由基(·)的清除能力,结果见图7。

图7 多糖对羟基自由基(a)和超氧阴离子自由基(b)的清除能力Fig.7 Capability to scavenge hydroxyl free radical(a)and superoxide anion free radical(b)of polysaccharides
由图7可以看出,刺山柑水溶性多糖对羟基自由基(·OH)和超氧阴离子自由基(·O)均有一定的清除作用。随着浓度的增大,刺山柑水溶性多糖对两种自由基的清除能力明显升高,当添加浓度为4mg·mL-1时,刺山柑水溶性多糖对羟基自由基(·OH)和超氧阴离子自由基(·O)的清除率均达到较高水平,分别为67.38%和41.12%。表明,刺山柑水溶性多糖具有一定的抗氧化活性。
3 结论
(1)在单因素实验的基础上,利用 Box-Behnken设计、响应曲面法以及 Design Expert 7.1.6 软件,建立了以刺山柑水溶性多糖提取率为响应值,以提取温度、提取时间、液料比为影响因子的二次多项式数学模型。根据模型以及验证实验最终确定超声辅助提取刺山柑水溶性多糖的优化工艺条件为:提取温度85℃、提取时间89min、液料比30∶1(mL∶g),在此条件下平均提取率为8.89%。
(2)采用响应曲面法优化得到的刺山柑水溶性多糖提取工艺科学合理,与实际结果吻合较好,为刺山柑水溶性多糖的提取提供了理论依据。
(3)抗氧化活性研究结果表明,刺山柑水溶性多糖对羟基自由基(·OH)和超氧阴离子自由基(·O-2)具有一定的清除作用,说明刺山柑水溶性多糖是一种有潜在开发价值的天然抗氧化剂。
[1]新疆植物志编辑委员会.新疆植物志(第二卷,第二分册)[M].乌鲁木齐:新疆科技卫生出版社,1995:35.
[2]栗茂腾,王艳婷,甘露,等.药用植物刺山柑快繁再生体系的建立[J].华中农业大学学报,2007,26(1):25-29.
[3]张瑜,张华,韩博,等.刺山柑多糖提取及其抗炎镇痛作用研究[J].石河子大学学报(自然科学版),2011,29(2):205-209.
[4]官波,郑文诚.山药多糖提取工艺的优化[J].食品与机械,2010,26(1):98-101.
[5]陈旋,张翼,张剑波,等.植物多糖的研究进展[J].中国新药杂志,2007,16(13):1000-1005.
[6]亓树艳,王荔,莫晓燕.大枣多糖的提取工艺及抗氧化作用研究[J].食品与机械,2012,28(4):117-120.
[7]朱良,张杰平,王一飞.繁枝蜈蚣藻多糖的抗氧化活性研究[J].食品科学,2008,29(3):453-456.
[8]尹秀莲,游庆红.超声辅助复合酶法提取桑黄多糖[J].食品与机械,2011,27(4):58-60.
[9]Claver I P,Zhang H H,Li Q,et al.Optimization of ultrasonic extraction of polysaccharides from Chinese malted sorghum using response surface methodlogy[J].Pakistan Journal of Nutrition,2010,9(4):336-342.
[10]Wang Y J,Cheng Z,Mao J W,et al.Optimization of ultrasonicassisted extraction process of Poria cocos polysaccharides by response surface methodology[J].Carbohydrate Polymers,2009,77(4):713-717.
[11]刘敏,郭丽梅,张丽.苯酚-硫酸法测定油松花粉多糖含量研究[J].时珍国医国药,2010,21(6):1526-1528.
[12]刘文玉,颜雪琴,林祥群,等.响应面法优化新疆胀果甘草多糖的提取工艺[J].食品工业科技,2012,33(23):288-291.
[13]王明艳,周琴,杨俊,等.响应面法同步优化裙带菜中蛋白和多糖提取工艺[J].食品科学,2012,33(24):66-71.
