GSK-3β、PTEN、PLK1在儿童急性髓系白血病中的表达及意义
2013-08-14徐酉华胡艳妮孙艳辉杨桂存
王 妍,徐酉华,胡艳妮,孙艳辉,金 鑫,杨桂存
(重庆医科大学附属儿童医院/儿童发育疾病研究省部共建教育部重点实验室/儿科学重庆市重点实验室/重庆市儿童发育重大疾病诊治与预防国际科技合作基地 400014)
急性白血病是儿童最常见的恶性肿瘤,传统的化疗和干细胞移植使儿童急性淋巴细胞白血病(ALL)的5年生存率达到80%,而急性髓系白血病(acute myeloid leukemia,AML)患儿的5年生存率只接近60%[1]。新型分子靶向化疗药物具有更强的抗肿瘤活性,且对正常细胞不良反应小。因此,寻找儿童AML的有效分子作用靶点至关重要。
糖原合酶激酶-3β(GSK-3β)是一种多功能的胞浆丝氨酸/苏氨酸蛋白激酶,研究证实它是治疗2型糖尿病[2]、阿尔茨海默病[3]的有效药物靶点,并且与癌症的发生、发展密切相关[4],但其在白血病中起激活作用还是抑制作用尚不明确。PTEN是第1个呈双专一性磷酸酶活性的抑癌基因,它作为GSK3β的上游基因,可调控GSK3β的表达[5]。在成人急性白血病中存在与张力蛋白同源的位于第10号染色体磷酸酶基因(PTEN)基因的表达缺失[6],但儿童 ALL患者骨髓标本中PTEN蛋白的表达高于非恶性疾病儿童[7]。Polo样激酶1(PLK1)是一种高度保守的丝氨酸/苏氨酸激酶,可促进有丝分裂的进程,其抑制剂BI2536已经进入AML的Ⅰ期临床实验阶段[8]。有研究认为GSK-3β可能是PLK1的负调控因子,在维系PLK1的功能方面发挥作用[9]。本课题组研究GSK-3β、PTEN、PLK1在儿童AML的表达和临床的关系,报道如下。
1 资料与方法
1.1 一般资料 实验组为2012年3~9月重庆医科大学附属儿童医院血液科收治的33例初诊AML患儿骨髓(M12例,M215例,M36例,M41例,M56例,M62例,M71例 ;中位年龄6岁2个月)。按形态学、免疫学、染色体、基因(MICM)分型标准诊断。根据患儿的临床以及实验室指标按危险度分型将实验组分为高危组、中危组、低危组,每组11例。对照组为10例骨科手术切除骨中抽吸的正常骨髓。
1.2 方法
1.2.1 标本处理 无菌操作取骨髓液2~3mL,肝素抗凝,聚蔗糖(FicoLL)液(相对密度1.077g/mL)分离骨髓单个核细胞(BMMNC),取约5×106个细胞,磷酸盐缓冲液(PBS)洗涤1次,混匀后-80℃保存。

表1 GSK-3β、PTEN、PLK1、β-actin的引物及目的片段大小
1.2.2 裂解骨髓单个核细胞 离心沉淀细胞,加1mL裂解液RL充分裂解细胞。分别收集水相中的总RNA及有机相中的总蛋白。
1.2.3 RT-PCR检验 按北京百泰克生物技术有限公司高纯总RNA快速提取试剂盒说明书提取RNA。按大连宝生物技术有限公司逆转录试剂盒PrimeScript®RT reagent Kit Perfect Real Time说明书进行反转录。GSK-3β、PTEN、PLK1、βactin的引物及目的片段大小见表1,PCR条件:95℃预变性5 min;然后95℃变性30s;GSK-3β、PLK1、β-actin均为55℃退火30s,PTEN 60℃ 退火30s,72℃延伸1min,30个循环;72℃延伸10min。
1.2.4 PCR产物分析 取PCR产物8μL在25~30g/L琼脂糖凝胶中电泳,100V电泳45min。用紫外投射仪观察并用粘胶成像仪照相,照片经Metamorphose Imaging Sight软件进行分析并读取吸光度值,分别取GSK-3β、PTEN、PLK1与actin吸光度比值(GSK-3β/actin、PTEN/actin、PLK1/actin)进行半定量分析。
1.2.5 酶联免疫吸附实验(ELISA) 采用ELISA双抗体夹心法对有机相中的 GSK-3β、P-GSK-3β水平进行定量分析。操作步骤严格按上海沪尚生物有限公司 GSK-3β及P-GSK-3β ELISA试剂盒使用说明书进行。选择450nm波长,在酶标仪上测定A值,以标准品A值绘制标准曲线。
1.3 统计学处理 采用SPSS17.0软件进行统计学分析,计量资料用表示,两组间的比较采用t检验;组间两两比较采用F检验;两组间的相关性研究采用Pearson相关检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 GSK-3βmRNA、PTEN mRNA、PLK1mRNA 在两组BMMNC的表达 实验组GSK-3βmRNA和PLK1mRNA的平均表达量较对照组的平均表达量高(P<0.05);实验组PTEN mRNA的平均表达量较对照组的平均表达量低(P<0.05)。见表2、图1。
表2 两组GSK-3β、PTEN、PLK1的PCR检测结果()

表2 两组GSK-3β、PTEN、PLK1的PCR检测结果()
组别 n GSK-3β 330.55±0.16 0.50±0.16 0.71±0.18对照组 100.41±0.09 0.63±0.25 0.57±0.18 P mRNA PTEN mRNA PLK1mRNA实验组0.012 0.012 0.040
2.2 GSK-3β蛋白及P-GSK-3β蛋白在两组BMMNC的表达情况 实验组GSK-3β蛋白的平均浓度较对照组的平均浓度高(P<0.05);实验组P-GSK-3β蛋白的平均浓度较对照组的平均浓度低(P<0.01)。见表3。
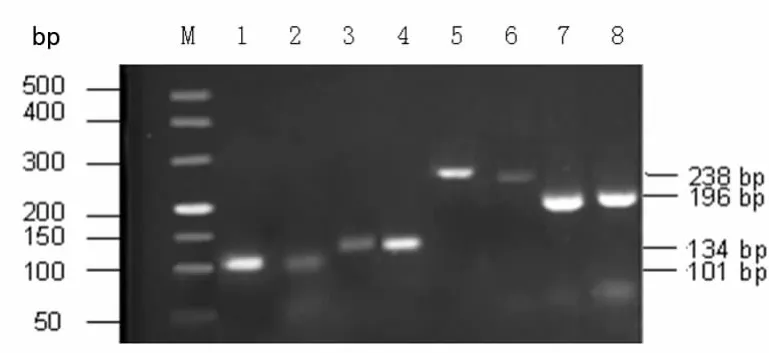
图1 两组 GSK-3β、PTEN、PLK1的PCR检测结果
表3 两组 GSK-3β、P-GSK-3β的ELISA检测结果(pg/mL,)

表3 两组 GSK-3β、P-GSK-3β的ELISA检测结果(pg/mL,)
组别 n GSK-3β P-GSK-3β 33 2553.40±358.59 294.17±40.53对照组 10 2204.02±283.52 350.53±53.32 P实验组0.014 0.002
2.3 GSK-3βmRNA、PTEN mRNA、PLK1mRNA、GSK-3β蛋白及P-GSK-3β与临床指标的相关性 实验组GSK-3βmRNA、PTEN mRNA、PLK1mRNA、GSK-3β蛋白 及 P-GSK-3β的表达与性别、肝脾是否肿大均无明显相关性,仅GSK-3β蛋白的表达与外周血白细胞计数增高呈正相关(P=0.011)。临床危险度高则 GSK-3βmRNA[高危组高于中危组(P=0.012),高危组高于低危组(P=0.000)]、GSK-3β蛋白[高危组高于中危组(P=0.012),高危组高于低危组(P=0.003)]、PLK1mRNA[高危组高于低危组(P=0.009)]表达相应增高。临床危险度高则P-GSK-3β表达减低[高危组低于中危组(P=0.047),高危组低于中危组(P=0.036)]。PTEN mRNA的表达与临床危险度分型无明显相关性。
2.4 GSK-3β与PTEN mRNA、PLK1mRNA表达的相关性本研究中 GSK-3βmRNA、P-GSK3β与 PTEN mRNA 的表达无明显相关性(r=-0.265,P=0.136;r=0.023,P=0.899),GSK-3β蛋白与PTEN mRNA的表达呈负相关(r=-0.415,P=0.016)。GSK-3βmRNA、GSK-3β蛋白与PLK1mRNA 的表达呈正相关(r=0.388,P=0.026;r=0.427,P=0.013),P-GSK3β与PLK1mRNA的表达无明显相关性(r=-0.319,P=0.070)。
3 讨 论
分子靶向药物在白血病治疗中发挥越来越重要的作用。近来研究表明GSK-3β为癌基因,使用GSK-3β的抑制剂BIO后TF-1、U937、K562和HL60细胞大量凋亡,但不影响正常造血干细胞的活性[10]。另有研究表明GSK-3β为抑癌基因,在APL中,ATO激活GSK-3β诱导 Mcl-1降解进而诱导NB4细胞分化[11]。本课题组前期研究表明儿童ALL中GSK-3β起癌基因的作用[12]。本实验结果显示儿童AML中GSK-3β在基因及蛋白水平均高表达,且表达水平与临床分型呈正相关,GSK-3β蛋白与外周血白细胞计数呈正相关;P-GSK-3β低表达,与临床分型呈负相关。因此,GSK-3β在儿童AML中可能同样起癌基因的作用。
本研究中儿童AML骨髓标本中PTEN mRNA的表达量明显低于对照组,其在儿童AML中可能起抑癌作用,但其表达量与临床指标无相关性。
PLK1目前被认为是肿瘤治疗过程中有价值的作用靶点,在AML动物模型中,PLK1的特异性的抑制剂NMS-P937联合阿糖胞苷口服后,可使其较好地长期存活[13];在成人AML中PLK1高表达,与不良预后呈明显正相关[14]。本研究中儿童AML骨髓标本中PLK1mRNA的表达量同样明显高于对照组,且其表达量与临床分型呈一定正相关,表明PLK1在儿童AML中可能同样起癌基因的作用。
肿瘤中抑癌基因PTEN主要通过两种作用途径调控GSK-3β的表达:一种为通过降低对PI3K/AKT信号通路的抑制,增强AKT对GSK-3β的抑制性磷酸化,GSK-3β的表达减少[5];一种为通过增强对cdc42活性的抑制,降低cdc42信号通过对GSK-3β的抑制作用,GSK-3β的表达增加[15]。本研究初步显示儿童AML中,GSK-3β蛋白与PTEN mRNA的表达呈现一定负相关。因此,儿童AML中,PTEN可能主要通过cdc42信号通路调控GSK-3β的转录后水平的表达。
在肺癌中,GSK-3β的抑制剂LiCl能增强PLK1的启动子活性,促进PLK1的表达,提示GSK-3β可能是PLK1的负调控因子[9]。而本研究结果显示 GSK-3βmRNA、GSK-3β蛋白与PLK1mRNA的表达呈正相关。本课题组前期研究表明儿童ALL中 GSK-3β高表达,且其正向调控 NF-κB信号通路[12]。Lin等[16]研究表明 NF-κB的亚基 RelA 通过直接与PLK1的启动子结合,增强PLK1的转录。因此,在儿童AML中,GSK-3β可能通过正向调控 NF-κB信号通路从而增强PLK1的转录。
综上所述,儿童AML中,GSK-3β和PLK1可能起癌基因的作用,而PTEN起抑癌基因的作用,三者在白血病中的作用机制有待进一步探讨,可能成为儿童AML危险度分型的指标及靶向治疗的有效作用靶点。
[1]Pui CH,Carroll WL,Meshinchi S,et al.Biology,risk stratification,and therapy of pediatric acute leukemia:an update[J].J Clin Oncol,2011,29(5):551-565.
[2]Gum RJ,Gaede LL,Koterski SL,et al.Reduction of protein tyrosine phosphatase 1Bincreases insulin-dependent signaling in ob/ob mice[J].Diabetes,2003,52(1):21-28.
[3]Gandy JC,Melendez-Ferro M,Bijur GN,et al.Glycogen synthase kinase-3β(GSK3β)expression in a mouse model of Alzheimer′s disease:a light and electron microscopy study[J].Synapse,2013,67(6):313-327.
[4]Miyashita K,Nakada M,Shakoori A,et al.An emerging strategy for cancer treatment targeting aberrant glycogen synthase kinase 3beta [J].Anticancer Agents Med Chem,2009,9(10):1114-1122.
[5]Al-Khouri AM,Ma Y,Togo SH,et al.Cooperative phosphorylation of the tumor suppressor phosphatase and tensin homologue(PTEN)by casein kinases and glycogen synthase kinase 3beta [J].J Biol Chem,2005,280(42):35195-35202.
[6]沈权,陈泽,刘旭萍,等.抑癌基因PTEN mRNA在白血病细胞中的表达及意义[J].中华血液学杂志,2005,26(8):493-496.
[7]Gauffin F,Diffner E,Gustafsson B,et al.Expression of PTEN and SHP1,investigated from tissue microarrays in pediatric acute lymphoblastic,leukemia[J].Pediatr Hematol Oncol,2009,26(1):48-56.
[8]Wäsch R,Hasskarl J,Schnerch D,et al.BI_2536-targeting the mitotic kinase Polo-like kinase 1(Plk1)[J].RecentResultsCancer Res,2010,184:215-218.
[9]周琼,白明,辛建保,等.氯化锂抑制A549细胞增殖及其对Polo样激酶1转录活性的影响[J].中国生物化学与分子生物学报,2006,22(10):832-838.
[10]Holmes T,O′Brien TA,Knight R,et al.Glycogen synthase kinase-3beta inhibition preserves hematopoietic stem cell activity and inhibits leukemic cell growth[J].Stem Cells,2008,26(5):1288-1297.
[11]Wang R,Xia L,Gabrilove J,et al.Downregulation of Mcl-1through GSK-3βactivation contributes to arsenic trioxide-induced apoptosis in acute myeloid leukemia cells.[J].Leukemia,2013,27(2):315-324.
[12]Hu Y,Gu X,Li R,et al.Glycogen synthase kinase-3βinhibition induces nuclear factor-κB-mediated apoptosis in pediatric acute lymphocyte leukemia cells[J].J Exp Clin Cancer Res,2010,29:154-159.
[13]Valsasina B,Beria I,Alli C,et al.NMS-P937,an orally available,specific small-molecule polo-like kinase 1inhibitor with antitumor activity in solid and hematologic malignancies[J].Mol Cancer Ther,2012,11(4):1006-1016.
[14]Renner AG,Dos Santos C,Recher C,et al.Polo-like kinase 1is overexpressed in acute myeloid leukemia and its inhibition preferentially targets the proliferation of leukemic cells[J].Blood,2009,114(3):659-662.
[15]Deevi R,Fatehullah A,Jagan I,et al.PTEN regulates colorectal epithelial apoptosis through Cdc42signalling[J].Br J Cancer,2011,105(9):1313-1321.
[16]Lin DC,Zhang Y,Pan QJ,et al.PLK1is transcriptionally activated by NF-κB during cell detachment and enhances anoikis resistance through inhibitingβ-catenin degradation in esophageal squamous cell carcinoma[J].Clin Cancer Res,2011,17(13):4285-4295.
