3,5,3′,5′联苯四甲酸金属配合物合成与表征
2013-08-11谭正德席鹏飞
谭正德,席鹏飞
(湖南工程学院 化学化工学院,湘潭411104)
0 前 言
对称芳烃多元羧酸是特种高分子材料合成的主要的中间体.以3,4,3′,4′-联苯四甲酸合成的全芳香族聚酰亚胺是迄今为止耐热耐高温度树脂,该聚合物具有良好的柔韧性,高强的物理性能;以3,5,3′,5′-联苯四甲酸合成高强度的枝状聚酰亚胺树脂,用作反渗透薄层复合膜材料;近年来对称芳烃多元羧酸研究范围逐渐拓展到超分子化学及超分子配体等领域.
目前主要的研究方法有以下两种:一是由四甲基联苯氧化法.该方法原料制备难,要采用昂贵稀土催化剂或反应条件苛刻;二是以对或间)苯二甲酸(酯)卤代物通过偶联反应制得联苯四甲酸,该方法反应条件苛刻,收率低于65%.如以苯二甲酸计,联苯四甲酸的总收率一般低于51%.
目前国内对3,5,3′,5′-联苯四甲酸的生产都是利用间苯二甲酸的硝化、氨基化生成5-氨基间苯二甲酸,然后通过偶合反应合成联苯四甲酸.
间苯二甲酸在混酸的条件下发生硝化反应生成5-硝基间苯二甲酸,用硫化钠还原5-硝基间苯二甲酸上的硝基生成5-氨基间苯二甲酸.制备5-氨基间苯二甲酸的重氮盐溶液,用硫酸铜、浓氨水与盐酸羟胺与氢氧化钠配制而成的还原溶液进行偶合反应.调节PH 即可得到3,5,3′,5′-联苯四甲酸.
本方法总收率达63%,操作简单,原料易得,反应条件成熟,反应生成的废渣、废水、废气比较少、具有一定的工业价值.
1 实验部分
1.1 实验药品

表1 实验药品名称及生产厂商
1.2 实验仪器

表2 实验仪器名称及生产厂商
1.3 实验方法
1.3.1 5-硝基间苯二甲酸的合成
向250ml的三口烧瓶中加入20.0g间苯二甲酸(0.12mol),60.0g浓硫酸(0.6mol,33.0ml),搅拌,慢慢滴加20.0g浓硝酸(0.3mol,14.0ml),保持温度50~60℃下,滴加,升温至95℃,反应2 h,然后冷却至室温,搅拌4h,再加入0~5℃水20.0ml,0~5℃下保温1h,析出固体产物.抽滤,洗涤,干燥,称量,计算产率.对产物进行Tm、IR表征.反应式如下:

1.3.2 5-氨基间苯二甲酸的合成
在三口烧瓶中加入5-硝基间苯二甲酸20.0g(0.0948mol),水90.0g,碳酸钠14.0g,搅拌加热溶解,然后滴加25%硫化钠48.0g,控制温度95℃左右,滴加完毕回流3h.反应完毕,趁热抽滤,收集滤液,在滤液中滴加2滴甲基橙指示剂,再滴加盐酸,使溶液呈橙色,析出沉淀,陈化1h,抽滤,洗涤滤饼,恒重,得5-氨基间苯二甲酸.然后抽滤,洗涤,干燥,称量,计算产率.对产物进行Tm、IR表征.反应式如下:

1.3.3 重氮盐的制备
将15g5-氨基间苯二甲酸溶解于226.0ml水加7.0g氢氧化钠的溶液,搅拌加入6.9g亚硝酸钠,冷却至10℃备用.在三口烧瓶中依次加入浓盐酸40.0ml,水60.0ml,冰浴冷却至0~5℃.缓慢滴加盐酸溶液,滴加完毕,继续搅拌20min,重氮化,冷藏,备用.反应式如下:

1.3.4 还原溶液的制备
向三口烧瓶中加入42.4g20%的硫酸铜溶液,和70.8ml浓氨水.另称取13.5g盐酸羟胺溶于56.0ml水,然后加入7.7g 20%氢氧化钠,冷却至10℃,将混合液加入铜氨络合离子溶液,冷却至10℃备用.
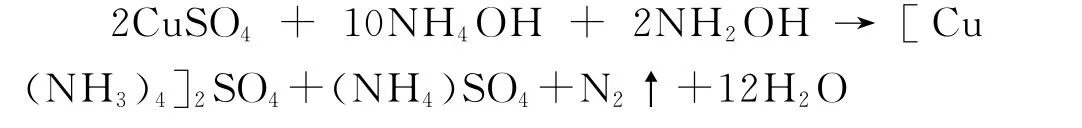
1.3.5 偶联反应
搅拌下,将重氮盐溶液滴加至还原溶液,维持温度0~5℃,滴加完毕,升温至95℃,然后冷却至室温,用盐酸调节pH为3.0~4.0,有沉淀生成,静置过夜,抽滤,洗涤,干燥.反应式如下:

1.3.6 3,5,3′,5′-联苯四甲酸的提纯
将偶联反应所得到的产物用DMF加热溶解,趁热抽滤,收集滤液.将滤液静置过夜,得黄色针状结晶.然后抽滤,洗涤,干燥,称量,计算产率.对产物进行Tm、IR表征.
1.3.7 金属镍的配合物的合成
将3,5,3′,5′- 联 苯 四 甲 酸 (1.00mmol,330.00mg)溶于20.00ml乙醇中,加入硝酸镍(0.50mmol,195.00mg)水溶液5.00mg,水浴加热的60℃,搅拌4h,冷却至室温,过滤.
1.3.8 金属锰的配合物的合成
将3,5,3′,5′- 联 苯 四 甲 酸 (1.00mmol,330.00mg)溶于20.00ml乙醇中,加入氯化锰(0.50mmol,117.00mg)水溶液5.00ml,水浴加热到60℃,搅拌4h,冷却至室温,然后抽滤,洗涤,干燥,称量,计算产率.对产物进行Tm、IR表征.
1.3.9 金属锌的配合物的合成
将3,5,3′,5′- 联 苯 四 甲 酸 (1.00mmol,330.00mg)溶于20.00ml乙醇中,加入氯化锌(0.50mmol,122.00mg)水溶液5.00ml,水浴加热到60℃,搅拌4h,冷却至室温,然后抽滤,洗涤,干燥,称量,计算产率.对产物进行Tm、IR表征.
1.3.10 金属锆的配合物的合成
将3,5,3′,5′- 联 苯 四 甲 酸 (1.00mmol,330.00mg)溶于20.00ml乙醇中,加入氧氯化锆(0.50mmol,161.12mg)的水溶液5.00mg,水浴加热到60℃,搅拌4h,冷却至室温,然后抽滤,洗涤,干燥,称量,计算产率.对产物进行Tm、IR表征.
1.3.11 金属铜的配合物的合成
将3,5,3′,5′- 联 苯 四 甲 酸 (1.00mmol,330.00mg)溶于20.00ml乙醇中,加入氯化铜(0.50mmol,75.24mg)水溶液5.00ml,水浴加热到60℃,搅拌4h,冷却至室温,然后抽滤,洗涤,干燥,称量,计算产率.对产物进行Tm、IR表征.
2 结果及讨论
本文以间苯二甲酸为原料,经硝化、还原、重氮化-偶联反应制备3,5,3′,5′-联苯四甲酸,对硝化、还原,重氮化-偶联反应中各种反应条件的影响进行探讨.
2.1 硝化反应
反应温度95℃,间苯二甲酸与硫酸的物质的量比为1.0∶5.0的条件下,探讨了硝酸与间苯二甲酸的物质量比对硝化反应的影响,见表1.

表1 硝化反应的影响因素及实验结果
在间苯二甲酸与硫酸的物质的量比为1.0:5.0,反应温度95℃的条件下,探讨了反应时间对硝化反应的影响,见表2.

表2 硝化反应时间对结果的影响
表l表明:n(间苯二甲酸)∶n(浓硝酸)=1∶(1.75~2.25)时,硝化产物收率增长较快;当n(间苯二甲酸)∶n(浓硝酸)=1∶2.5时,硝化产物收率达到90.0%以上,继续增加硝酸用量,但硝化产物的收率无影响.其原因反应带到平衡,并且增加硝酸的用量还有可能导致副产物的增加.
表2表明:随反应时间的延长,硝化产物收率也增加,当反应时间达到2h后,硝化产物收率无变化.因此硝化反应最佳mol比为n(间苯二甲酸)∶n(硫酸)∶n(浓硝酸)=1.0∶5.0∶2.5,反应温度95℃,反应时间为2h.
2.2 还原反应
采用硫化物还原法,同时探索了5-硝基间苯二甲酸与硫化钠的摩尔比对还原反应的影响.

表3 硫化钠用量对还原反应的影响
由表3可知随着硫化钠与5-硝基间苯二甲酸的物质的量比增加,还原反应的收率相应地增加,当二者的物质的量比为1.1∶1.0时,收率最高,达96.0%,继续增加硫化钠的用量时,收率反而下降.
2.3 重氮化反应
2.3.1 盐酸用量对重氮化应的影响

表4 盐酸用量对反应的影响
表4表明:随着盐酸的用量增加,重氮盐溶液由浑浊向澄清逐步转化,颜色由深变浅.其原因是盐酸用量增加,氢离子效应增强.当氯化氢∶5-氨基间苯二甲酸为5∶1时,重氮盐溶液呈红黄色澄清状,继续增加盐酸用量,过量的盐酸对偶联反应造成不利的影响.
2.3.2 亚硝酸钠用量的选择
亚硝酸浓度决定着反应体系中游离的氨基能否快速的反应和减少副反应生成.本实验在保持n(5-氨基间苯二甲酸)∶n(氢氧化钠)∶n(氯化氢)=1.0∶2.1∶5.0情况下,考察了不同亚硝酸钠用量对重氮化反应的影响.当亚硝酸钠与5-氨基间苯二甲酸的物质的量比依次为1.0、1.1、1.2、1.3增加时,重氮盐溶液由浑浊向澄清逐步转化,颜色由深变浅,棕色向红黄色变化.当n(亚硝酸钠)∶n(5-氨基间二甲酸)=1.2∶1.0时,可以取得较好的效果;继续加大的亚硝酸钠用量,多余的亚硝酸钠对下一步反应产生不利影响.

表5 亚硝酸钠用量对反应的影响
2.4 偶联反应
在重氮盐的还原偶联反应中,采用盐酸羟胺还原,氢氧化钠调节酸碱度.通过研究不同投料比对反应收率的影响发现,当氢氧化钠和盐酸羟胺的物质的量投料比为1∶1时.收率73.1%~78.2%.
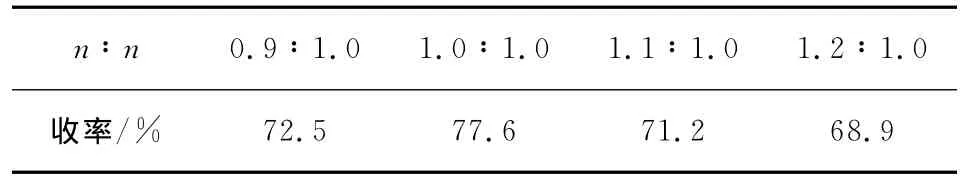
表6 氢氧化钠与盐酸羟胺的比例对反应的影响
2.5 5-硝基间苯二甲酸的表征
2.5.1 5-硝基间苯二甲酸红外光谱分析

图1 5-硝基间苯二甲酸红外光谱图
图中2950cm-1处的尖峰是苯环上C-H伸缩振动吸收峰,700cm-1处是-OH的面外弯曲,1210 cm-1处是C-O伸缩吸收峰,920cm-1处是-OH面外弯曲振动峰,1150cm-1,1210cm-1是苯环骨架振动吸收峰,760cm-1是苯环邻二取代特征峰,1710 cm-1-C=O的伸缩振动吸收峰.
2.5.2 5-硝基间苯二甲酸元素分析

表7 5-硝基间苯二甲酸元素分析
2.6 5-氨基间苯二甲酸的表征
2.6.1 5-氨基间苯二甲酸元素分析

表8 5-氨基间苯二甲酸元素分析
2.7 3,5,3′,5′-联苯四甲酸的表征
2.7.1 3,5,3′,5′-联苯四甲酸红外光谱的分析

图2 3,5,3′,5′-联苯四甲酸红外光谱图
图中3076cm-1处的尖峰是苯环上C-H伸缩振动吸收峰,2553cm-1处宽且强的吸收峰是-OH的伸缩振动吸收峰,1703cm-1处是苯环上C=O伸缩振动吸收峰,689cm-1处是-OH的面外弯曲,1221cm-1、1281cm-1处是C-O伸缩吸收峰,925 cm-1处是-OH 面外弯曲振动峰,1108cm-1、1146 cm-1、1221cm-1、1281cm-1是苯环骨架振动吸收峰,并说明有4个取代基,1609cm-1C=C骨架振动吸收峰,760cm-1是苯环邻二取代特征峰
2.7.2 3,5,3′,5′-联苯四甲酸元素分析

表9 3,5,3′,5′-联苯四甲酸元素分析
2.8 产物的Tm表征

表10 3,5,3′,5′-联苯四甲酸 Tm值
3 结论
以间苯二甲酸为原料经硝化、还原和重氮化-偶联等一系列反应合成了3,5,3′,5′-联苯四甲酸,总收率>63.2%.以间苯二甲酸为原料,经硝化、还原两步反应制备了5-氨基间苯二甲酸,两步反应收率达86.4%;硝化反应在反应温度95℃.反应时间2h,n(间苯二甲酸)∶n(硫酸)∶n(硝酸)=1.0∶5.0∶2.5时,硝化反应收率达90.0%;还原反应在反应温度90-98℃,反应时间3h,n(硫化钠):n(5-硝基间苯二甲酸)=1.1∶1.0时,还原反应收率达96.0%;5-氨基间苯二甲酸经重氮化.偶联反应合成3,5,3′,5′-联苯四甲酸,当n(氢氧化钠)∶n(盐酸羟胺)=l∶l时,偶联反应收率为73.1%-78.2%.该合成方法原料易得、操作简单,具有较好的工业价值.
[1] 杨建国,段启伟,何鸣元.3,3′,4,4′-联苯四甲酸及其衍生物的合成与应用[J].精细化工,2001,18(8):284-288.
[2] 焦 岩,方志杰,姜宇华等.制备2,2′,4,4′-联苯四甲酸的新方法[J].应用化学,2007,24(7):844-846.
[3] 陈宏基,徐剑丰.5-氨基-2,4,6-三碘异酞酸的合成[J].化学试剂,1997,19(6):378-380.
[4] 刘志雄,程清蓉.3,5,3′,5′-联苯四甲酸的合成[J].化学试剂,2011,33(5),469-472.
[5] N.Misuhary,I.Kazutaka,E.Masanao,Efficient Red Electro1uminescence From New Europium Complex[J].Chem.Lett.,2001:320-321.
[6] M.Kawa and J.M.J.Fréchet,Enhanced Luminescence of Lanthanide Within Lanthanide-cored Dendrimer Complexes[J].Thin Solid Films,1998,331:259-263.
[7] X.Jiang,A.K.Y.Jen,G.D.Phelan,D.Huang,T.M.Londergan,L.R.Dalton,R.A.Register,Efficient Emission From a Europium Complex Containing Dendron-substituted Diketone ligands[J].Thin Solid Films,2002,416:212-217.
[8] Sun M.,Xin H.,Wang K.Z.,Bright and Monochromic Red Lightemitting Electro1umine-scence Devices based on a New Ultifunctional Europium Ternary Complex[J].Chem.Commun.,2003(6):702-703.
[9] T.Yasuda,I.Yamaguchi,T.Yamamoto,A new Soluble 1,10-phenanthroline-containing-conjugated Polymer:Synthesis and Effect of Metal Complexation on Optical Properties[J].Adv.Mater.,2003,15:293-296.
[10]W.G.Zhu,X.Q.Wei,M.X.Zhu,Red Electro1uminescence and Photo1uminescence From Novel Binuclear Europium Complex with Squaric Acid Ligand[J].Chin.Chem.Lett.,2001,12:921-924.
[11]D.Q.Gao,Z.Q.Bian,K.Z.Wang,Synthesis and E-lectro1uminescence Properties of an Organic Europium Complex[J].J Alloys and Compounds,2003,358:188-192.
