医院药品质量控制与现有药品质量监管体系不足的探讨
2013-08-10吴颖坤上海交通大学医学院附属新华医院上海200092
黄 源,沈 烽,张 健,吴颖坤,金 ,梁 斌(上海交通大学医学院附属新华医院,上海 200092)
目前市场80%的药品经医院用于各类患者,要掌控好这类药品的质量问题,则相关的统计与分析就显得意义重大。本文就2009-2011年我院药品质量登记情况进行回顾性统计与分析,对统计结果进行客观阐述,并对药品从质量监管、生产、流通到医院患者使用等环节中存在的各自责任情况与作用进行分析,并阐述各环节在药品质量控制上的主要作用与意义。只有经各流通环节的相互配合、相互制约,确保整个药品流通环节药品质量的可控,才可能最终将合格药品用于合适的病患。
1 2009-2011年我院药品质量登记统计分析
1.1 分析入库药品拒收原因
药品质量直接影响到临床疗效,为确保医院入库药品的质量,2005年开始我院将条形码应用于药品入库验收上,严把入库药品验收关,杜绝信息与实物不符的药品流入医院,确保在院药品物流信息的准确,并对我院2011年入库验收过程中药品拒收的原因进行分析,详见表1。
1.2 对质量问题进行分类描述
对院内药品质量问题按发生于出厂前、后归为2类。凡出厂前已经存在的药品质量问题称为A类药品质量问题[1],如含异物、粒度不符、装量差异等,并定为严重质量问题,应引起各方重视。这类问题对生产企业来说,可通过改进工艺、增加检测设备而尽量杜绝。凡出厂后产生的质量问题称为B类药品质量问题,如破损、输液吊环断裂、片剂色差等,需及时将该类信息反馈给供应商或生产企业[2],为今后改进药品包材提供客观数据支持。A、B类药品具体情况见表2。
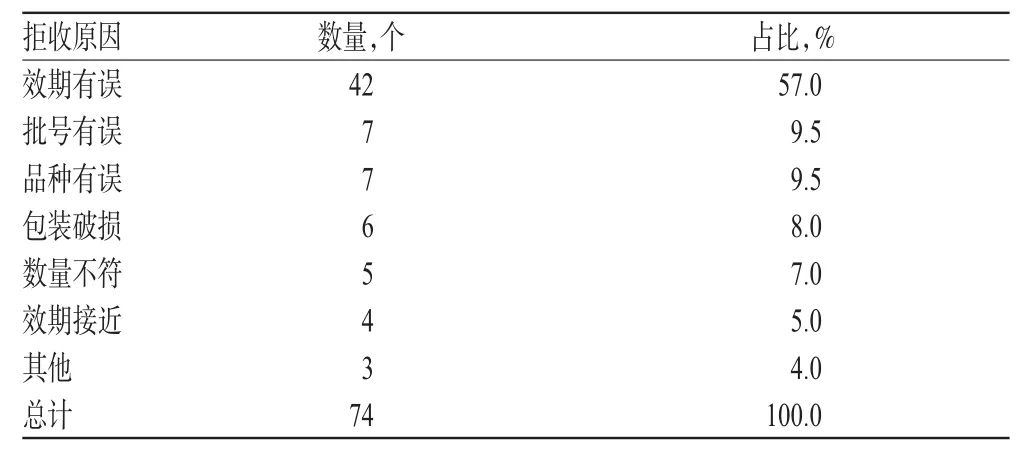
表1 2011年我院入库药品拒收原因分析Tab1 Cause analysis of the rejected drug in our hospital in 2011
1.3 我院药品质量登记综合数据结果分析
2009-2011年我院药品质量登记综合数据比较结果见表3。

表2 A、B类药品质量问题常见情况统计Tab2 Statistics of common type A and B of drug quality problems
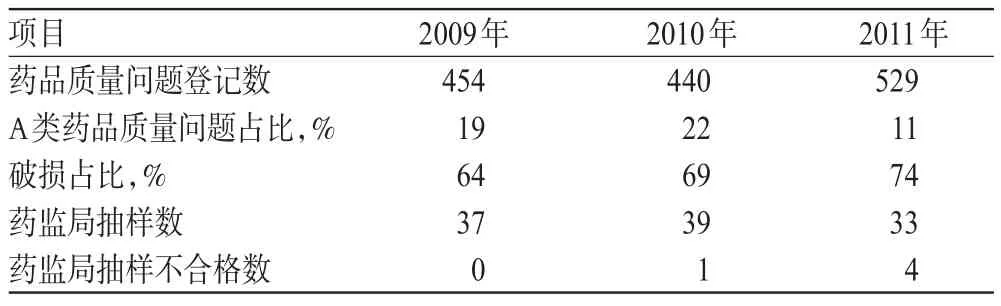
表3 我院2009-2011年药品质量登记综合数据比较Tab3 Comparison of comprehensive data of drug quality in our hospital during 2009-2011
通过表3可以看出,我院每年药品质量登记个数(发生1次记为1,与该批药品数量无关)在提高,A类药品质量问题数2011年有明显下降,说明生产企业对出厂前的药品质量问题控制在逐年加强;药品破损数在逐年提高,提示从生产企业出厂后运输、供应商储运直至医院内部药品的运转,都需进行针对性的控制,应加强现代物流管理,减少每箱手工搬运次数,以降低由于药品搬运不当造成的破损。
如果同一品种破损率增加,需及时反馈给供应商或生产企业,通过改进外包装或容器材质来减少破损。食品药品监督管理局(以下简称药监局)每年针对每家医院的规模和性质有一定的抽样比例,根据表3分析,2011年抽样数有一定程度的下降,但是不合格药品的检出率在增加,说明药监部门的抽样存在一定的偶然性与随机性。不合格样本原因为装量差异、饮片含量不符、含异物以及溶液澄清度不符。前3项,按药品质量分类为A类质量问题;澄清度不符(色差)可算是B类药品质量问题,可能与运输和储存有关。
由于药品A类质量问题相对于B类质量问题更严重,故为了说明近3年来我院A类药品质量问题变化趋势,对2009-2011年我院每年A类质量问题的不同类别占比进行横向比较,见表4。
由表4可见,2011年A类药品质量问题与之前比较大多有一定程度的降低,说明生产企业以及供应商提供的药品质量的可靠性有了提升。
2 现有药品监督管理部门对药品质量监控存在的不足
2.1 抽查性检验[3]存在相应的被动性与偶然性
药监局每次例行抽样具有被动性与偶然性,笔者认为应该建立黑名单制度,如第1次出现A类质量问题药品时,需将该品种列入黑名单;下次应继续抽样,如再次出现同样质量问题时可吊销该药品的生产批文,同时对该生产线药品《生产质量管理规范》(GMP)进行复审。建立类似于药品不良反应申报的“药品质量信息申报平台”,及时掌握药品质量现状,并根据各医院、供应商申报的药品质量信息进行分析,科学地实施抽样计划,使抽验药品具有总体代表性[4]。
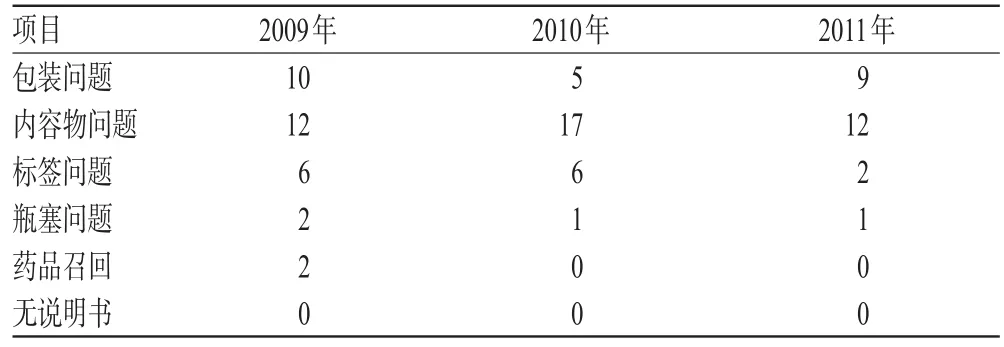
表4 我院2009-2011年A类药品质量问题统计分析(占比,%%)Tab4 Statistical analysis of type A drug quality problems in our hospital form 2009 to 2011
2.2 抽样回馈结果时间周期过长
为了说明该情况,笔者对我院2010-2011年被抽样药品进行统计分析,抽样天数根据药监局抽样报告日期与相应药品检验部门(药检所)对该药出具报告的日期进行计算得出。我院2010-2011年被抽样品种从抽样开始到出具检验报告时间的天数统计见表5。

表5 2010-2011年我院被抽检药品反馈报告时间统计分析Tab5 Statistical analysis of samples inspection reports in our hospital from 2010 to 2011
根据表5统计结果可见,平均报告天数为81天,药检所属地涉及全国13个省、市、自治区,最远的样品送到了海南、甘肃、吉林等地(该信息来源于检验报告上的印章)。对于抽样结果,回馈时间太长,大多数样品出具报告时间在2个月以上。建议利用现代化管理软件,加强检验报告时限管理,以便及时停用不合格药品[5]。中国版图幅员辽阔,天南地北,温差较大,在运送这些药品时,被抽检药品是否会受运输、气候温度的影响?是否今后可考虑就近原则,尽量安排在周边省会城市进行检查,以免路途之遥,还可节省费用?另外,我院目前库存量基本控制在1周半左右,当抽样不合格药品反馈信息送至医院时,该批次的药品大多已用完,那么真正受害的还是患者。
2.3 抽样不合格药品后处罚对象值得商榷
现有药品监督管理部门对药品质量问题的处罚方式是:从生产企业、供应商到医院,如果哪个单位抽检不合格,药监部门对相应单位按《药品管理法》进行罚款。笔者认为对于药品抽样不合格的处罚,不能简单行事,应区分不合格药品质量问题的类型:如果是A类质量问题,应立即对生产企业进行反馈与调查,生产企业需及时进行整改;如果是B类质量问题,可能是运输和储存过程不当造成的,那么被检出供应商或医疗机构应对不合格药品负责,药监部门对其进行必要的处罚。通过处罚,来督促供应商和医疗机构及时改进,真正使得当事人心服口服。
3 讨论
3.1 药品身份编码、外包装等的图片信息应纳入监管层管理范围
近年来,随着现代化设备的大量引入,医院药品调配自动化程度的大幅提高,从而对保障患者的用药安全起到非常大的作用。同时,每个药品的信息需要也更加全面。一个新药登记注册时,药监部门须对该药统一编制一个唯一码(该码可包含药理分类、生产企业、剂型、规格等相应信息),如身份证一样,需保存该药的外观以及内在个体的图像资料,并将这些信息在相关政府网站上公布。这样医院在引进任何药品时,都能通过相应网站对所需数据进行下载,并将下载的药品身份信息和图像信息用于医院药品的编码与药品核对上,避免现在各家医院各自建立药品图像库的现象。
由于药品种类繁多,同一生产企业不同剂量的同一药品或同种剂量不同数量的药品应有不同的身份号码,以确保唯一性。由于具有唯一性,故药品身份号码可以应用于监管层药品的监管,各省市“医保”部门利用该码来解决“医保”药品与医院对码问题,药品调价部门利用该码进行调价,药品招标部门利用该码对药品进行招投标,医院利用该码可以上网同步查核相关新进药品信息,从而真正实现使生产企业减负,并让利于患者。
3.2 对于A类药品质量问题的处罚对象需把握准确
A类药品质量问题如含异物、粒度不符等在出厂前就已经存在的药品质量问题,如在医院抽样中被检出,那么监管部门就不应该对医院进行处罚,因为医院同时也是受害者,将面临着被患者投诉的风险。应严厉处罚生产该类药品(劣药)的企业,也就是处罚导致不合格药品产生的直接责任者[6],通过处罚来震慑生产企业,使其严格按照GMP标准进行药品生产,而不应将医院纳入处罚对象,那是无济于事的。
3.3 药品质量信息平台的建立
医院作为药品流通环节的最主要环节,在使用过程中掌握着大量与药品质量问题相关的重要信息,监管部门如果将各医院的这类信息通过专门平台进行统一申报,并对每年医院反馈的药品质量问题信息进行整理分析,相信对生产企业GMP复审等,都有第一手的客观的数据依据,可为药品质量问题的监管打通另一途径。例行的药品质量抽查是被动的,且有一定的偶然性,而医院主动上报药品质量问题具有全面性。在该问题上药监部门应积极鼓励医院上报药品质量问题,而不应完全通过罚款来处理同样作为受害者的医院。
3.4 药品质量控制中各环节担当的角色
药品监督管理部门、生产企业、医药经销企业、医院等是药品管理、生产、流通以及使用的相关环节,都有各自的分工和职责。药品监督管理部门主要承担着药品生产企业和药品经销企业的GMP和《药品经营质量管理规范》(GSP)的审核与复审工作,并从事证照发放后从生产企业到使用环节的药品质量的监督和管理工作;生产企业必须严格按照GMP要求从事药品生产工作,确保出厂药品质量的可靠;药品经销企业必须严格按照GSP要求从事药品流通环节的工作,并通过科学化的现代化物流模式,为医院药品供应提供优质服务;医院通过验收经GMP企业生产以及GSP企业经营的药品,只需验收外观以及名称、规格、数量等即可,且医院主要的工作是保证临床药品的供应,确保医院用药安全与合理。对于一个药品从生产开始到患者使用,整个质量控制环节的过程应该是由紧至松,而绝非越来越严格;如果越来越严的话,那么终端客户就变成了全能选手,需掌握生产企业质量控制、经营企业物流管理等的各项技术,甚至在应用于患者时也需从头到尾再来一遍质量审核。这样显然整个环节就无诚信可言,也没必要。
[1]沈烽,张健,王兰珍,等.药品质量数据分析在医院药库管理中的应用[J].中国药房,2009,20(10):760.
[2]林燕.医院药品质量管理体会[J].海峡药学,2011,23(11):261.
[3]苏姣.我国的药品质量管理和药品的监督检验[J].黑龙江医药,2011,24(5):758.
[4]赵勇.对军队药品抽验体会[J].解放军药学学报,2011,27(6):560.
[5]黄志禄,郭志鑫,丛佳,等.对规范国家药品评价抽验不合格报告书传递工作的几点建议[J].中国药事,2010,25(10):999.
[6]许国政.《药品管理法》缺陷与完善之研究进展[J].中国药房,2009,20(10):731.
