平菇及其培养料中5种拟除虫菊酯类农药的残留消解动态
2013-08-07樊中臣操海群吴祥为花日茂岳永德
樊中臣,唐 俊,操海群,*,吴祥为,花日茂,汤 锋,岳永德
(1.安徽农业大学植物保护学院,安徽省农产品安全重点实验室,安徽 合肥 230036;2.安徽农业大学资源与环境学院,安徽省农产品安全重点实验室,安徽 合肥 230036;3.国际竹藤中心,北京 100080)
随着生活水平的不断提高和改善,人们对食品安全的要求越来越高,因此食用菌产品中农药残留问题越来越受到重视[1-2]。在食用菌生产中,使用化学农药进行病虫害防治,以及使用含有农药残留的农作物秸秆、木材等来栽培食用菌,可能会带来食用菌产品中不同程度的农药残留污染,危害人们的身体健康[3-6]。
平菇(Pleurotus ostreatus)是目前栽培面积广、消费量最大的食用菌品种之一,具有重要的食用和药用价值[7]。解永刚等[8]研究发现,用500g/L异菌脲670倍液采用拌料法施药后,培养料中异菌脲消解半衰期为52.16d;张浩等[9]报道了多菌灵和噻菌灵在平菇子实体和培养料中半衰期分别为2.24、2.58d和5.01、6.21d;在平菇子实体中的消解速度要快于培养料;最后一次采样测定平菇子实体和培养料中的残留量均低于各自检出限。
拟除虫菊酯类农药是一类广谱、高效、低毒杀虫剂,广泛用于农业生产中的害虫防治[10-12],目前有关拟除虫菊酯类农药在食用菌上的消解动态的报道甚少。本实验在确证平菇培养料中联苯菊酯、甲氰菊酯、高效氟氯氰菊酯、高效氯氰菊酯和溴氰菊酯等5种拟除虫菊酯类农药多残留分析方法的基础上,研究了供试农药在平菇及其培养料中的残留消解动态规律,并探讨了培养料中供试农药残留向平菇子实体中转移的规律。研究结果将为指导拟除虫菊酯类杀虫剂在食用菌栽培过程中的合理使用及其健康风险评估提供科学依据。
1 材料与方法
1.1 材料与试剂
平菇:安徽农业大学植保学院食用菌基地自种。
平菇培养料:原料为85%棉籽壳、2%石膏粉、1.5%熟石灰和1.5%过磷酸钙,在0.10~0.15kPa,121~126℃高温灭菌180min。
乙腈、正己烷、乙酸乙酯、石油醚(均为分析纯) 江苏强胜化工有限公司;无水硫酸钠、氯化钠(均为分析纯) 中国医药集团上海化学试剂公司;弗罗里硅土(60~100目) 德国Riedel-De Haen公司;实验用水均为艾科浦超纯水系统所制纯水。
农药标准品:联苯菊酯(纯度≥98.3%)、甲氰菊酯(纯度≥99.0%)、氰戊菊酯(纯度≥99.8%)、溴氰菊酯(纯度≥98.5%)、高效氯氟氰菊酯纯度≥97.0%) 国家农药质检中心;高效氯氰菊酯(纯度≥99.0%) 天津农药股份有限公司。
供试农药:25g/L联苯菊酯乳油 苏州富美实植物保护剂有限公司;20%甲氰菊酯乳油 浙江省东阳市金鑫化工有限公司;2.5%高效氯氟氰菊酯乳油 通州正大农药化工有限公司;45g/kg高效氯氰菊酯乳油 威海韩孚生化药业有限公司;25g/L溴氰菊酯乳油 拜耳作物科学(中国)有限公司。
1.2 仪器与设备
Agilent 6890气相色谱仪(带电子捕获检测器(ECD) 美国安捷伦科技有限公司;KQ-600型超声波清洗器 昆山市超声仪器有限公司;ZD-2型调速多用振荡器 江苏省金坛市国胜实验仪器厂;TPZ-5型多管架自动平衡离心机 长沙湘仪离心机仪器有限公司;EYELAN-1100型旋转蒸发仪 上海爱郎仪器有限公司;SQ-2119B多功能食品加工机 上海帅佳电子科技有限公司。
1.3 方法
1.3.1 标准溶液的配制
准确称取农药标准品,配制成质量浓度为1000mg/L的供试农药单标贮备液。分别移取联苯菊酯、甲氰菊酯和高效氯氟氰菊酯单标贮备液0.1mL,高效氯氰菊酯和溴氰菊酯单标贮备液0.2mL置于10.0mL容量瓶中,正己烷定容至刻度,得到拟除虫菊酯类农药混合标准贮备液(联苯菊酯、甲氰菊酯和高效氯氟氰菊酯质量浓度为10.0mg/L,溴氰菊酯和高效氯氰菊酯质量浓度为20.0mg/L),逐级稀释配制成不同供试质量浓度的混合标准工作溶液。
1.3.2 供试农药在平菇上的消解动态实验
根据《农药登记残留田间实验标准操作规程》要求[13],在植物保护学院食用菌种植大棚中开展残留消解动态实验(2009年12月-2010年1月)。栽培条件:菌丝体培养阶段温度在25℃左右,黑暗条件下生长,生长期为25~30d;产菇期培养料水份在65%~75%之间,温度在10~15℃之间,光照为散射光,大约10~14d子实体成熟。
当平菇子实体直径长至2cm左右时,将供试农药兑水稀释750倍(在蔬菜上推荐施用质量浓度的1.5倍)均匀喷雾,至子实体表面有水珠滴下。每个处理3次重复,每个重复10袋料(每袋料约1kg)。分别于施药后2h及1、2、4、5、6、9、10、14、21d采集平菇样品。采集方法为多点随机取样法,每次每个重复采集平菇样品1.0kg左右,混匀缩分,各取200g,置于-20℃冰箱中保存,供残留分析。
1.3.3 供试农药在平菇培养料中的消解动态及其向平菇子实体的转移实验
实验于2010年3—7月在植物保护学院食用菌种植大棚进行。栽培条件:菌丝体培养阶段温度在25℃左右,黑暗条件下生长,生长期为25~30d;产菇期培养料水份在65%~75%之间,温度在10~36℃之间,光照为散射光,大约3~7d子实体成熟。
按照各供试农药在蔬菜上推荐用量的1.5倍(稀释750倍),于培养料灭菌前喷雾,并混合均匀,另设空白对照。每个处理3次重复,每个重复10袋料(每袋料约1kg)。分别在施药后2h,灭菌后2h及1、3 、5、7、9、l4、21、28、42、62、83、103d采集培坡养料样品。在施药后42、62、83、103d,即分别为第1茬、第2茬、第3茬和第4茬出菇期间,同步采集平菇和培养料样品,供残留分析。
1.3.4 样品分析
提取:10.0g样品中加入5mL水和20mL乙腈,机械振荡提取10min,超声波振荡提取10min;加入6g NaCl,振摇1min,4000r/min离心5min;取上清液过无水硫酸钠漏斗;所剩基质再加入20mL乙腈,超声波提取15min,离心5min,取上清液过无水硫酸钠漏斗;合并提取液于40℃条件下旋转浓缩近干,待净化。
净化:玻璃层析柱中自下而上依次装入少许脱脂棉、2cm无水硫酸钠、4g 5%的水脱活的弗罗里硅土和2cm无水硫酸钠,敲实;10mL石油醚预淋洗,上样;用40mL石油醚-乙酸乙酯(98:2,V/V)淋洗,前10mL弃去;收集淋洗液于38℃条件下浓缩至干,正己烷定容至10mL,待测定。
测定:HP-5毛细管气相色谱柱(30mm×0.25mm,0.25μm);程序升温:60℃保持1min,以30℃/min升温到180℃,再以5℃/min升温到250℃,保持5min,最后以3℃/min到280℃,保持1min;进样口温度:250℃;检测器温度:300℃;载气:高纯氮气(99.999%);流速:1.5mL/min;不分流进样;进样体积:2μL。
1.3.5 数据处理
实验数据的统计分析均采用唐启义等[14]的DPS统计软件。一级动力学方程采用文献[15]的方法,计算公式如下:

式中:K为消解速率常数/d-1;C0为供试农药的初始量/(mg/kg);Ct为t时刻供试农药的残存量/(mg/kg);当供试农药消解50%时,即Ct=C0/2时,所需的时间即为消解半衰期,以t1/2表示。
2 结果与分析
2.1 平菇培养料中拟除虫菊酯类农药多残留分析方法的确证
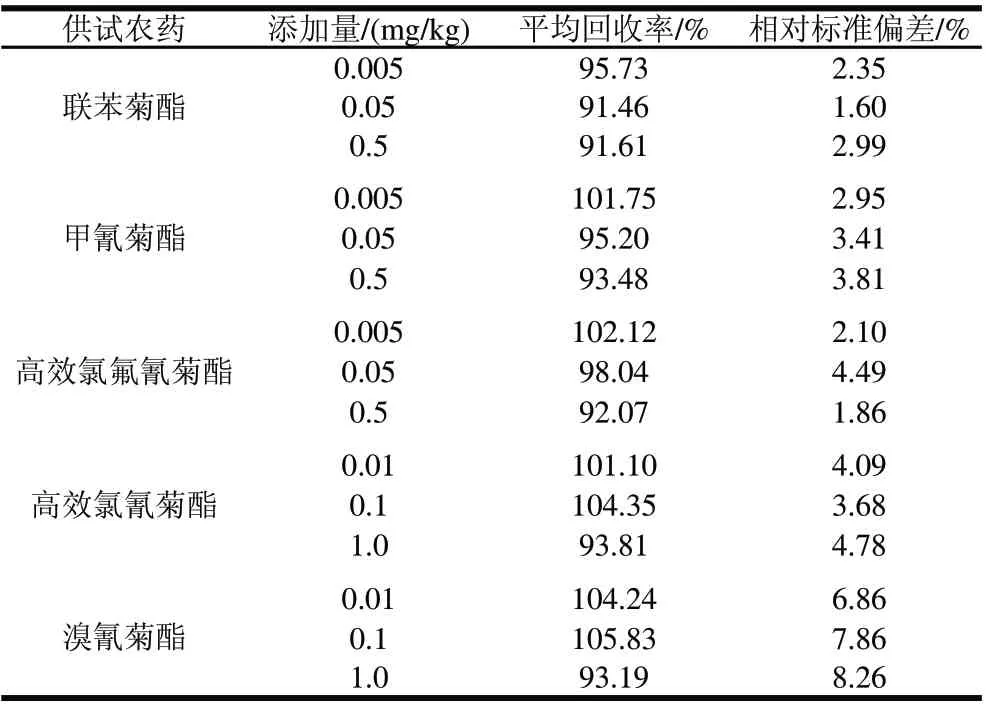
表1 供试拟除虫菊酯类农药在平菇培养料中的添加回收结果Table 1 Recoveries of selected pyrethroid pesticides in spiked growing medium
多残留分析方法测定平菇中拟除虫菊酯类农药残留的准确性、精确性以及灵敏度,均满足农药残留分析的要求[16]。本实验在空白培养料中添加联苯菊酯等5种拟除虫菊酯类农药的混合标样,其中联苯菊酯、甲氰菊酯和高效氯氟氰菊酯添加量分别为0.005、0.05、0.5mg/kg;高效氯氰菊酯和溴氰菊酯添加量分别为0.01、0.1、1mg/kg,每个添加量5次重复,进行添加回收实验。
由表1可知,在添加量范围内,培养料中拟除虫菊酯类农药平均添加回收率为91.46%~105.83%,相对标准偏差为1.60%~8.26%。联苯菊酯、甲氰菊酯和高效氯氟氰菊酯最低检测限为5μg/kg,高效氯氰菊酯和溴氰菊酯最低检测限为10μg/kg。该残留分析方法的准确度、精确度和灵敏度均满足农药残留分析的要求。
2.2 拟除虫菊酯类农药在平菇中的消解动态
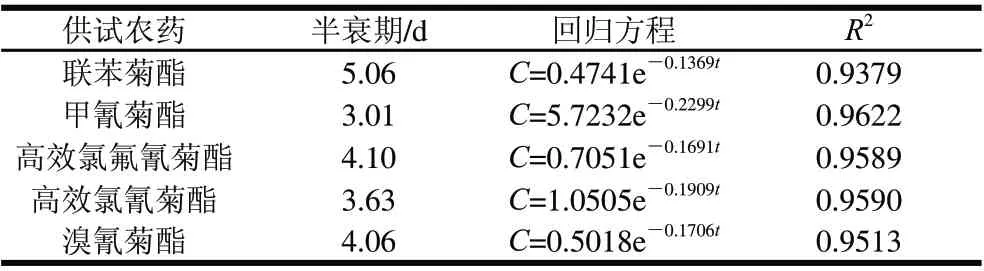
表2 拟除虫菊酯类农药在平菇中消解动力学参数Table 2 Degradation kinetic parameters of pyrethroid pesticides in Pleurotus ostreatus
用联苯菊酯等5种拟除虫菊酯类农药喷施一次,于施药后不同时间采样进行残留量测定。由表2可知,平菇中供试农药的残留量随着时间的延长而逐渐降低,其消解动态符合一级动力学方程。供试5种拟除虫菊酯类农药在平菇中的消解速率较快,半衰期为3.01~5.06d。其中,甲氰菊酯降解最快,其消解曲线方程为C=5.7232e-0.2299t(R2= 0.9622),半衰期为3.01d;联苯菊酯最慢,其消解曲线方程为C=0.4741e-0.1369t(R2= 0.9379),半衰期为5.06d。
2.3 灭菌对拟除虫菊酯类农药在培养料中降解的影响
在食用菌栽培中,要对培养料进行高温高压灭菌处理,以除去影响食用菌生长的杂菌。灭菌前后,联苯菊酯等5种拟除虫菊酯类农药在培养料中的残留量如表3所示。培养料的灭菌会显著影响联苯菊酯等5种拟除虫菊酯类农药在培养料中的消解。其中,联苯菊酯和甲氰菊酯的消解率在20%左右,高效氯氟氰菊酯、高效氯氰菊酯和溴氰菊酯的降解率达50%以上。

表3 灭菌对拟除虫菊酯类农药在培养料中降解的影响Table 3 Degradation rates of pyrethroid pesticides in sterilized growing medium
2.4 拟除虫菊酯类农药在平菇培养料中的消解动态
用联苯菊酯等5种拟除虫菊酯类农药喷施一次,于施药灭菌后不同时间采样,测定其在培养料中的残留量。由表4可知,培养料中供试农药的残留量随着时间的延长而逐渐降低,其消解动态符合一级动力学方程。供试5种拟除虫菊酯类农药在培养料中的消解速率较慢,半衰期为21.07~54.59d。其中,甲氰菊酯降解最快,其消解曲线方程为C=17.273e-0.0329t(R2= 0.9635),半衰期为21.07d;联苯菊酯最慢,其消解曲线方程为C=5.7542e-0.0127t(R2= 0.8378),半衰期为54.59d。
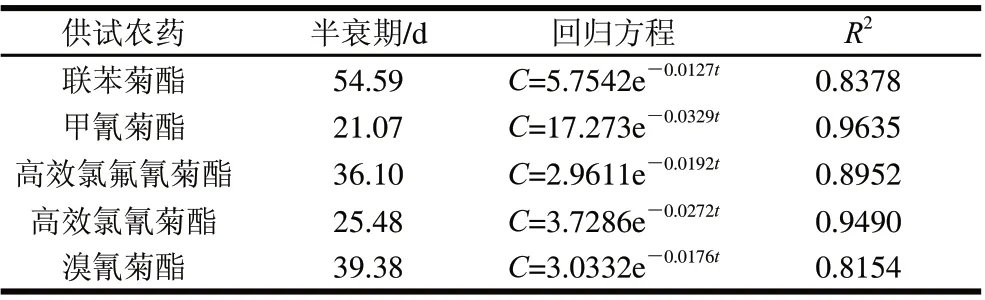
表4 拟除虫菊酯类农药在培养料中消解动力学参数Table 4 Degradation kinetic parameters of pyrethroid pesticides in growing medium
2.5 培养料中拟除虫菊酯类农药向平菇子实体中转移规律
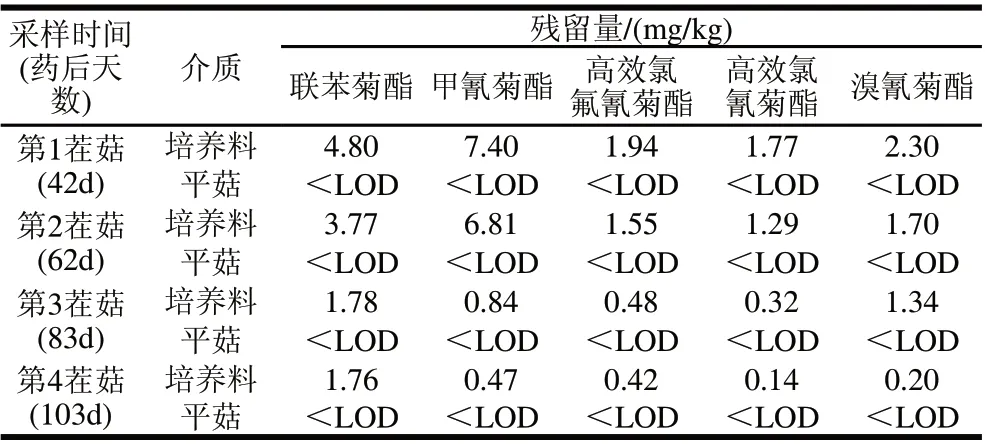
表5 培养料中拟除虫菊酯类农药向平菇子实体中的转移Table 5 Pyrethroid pesticide residues in growing medium and Pleurotus ostreatus
在平菇培养料中添加一定量供试农药后,正常栽培平菇,分别于药后42d(第一茬菇采收期)、62d(第二茬菇采收期)、83d(第三茬菇采收期)、103d(第四茬菇采收期)同步采集平菇及其培养料样品,进行供试农药残留检测。由表5可知,培养料中供试农药在药后42、62、83、103d后的残留量仍较高,分别达1.29~7.40、1.55~1.78、0.32~1.78、0.14~1.76mg/kg。然而,在同步采集的平菇子实体中均没有检测到供试农药的残留量。可见,平菇子实体在生长期间,平菇培养料中供试拟除虫菊酯类农药残留不会向平菇子实体转移,对食用菌产品质量安全的影响较小。
3 讨 论
本实验开展了平菇培养料中联苯菊酯、甲氰菊酯、高效氯氟氰菊酯、高效氯氰菊酯和溴氰菊酯等5种拟除虫菊酯类农药多残留分析方法的确证实验,证明该方法具有较好的准确度、精密度和灵敏度,完全满足农药残留分析的要求[17]。另外,该方法操作简单,也可以用于平菇、金针菇等食用菌产品中拟除虫菊酯类农药的多残留分析[16,18]。
联苯菊酯等5种供试拟除虫菊酯类农药在平菇和培养料中的消解动态符合一级动力学方程,其在平菇中的消解速率明显快于培养料,半衰期分别为3.01~5.06d、25.48~54.59d。培养料灭菌会显著影响使其中的联苯菊酯和甲氰菊酯降解20%左右,高效氯氟氰菊酯、高效氯氰菊酯和溴氰菊酯降解50%以上。这可能主要是由于拟除虫菊酯类农药随着温度的升高分解会加快,残留农药会有不同程度的降解。
在转移实验中,培养料中供试农药在药后42、62、83、103d后的残留量仍较高,分别达1.29~7.40、1.55~1.78、0.32~1.78、0.14~1.76mg/kg。然而,在同步采集的平菇子实体中均未检测到供试农药的残留量。因此,平菇子实体在生长期间,平菇培养料中供试拟除虫菊酯类农药残留不会向平菇子实体转移,对食用菌产品质量安全的影响较小。曲明清[19]报道了真姬菇和培养料中氯菊酯的最终残留,在接菌和未接菌的情况下,培养料中均含有大量氯菊酯农药残留,而在真姬菇中却未检出残留量。这可能因为拟除虫菊酯类农药是一类脂溶性农药,疏水性很强,极性很弱[20]。在平菇的生产过程中,拟除虫菊酯类农药易被培养料及菌丝吸附并固定,而难以被平菇吸收而进入子实体中。但在不同的栽培条件下,不同的食用菌品种中,是否仍有相同的转移规律,有待进一步的研究。
[1] 管道平, 胡清秀. 食用菌农药残留限量与产品质量安全[J]. 中国食用菌, 2008, 27(2): 3-6.
[2] 胡清秀, 宋金俤, 谢艳丽. 食用菌农药残留控制研究[J]. 中国食用菌, 2009, 28(1): 55-57; 64.
[3] 姚平官. 食用菌的主要病虫害及其防治[J]. 现代农业科技, 2008(20): 124; 127.
[4] 陈德荣. 夏季栽培食用菌如何防治病虫害[J]. 食用菌, 2007(3): 62-63.
[5] 朱富春. 对食用菌病虫害综合防治的几点建议[J]. 中国食用菌, 2008, 27(1): 51; 62.
[6] 彭卫红, 郑林用, 甘炳成. 食用菌生产中农药使用原则和安全性[J]. 食用菌, 2002(1): 33-34.
[7] 杨土凤, 王立洪, 杨涛, 等. 平菇与香菇原生质体融合新菌株的生物学特性研究[J]. 四川大学学报, 2010, 47(1): 202-206.
[8] 解永刚, 吴小文, 华日茂, 等. 平菇及其培养料中异菌脲的残留分析方法及消解动态研究[J]. 安徽农业大学学报, 2011, 38(6): 970-973.
[9] 张浩, 张祥辉, 逯忠斌, 等. 食用菌中多菌灵和噻菌灵残留动态的研究[J]. 食用菌, 2009(2): 36-37.
[10] 韩熹莱. 中国农业百科全书· 农药卷[M]. 北京: 中国农业出版社, 1993.
[11] 华纯. 拟除虫菊酯类农药的进展和剂型[J]. 世界农药, 2009(5): 39-44.
[12] 韩永奇. 拟除虫菊酯类农药隐忧凸显[J]. 中国石油和化工, 2010(11): 36-37.
[13] 农业部农药检定所. 农药登记残留田间实验标准操作规程[M]. 北京: 中国标准出版社, 2007.
[14] 唐启义, 冯明光. 实用统计分析及其DPS数据处理系统[M]. 北京: 科学出版社, 2000.
[15] 花日茂, 徐利, 吴祥为, 等. 表面活性剂对水中乙草胺光解的影响[J]. 农业环境科学学报, 2007, 26(3): 1049-1053
[16] 樊中臣, 施艳红, 操海群, 等. 气相色谱法测定平菇中拟除虫菊酯类农药残留[J]. 安徽农业大学学报, 2011, 38(4): 559-562.
[17] 岳永德. 农药残留分析[M]. 北京: 中国农业出版社, 2004.
[18] 樊中臣, 施艳红, 花日茂, 等. 金针菇中6种拟除虫菊酯类农药多残留的测定[J]. 食品科学, 2012, 33(6): 199-202.
[19] 曲明清. 三种食用菌中农药残留及富集研究[D]. 吉林: 吉林农业大学, 2006: 28-29.
[20] 司辉清, 庞晓莉, 吉当玲. 窖制技术在荣莉花茶农残转移中的作用[J]. 茶叶科学, 2007, 27(2):167-171.
