人工蛹虫草的化学成分分析
2013-08-07图力古尔包海鹰
陈 策,图力古尔*,包海鹰
(吉林农业大学 食药用菌教育部工程研究中心,吉林 长春 130118)
蛹虫草(Cordyceps militaris (Fr.) Link)又称北冬虫夏草,属子囊菌门(Ascomycota)、麦角菌科(Clavicipitaceae)、虫草属(Cordyceps),是本属的模式种,在我国分布于吉林、内蒙古、湖北、安徽、贵州、云南等省区,为目前研究和开发较多的虫草之一,也是常见人工栽培的虫草[1-2]。大量报道显示蛹虫草提取物具有广泛的药理活性,包括免疫调节、抗菌、抗肿瘤、抗炎、镇静、抗疲劳等[3-5]。但对野生和人工蛹虫草的化学成分的研究不够深入,因此本实验对人工栽培蛹虫草的化学成分进行进一步系统研究,为建立其质量标准和了解药理活性提供参考。
1 材料与方法
1.1 材料与试剂
样品人工蛹虫草(含有寄主蚕蛹和蛹虫草子实体)由东北虎药业股份有限公司提供;玉米黄素对照品(纯度95%,批号144-68-3),购于北京伊普瑞斯科技有限公司。
甲醇(色谱纯) 山东禹王实业有限公司化工分公司;二级纯净水 杭州娃哈哈集团有限公司;高效薄层板(Folio de silica gel 60 F254)、硅胶H(200~300目) 青岛海洋化工厂;石油醚(分析纯) 天津天泰精细化学品有限公司;其他试剂均为分析纯 北京化工厂。
1.2 仪器与设备
Agilent 1100型高效液相色谱仪(配有:高压四元泵,在线真空脱气机,自动进样器,柱温箱,光电二级管阵列检测器) 美国Agilent公司;Q TRAP LC-MS/MS system(配有电喷雾(ESI)接口的线性离子阱质谱仪) 美国Applied Biosystems/MDS Sciex公司;UV-2450紫外-可见分光光度计 日本岛津公司;Finnigan-MAT.LCQ电喷雾质谱仪 上海齐羿电子科技有限公司;Bruker AM-400MHz型核磁共振波谱仪 瑞士布鲁克公司;Agilent 7890A 5975C型气-质联用仪 广州优瓦仪器有限公司;RY-2型熔点测试仪 天津市国铭医药设备有限公司;VG-Autospec-300型质谱仪 上海仁特检测仪器有限公司。
1.3 提取、分离及鉴定
1.3.1 提取与分离
取干燥的人工蛹虫草样品2kg,粉碎后分别采用石油醚、氯仿和甲醇梯度提取,得石油醚层提取物15.6g,氯仿层提取物24.5g,甲醇层提取物33.2g。石油醚层提取物先采用硅胶柱色谱法粗分,以石油醚-乙酸乙酯(体积比10:1、5:1和2:1)为流动相进行梯度洗脱,分别得FrA1(3.2g)、FrA2(4.1g)和FrA3(4.9g)。FrA1经硅胶柱色谱(正己烷-乙酸乙酯10:1)反复纯化,得化合物4(15mg);FrA2先经硅胶柱色谱(正己烷-乙酸乙酯体积比5:1)纯化后,再采用重结晶(氯仿)法得化合物5(18mg);FrA3用硅胶柱色谱(正己烷-乙酸乙酯体积比2:1)纯化后,再经重结晶(乙醚)得化合物6(49mg)。氯仿层提取物同样采用硅胶柱色谱法分离,以二氯甲烷-乙酸乙酯(体积比20:1、5:1、3:1、2:1和3:2)梯度洗脱,得FrB1(2.2g)、FrB2(1.2g)、FrB3(4.1g)、FrB4(5.4g)和FrB5(2.1g)。其中FrB2以石油醚-乙酸乙酯(体积比60:1)为流动相进行硅胶柱色谱纯化,得化合物2(12mg);FrB3以石油醚-乙酸乙酯(体积比20:1)为流动相也进行硅胶柱色谱纯化,得化合物3(89mg);对FrB4以二氯甲烷-甲醇(体积比75:1)为流动相进一步采用硅胶柱色谱纯化,得化合物1(25mg);FrB5经重结晶(正己烷)得化合物7(28mg)。甲醇层提取物在低温下静置72h后,有结晶析出,将析出的结晶再经95%乙醇重结晶,得化合物8(50mg)。
1.3.2 化合物1的鉴定方法
紫外-可见吸收光谱法测定:取适量玉米黄素对照品和化合物1分别溶于氯仿,吸取对照品溶液、化合物1溶液各3mL,置于石英比色皿中,以纯氯仿溶液作对照,进行紫外-可见吸收(340~600nm)扫描,记录各吸光度。
薄层色谱法测定:取等量化合物1和玉米黄素对照品分别溶于氯仿,分别吸取10μL,点于同一高效薄层板上,以石油醚-乙酸乙酯(体积比3:2)、石油醚-丙酮(体积比2:1)和氯仿-甲醇(体积比50:1)为展开剂展开,取出后晾干,置可见光下检视。
HPLC-MS/MS法:分别取适量玉米黄素对照品和化合物1,用5mL甲醇溶解,滤膜过滤得对照品溶液与供试品溶液。色谱条件为美国Restek公司PinnacleⅡ C18色谱柱(250mm×4.6mm,5μm),流动相为甲醇-水(体积比95:5),流速1mL/min,进样量20μL,柱温25℃。质谱条件为离子化方式ESI(+),干燥气温度350℃,扫描范围m/z 50~700,干燥气流速50mL/min,毛细管电压5500eV。
2 结果与分析
2.1 结构鉴定
2.1.1 化合物1
玉米黄素对照品和化合物1的紫外-可见吸收光谱均在波长400~500nm范围呈1个主峰和1个肩峰。对照品和化合物1的紫外-可见吸收光谱中2个特征吸收峰数值一致,且化合物1的紫外-可见吸收光谱中2个特征吸收峰数值(462、491nm)与文献[6]报道的玉米黄素紫外-可见吸收数据基本相同。
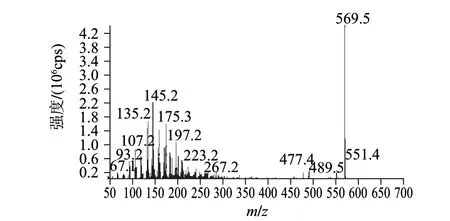
图 1 玉米黄素对照品的EPI质谱图Fig.1 Enhanced product ion (EPI) mass spectrum of zeaxanthin standard

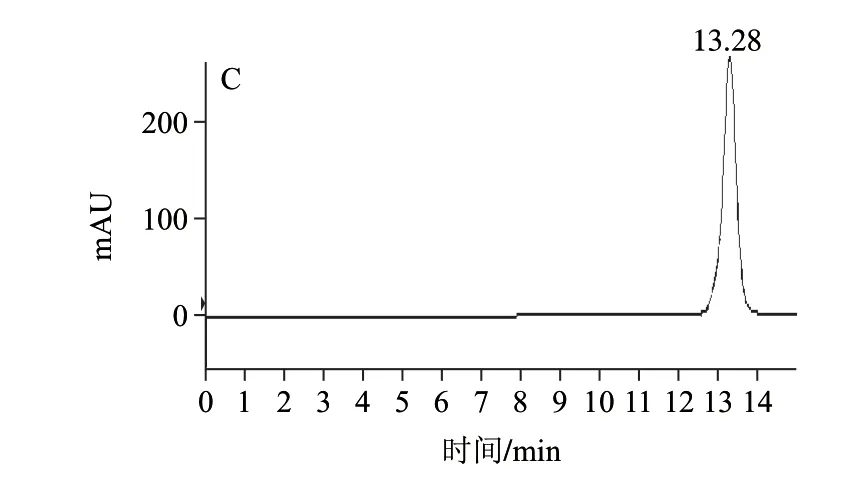
图 2 玉米黄素对照品的HPLC-MS/MS分析Fig.2 HPLC-MS/MS analysis of zeaxanthin standard
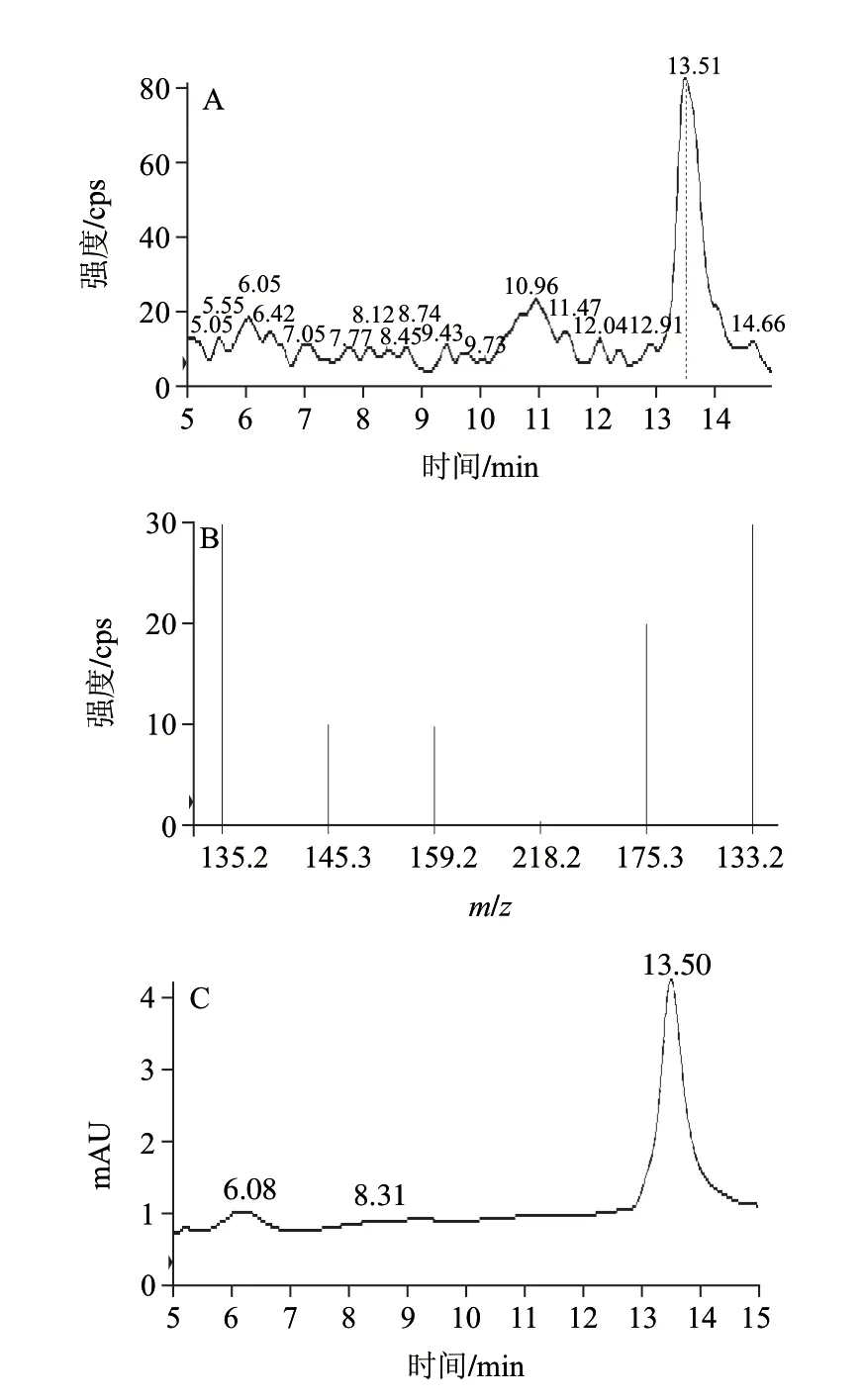
图 3 蛹虫草中化合物1的HPLC-MS/MS分析Fig.3 HPLC-MS/MS analysis of compound 1 from Cordyceps militaris
玉米黄素对照品、化合物1在3种展开系统中均呈单一的黄色斑点,且化合物1与玉米黄素对照品的Rf值相同,薄层色谱显示两者为同一化合物。
HPLC-MS/MS的多反应监测结果见图1~3。图1为EPI质谱图,质谱分子离子峰为m/z 569.5。玉米黄素对照品多反应监测的总离子流峰(图2A)和高效液相色谱峰(图2C)的保留时间分别为13.31min和13.28min,化合物1多反应监测的总离子流峰(图3A)和高效液相色谱峰(图3C)的保留时间分别为13.51min和13.50min,与玉米黄素对照品的数据基本一致;MRM扫描占绝对优势的5对离子峰分别为m/z 135.2、145.2、159.2、218.2、175.3、133.2,玉米黄素对照品和化合物1在HPLC-MS/MS中保留时间分别为13.194min和13.305min时都含有该5个离子对(图2B和图3B)。因此,多反应监测结果显示化合物1和玉米黄素为同一化合物。
通过对人工培养蛹虫草中化合物1进行紫外-可见吸收光谱法、薄层色谱法和多反应监测法测定,化合物1被鉴定为玉米黄素(zeaxanthin),结构式见图4。
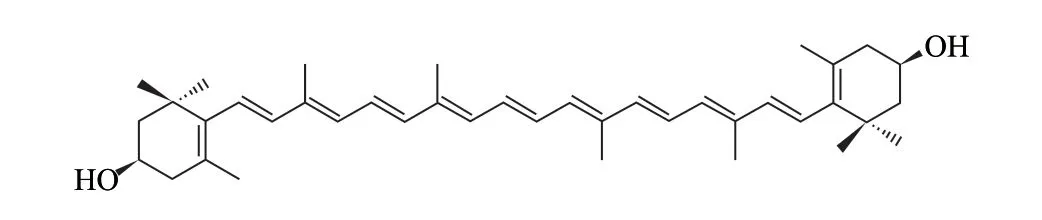
图 4 玉米黄素的结构式Fig.4 Chemical structure of zeaxanthin
2.1.2 化合物2
无色油状物,EI-MS m/z 653[M+H]+,1H-NMR (400MHz,CDCl3):δ 5.30~5.38 (2H, m, H-9’, 10’)、4.69 (1H, m, H-3)、2.25 (2H, t, J=7.6Hz, H-2’)、0.90 (3H, d, J=6.4Hz, H-21)、0.88 (3H, t, J=6.4Hz, H-18’)、0.864 (3H, d, J=6.8Hz, H-27)、0.860 (3H, d, J=6.8Hz, H-26)、0.82 (3H, s, H-19)、0.64 (3H, s, H-18);13C-NMR (100MHz,CDCl3):δ173.43 (C-1’)、129.97、129.76 (C-9’, 10’)、73.45 (C-3)、56.43 (C-14)、56.28 (C-17)、54.24 (C-9)、44.67 (C-5)、42.59 (C-13)、39.99 (C-12)、39.52 (C-24)、36.78 (C-1)、36.17 (C-10)、36.17 (C-22)、35.79 (C-20)、35.49 (C-8)、34.76 (C-8’)、34.40 (C-2’)、34.09 (C-11’)、32.00 (C-4)、31.91 (C-7)、29.77~29.09 [(CH2)n油酸部分]、28.63 (C-6)、28.23 (C-16)、28.00 (C-25)、27.53 (C-2)、25.08 (C-3’)、24.20 (C-15)、23.84 (C-23)、22.80 (C-27)、22.68 (C-26)、22.55 (C-17’)、21.20 (C-11)、18.66 (C-21)、14.10 (C-18’)、12.22 (C-18)、12.06 (C-19)。以上数据与文献[7]报道的一致,故确定化合物2为二氢胆甾醇油酸酯。
2.1.3 化合物3
常温条件下为无色的油状物,冷藏后变为白色固体,可溶于石油醚、氯仿等有机溶剂,置于254nm和365nm紫外灯下观察,无荧光现象,用10% H2SO4溶液和碘显色后的斑点为紫色,呈拇指状。EI-MS m/z 856[M]+,1H-NMR(CDCl3,400MHz):2.28(2H, t, J=7.6Hz)、1.59(2H, m)、1.29(8H, m)、5.30(1H, m)、5.30(1H, m)、2.04(2H, m)、2.04(4H, m)、1.29(10H, m)、1.29(2H, m)、0.87(3H, m)、2.28(2H, t, J =7.6Hz)、1.59(2H, m)、1.29(22H, m)、1.29(2H, m)、0.87(3H, m)。13C-NMR(CDCl3,100MHz):61.98(C-1)、68.83(C-2)、61.98(C-3)、172.62(C-1’)、34.08(C-2’)、2 4.7 8(C-3’)、3 1.8 3(C-4’~7’)、2 7.1 0(C-8’)、1 2 9.8 8(C-9’)、1 2 7.9 9(C-1 0’)、2 5.5 4(C-1 1’)、127.81(C-12’)、130.04(C-13’)、27.10(C-14’)、31.83(C-15’~16’)、22.49(C-17’)、14.00(C-18’)、1 7 3.0 4(C-1”)、3 3.9 2(C-2”)、2 4.7 8(C-3”)、31.83(C-4”~7”)、27.10(C-8”)、129.88(C-9”)、129.57(C-10”)、27.10(C-11”)、31.83(C-12”~16”)、2 2.6 0(C-1 7”)、1 4.0 0(C-1 8”)、1 7 3.0 4(C-1”’)、33.92(C-2”’)、24.78(C-3”’)、31.83(C-4”’~14”’)、22.60(C-15”’)、14.00(C-16”’)。以上数据与文献[8]报道的数据基本一致,鉴定化合物3为1-油酰基-2-亚油酸-3-棕榈酸甘油。
2.1.4 化合物4
淡黄绿色结晶,m p 1 1 2 ~1 1 4 ℃(丙酮),溶于氯仿、丙酮。置于3 6 5 n m 紫外灯下观察,有很强的亮蓝色荧光,1 0%硫酸显色后呈鲜艳的黄绿色斑点。EI-MS m/z 393[M]+,1H-NMR(CDCl3,400MHz):δ 6.59(1H, d)、6.01(1H, d)、5.74(1H, s)、5.25(1H, dd)、5.21(1H, dd)、2.48(1H, m)、2.46(1H, m)、2.14(1H, m)、2.12(1H, m)、2.06(1H, m)、1.88(1H, m)、1.85(1H, m)、1.84(1H, m)、1.83(1H, m)、1.79(1H, m)、1.51(1H, m)、1.49(1H, m)、 1.47(1H, m)、1.25(1H, m)、1.07(3H, s)、1.05(3H, s)、1.04(3H, d)、0.99(3H, d)、0.93(3 H, d)、0.8 3(3 H, d)。13C-N M R(C D C l3,100MHz):δ 199.48(C-3)、164.47(C-5)、156.13(C-14)、134.98(C-22)、134.05(C-23)、132.54(C-7)、124.46(C-6)、124.46(C-8)、122.95(C-4)、55.70(C-17)、44.33(C-9)、43.99(C-13)、42.86(C-24)、39.25(C-20)、36.76(C-10)、35.58(C-12)、34.12(C-1)、34.08(C-2)、33.07(C-25)、27.68(C-16)、25.36(C-15)、21.21(C-21)、19.96(C-26)、19.64(C-27)、18.97(C-18)、18.97(C-28)、17.61(C-11)、16.63(C-19)。以上数据与文献[9]报道的数据基本一致,鉴定化合物4为4,6,8(14),22(23)-四烯-3-酮-麦角甾烷。
2.1.5 化合物5
无色针状结晶,mp137~139℃(乙醇),易溶于氯仿、丙酮。EI-MS m/z 414[M]+。13C-NMR(CDCl3, 100MHz):δ 140.76(C-5)、121.68(C-6)、71.78(C-3)、56.77(C-14)、56.06(C-17)、50.14(C-9)、45.84(C-4)、42.31(C-13)、39.78(C-12)、37.26(C-24)、36.7(C-10)、36.41(C-1)、33.95(C-22)、31.90(C-7)、31.90(C-20)、31.55(C-8)、29.16(C-2)、29.16(C-16)、28.23(C-11)、26.09(C-15)、24.29(C-23)、23.07(C-27)、21.08(C-28)、19.80(C-21)、19.38(C-19)、19.17(C-25)、18.77(C-29)、12.05(C-26)、11.85(C-18)。以上数据与文献报道β-谷甾醇的数据基本一致[10],鉴定化合物5为β-谷甾醇。
2.1.6 化合物6
白色针晶,mp177~180℃(丙酮),可溶于石油醚、氯仿等有机溶剂,不溶于甲醇、乙醇等极性大的溶剂。EI-MS m/z 428[M]+。1H-NMR(CDCl3,400MHz):δ 6.49(1H, d, J=8.4Hz)、6.25(1H, d, J=8.4Hz)、5.21(1H, dd, J=15.2,7.6Hz)、5.19(1H, dd, J=15.2, 8.0Hz)、3.97(1H, m)、1.01(3H, d, J=5.6Hz)、0.90(3H, d, J=6.8Hz)、0.88(3H, s)、0.84(3H, d, J=3.6Hz)、0.82(3H, d, J=3.6Hz)、0.82(3H, s)。以上数据与文献[11]报道麦角甾醇过氧化物的数据基本一致,鉴定化合物6为麦角甾醇过氧化物。
2.1.7 化合物7
白色针晶,能溶于吡啶和热乙酸乙酯等溶剂,不溶于石油醚等一类极性较小的溶剂。无荧光现象,用10% H2SO4溶液和碘显色后的斑点为紫红色。EI-MS m/z 412(M-18),1H-NMR(CDCl3, 400MHz):1H-NMR(CDCl3, 400MHz):δ 5.36(1H, s)、5.22(1H, dd, J=15.3, 7.4Hz)、5.17(1H, dd, J=15.3, 8.0Hz)、4,07(1H, m)、3.63(1H, d, J=5.0Hz)、1.58(3H, s),1.09(3H, d, J=6.6Hz)、0.93(3H, d, J=6.8Hz)、0.85(3H, d, J=7.2Hz)、0.83(3H, d, J=7.2Hz)、0.60(3H, s)。13C-NMR(CDCl3, 100MHz):δ 144.02(C-8)、135.37(C-22)、132.20(C-23)、117.56(C-7)、75.79(C-5)、73.70(C-6)、67.73(C-3)、56.02(C-17)、43.78(C-9)、43.50(C-13)、42.83(C-24)、40.37(C-4)、39.51(C-20)、39.24(C-12)、37.16(C-10)、33.09(C-25)、32.91(C-1)、30.88(C-2)、27.89(C-16)、22.89(C-15)、22.06(C-11)、21.11(C-21)、19.94(C-26)、19.64(C-27)、17.59(C-19)、12.33(C-18)。以上数据与文献[12]报道啤酒甾醇的数据基本一致,鉴定化合物7为啤酒甾醇。
2.1.8 化合物8
斜方针状结晶(95%乙醇),mp 166~168℃,易溶于水,不溶于乙醚等极性较小的溶剂。于甘露醇标准品共薄层,以正丁醇-醋酸-水(体积比4:1:6)展开,用5%高碘酸钾溶液显色,再喷0.5%联苯胺乙醇溶液,加热显色,两者均显清晰的白斑,且Rf值相同;同时两者共熔点不下降,鉴定化合物8为甘露醇。
2.2 石油醚提取物的GC-MS分析结果

表1 人工蛹虫草石油醚提取物GC-MS分析结果Table 1 Results of GC-MS analysis of petroleum ether extract of cultured Cordyceps militaris
用GC-MS技术分析得到了样品总离子流色谱图。各组分的相对含量是以总离子流色谱图中用峰面积归一化方法计算而得,对总离子流色谱图的各峰进行色谱扫描后得到质谱图,以人工谱图解析并结合有关质谱文献资料确定各个化学成分,分析结果详见表1。人工蛹虫草石油醚提取物中脂肪酸含量较多,其中主要为亚油酸(9,12-十八碳二烯酸),含量为41.949%、反油酸(反9-十八碳烯酸),含量为27.696%。
3 讨 论
3.1 目前已有文献报道,蛹虫草中含有麦角甾-4,6,8(14), 22(23)-四烯-3-酮、β-谷甾醇、麦角甾醇过氧化物、虫草酸(D-甘露醇)等几种化合物。本研究以梯度洗脱的方法分离纯化了以上化合物,与文献[11]报道的结果相一致。
3.2 目前对氢化胆甾醇酯衍生物,尤其是和油酸结合生成的衍生物的生物活性并未见报道,本研究分离得到的二氢胆甾醇油酸酯就是一种氢化胆甾醇与油酸结合形成的脂肪酸酯。胆甾醇及其衍生物作为动物和真菌中的主要甾体化合物,具有重要的生理功能和生物学活性[13]。因为它含有一个甾核结构,该结构中有一个叫甾核的四元碳骨架,并且环上还有3个侧链,它能够消除偏振,所以被广泛应用于医药、化妆品、乳化剂和生物制剂等各个方面。而油酸属于不饱和脂肪酸中的一类烯酸,在蚕蛹油中大量存在,也被广泛应用于医药、化妆品和生物工程等领域。在医药领域,胆甾醇是一种重要的甾体药物前体,可作为合成甾体激素、VD3和人工牛黄等药物的原料[14]。另外,蚕蛹中脂肪酸含量十分丰富,尤其以油酸和亚油酸为主,还含有一定量的β-谷甾醇、胆甾醇。油酸有抗癌、降低血糖、调节血脂、降胆固醇作用,可以作为医药中间体使用,而本研究中发现蛹虫草石油醚提取物脂肪酸以亚油酸和反油酸为主,根据文献[15],未感染菌的寄主蚕蛹中也富含亚油酸和反油酸,所以人工蛹虫草中的亚油酸和反油酸主要来自虫体。本研究首次从人工蛹虫草中发现的胆甾醇与油酸结合生成的二氢胆甾醇油酸酯是否与蛹虫草的药用功效有关或是否是蛹虫草的特征性成分,值得进一步研究。
3.3 玉米黄素是一种极具潜力的色素和抗氧化剂,在食品、养殖和医药化工行业具有广阔的应用前景[16-17],但在真菌中提取得到未见报道,仅两篇文献报道蛹虫草中含有类胡萝卜素[18-19],但未纯化和结构鉴定。目前只有一篇报道虫草属真菌中分离得到了叶黄素[20],因此本研究从虫草属真菌中寻找到功能性天然色素,为进一步开发虫草提供了参考。
[1] 钟思敏, 杜梅, 陈往滨, 等. 蛹虫草菌丝产虫草素液体培养条件的研究[J]. 菌物学报, 2011, 30(2): 229-234.
[2] 李海洲, 张京国, 毛海霞. 液体菌种栽培蛹虫草的技术研究[J]. 陕西农业科学, 2013(1): 126-128.
[3] 桂仲争, 滕国琴, 贾俊强, 等. 蛹虫草食药用开发价值[J]. 中国食物与营养, 2012, 18(3): 70-73.
[4] 王建芳, 杨春清. 蛹虫草有效成分及药理作用研究进展[J]. 中医药信息, 2005, 22(5): 30-32.
[5] 夏春雨, 孙巍, 刘学铭. 虫草有效成分的研究进展[J]. 中国食用菌, 2009, 28(2): 3-7.
[6] FRANCISCO D V, OCTAVIO P L. Effects of enzymatic treatments of marigold flowers on lutein isomeric profiles[J]. Agric Food Chem, 1997, 45: 1097-1102.
[7] AKIRA S, YOSHIKI K, KAZUAKI I. Open-air and solvent-free ester condensation catalyzed by sulfonic acids[J]. Tetrahedron Letters, 2008, 49(34): 5017-5020.
[8] HUI S P, MURAI T, YOSHIMURA T, et al. Simple chemical syntheses of TAG monohydroperoxides[J]. Lipids, 2003, 12(38): 1287-1292.
[9] HE J, FENG X Z. Chemical constituents of Phellinus yamanoi[J]. Nat Prod Res Dev, 2000, 12(6): 33-35.
[10] 苏秀芳, 林强, 黄锡山, 等. 蝴蝶果茎枝化学成分的研究[J]. 西北植物学报, 2008, 28(11): 2339-2342.
[11] 吕子明, 姜永涛, 吴立军, 等. 人工蛹虫草子实体化学成分研究[J]. 中国中药杂志, 2008, 33(24): 2914-2917.
[12] KOBAYASHI M, KRISHNA M M, HARIBABU B, et al. Isolation of 23-demethylgorgost-7-ene-triol and (24S)-ergostan-3β, 5α, 6β, 7β, 15β-pentol from soft corals of the andaman and nicobar coasts[J]. Chemical and Pharmaceutical Bulletin, 1993, 41(1): 87-89.
[13] 李静, 周立刚, 文成敬. 真菌甾体化合物的研究进展[J]. 天然产物研究与开发, 2008, 20(1): 165-171.
[14] 陈小利, 林苗, 胡杰, 等. 进一步开发羊毛脂[J]. 化学世界, 2000, 41(1): 8-12.
[15] 张研宇, 李建科. 蚕蛹油提取、精炼及其脂肪酸组成分析[J]. 中国油脂, 2010, 35(6): 76-79.
[16] 邱涛涛, 黄明发, 陈颜虹, 等. 玉米黄素提取及应用研究进展[J]. 中国调味品, 2008, 357(11): 18-23.
[17] 王陶, 李文, 杨克. 蛹虫草类胡萝卜素的热酸-超声复合提取工艺的研究[J]. 食品工业, 2011(9): 54-57.
[18] 张志军, 江晓路, 牟海津, 等. 蛹虫草类胡萝卜素提取工艺的研究[J]. 食品科技, 2007(4): 99-103.
[19] 付鸣佳. 蛹虫草产类胡萝卜素的研究[J]. 食品与生物技术学报, 2005(4): 107-110.
[20] 闫喜涛, 包海鹰, 图力古尔. 人工培养蛹虫草中一种天然色素的分离和结构鉴定[J]. 菌物学报, 2010, 29(5): 777-781.
