桃果肉总酚提取和测定方法的研究
2013-08-02蔡志翔张斌斌俞明亮
严 娟, 蔡志翔, 张斌斌, 钱 巍, 俞明亮
(江苏省农业科学院园艺研究所,江苏 南京 210014)
酚类化合物因具有强大的抗氧化活性和清除自由基的能力而备受瞩目[1-4]。水果中富含多酚类物质,已成为研究和开发功能性水果及饮品的焦点[5]。桃[Prunus persica(L.)Batsch]原产中国,世界广泛分布和栽培,在国际国内果品市场供应和调节中占有重要地位。进行功能性桃品种的开发和挖掘,可适应现代社会对健康果品的需求,从而推动桃产业的良性发展。
国内外对桃酚类物质的研究主要集中在对其抗氧化功能等方面[6-13]。随着对红肉桃资源研究的逐渐深入,发现其含有大量的多酚类物质,抗氧化能力明显高于白肉、黄肉桃品种[14-15]。因此,开展对酚类物质的研究可成为开发功能性桃品种的一个切入点。
本试验对桃果肉总酚的超声波辅助提取和福林-酚比色测定方法进行了优化,试图建立简单、稳定的桃总酚提取和测定体系,为开发功能性桃品种奠定基础。
1 材料与方法
1.1 材料
试验用成熟桃果实均采摘于国家果树种质南京桃资源圃。每种桃均采10个果实,快速削皮分装于保鲜袋中,液氮速冻后放置于-70℃保存备用,3次重复。
1.2 方法
1.2.1 桃果肉总酚含量的福林-酚比色测定方法的优化
1.2.1.1 样品制备及溶液配制 称取北京一线红(红肉桃)、香金蟠(黄肉桃)和红清水(白肉桃)3个桃品种果肉各匀浆2.50 g,加入60.00%的乙醇20.0 ml,40℃避光超声波提取30 min,4℃下10 000 r/min离心10 min,取上清液定容至25.0 ml,4℃冰箱保存备用。称取0.11 g一水合没食子酸,用蒸馏水溶解定容至 1 000.0 ml,得到浓度为 100 μg/ml的没食子酸标准溶液。
1.2.1.2 最佳测量波长的选择 准确移取没食子酸标准溶液和北京一线红样品各0.50 ml,香金蟠和红清水样品各1.00 ml,加5.00 ml蒸馏水,再加入0.50 ml 0.5 mol/L福林-酚,混匀静置30 s后加入3.00 ml 0.5 mol/L Na2CO3,定容至 25.00 ml,室温下避光反应1 h,进行500~900 nm波长范围的扫描[UV6300(PC)双光束紫外可见分光光度计]。
1.2.1.3 最佳比色体系试剂用量的确定 Na2CO3用量的确定:准确移取7份0.50 ml没食子酸,加5.00 ml蒸馏水,再加入0.50 ml的福林-酚,混匀静置 30 s后分别加入 0.25 ml、0.50 ml、1.00 ml、1.50 ml、2.00 ml、2.50 ml、3.00 ml的 0.5 mol/L Na2CO3,混匀后定容到25.00 ml,室温下避光反应1 h后,在方法1.2.1.2中确定的最佳波长处测量吸光度,以确定最大吸光度所对应的Na2CO3与福林-酚的体积比。3次重复。
福林-酚用量的确定:准确移取6份0.50 ml没食子酸,加5.00 ml蒸馏水,再分别加入0.25 ml、0.50 ml、1.00 ml、1.50 ml、2.00 ml、2.50 ml福林-酚,混匀静置 30 s,再依次加入 1.00 ml、2.00 ml、4.00 ml、6.00 ml、8.00 ml、10.00 ml的 0.5 mol/L Na2CO3,混匀后定容到25.00 ml,室温下避光反应1 h后,在方法1.2.1.2中确定的最佳波长处测量吸光度,以确定最大吸光度所对应的福林-酚与没食子酸的体积比。3次重复。
1.2.1.4 测定温度的确定 准确移取5份0.50 ml没食子酸标准溶液,加5.00 ml蒸馏水,再分别加入1.50 ml的福林-酚,混匀静置30 s,再加入6.00 ml 0.5 mol/L Na2CO3,混匀定容到25.00 ml,分别在5℃、25℃、40℃、60℃、75℃下避光反应1 h后,在方法1.2.1.2中确定的最佳波长处测量吸光度,以确定适宜的反应温度。3次重复。
1.2.1.5 测定时间的确定 准确移取8份0.50 ml没食子酸标准溶液,加5.00 ml蒸馏水,再分别加入1.50 ml的福林-酚,混匀静置30 s,再加入6.00 ml 0.5 mol/L Na2CO3,混匀定容到25.00 ml,在确定的适宜温度下分别避光反应10 min、20 min、30 min、40 min、50 min、60 min、90 min、120 min 后,在方法1.2.1.2中确定的最佳波长处测量吸光度,以确定显色完全的最佳时间。3次重复。
1.2.1.6 标准曲线的绘制 准确移取0 ml、0.25 ml、0.50 ml、0.75 ml、1.00 ml、1.25 ml、1.50 ml的没食子酸标准溶液于25.00 ml试管中,没食子酸浓度分别为 0 μg/ml、1 μg/ml、2 μg/ml、3 μg/ml、4 μg/ml、5 μg/ml、6 μg/ml,按上述确定的最佳反应条件进行反应,并测量吸光度。以标准溶液浓度(单位为μg/ml)为横坐标,吸光度为纵坐标绘制标准曲线。
1.2.1.7 稳定性和精密度的测定 准确移取没食子酸和北京一线红果肉提取液0.50 ml,按最优条件反应,每隔10 min测量1次吸光度,计算稳定性。准确移取5份北京一线红果肉提取液,按最优条件反应,测定吸光度,根据标准曲线计算总酚含量,并计算精密度。3次重复。
1.2.1.8 加标回收率的测定 准确移取0.25 ml北京一线红桃肉提取液6份,加5.00 ml蒸馏水,再分别加入 0 ml、0.10 ml、0.20 ml、0.30 ml、0.40 ml、0.50 ml没食子酸,按最优条件反应,测定吸光度,计算总酚含量和加标回收率。
1.2.2 桃果肉总酚的超声波辅助提取方法的优化
1.2.2.1 不同提取剂对桃总酚提取效果的检测称取2.00 g北京一线红果肉 12份,分别加入20.00%、60.00%、100.00%浓度的乙醇、甲醇、乙酸乙酯和丙酮提取剂各20.00 ml,在40℃超声[DS-5510DTH(频率:40 KHZ;功率:300 W)]提取 30 min,10 000 r/min冷冻离心 10 min,上清液定容到25.00 ml,用优化的福林-酚测定法测定吸光度。3次重复。
1.2.2.2 不同料液比对桃总酚提取效果的检测称取2.00 g北京一线红果肉,加入由方法1.2.2.1中确定的提取剂,分别在料液比(样品质量/提取剂体积,g/ml)为1∶4、1∶6、1∶8、1∶10 和1∶12 条件下40℃超声提取30 min,10 000 r/min冷冻离心10 min,上清液定容到25.00 ml,用优化的福林-酚测定法测定吸光度。3次重复。
1.2.2.3 提取温度和时间的确定 在确定的提取剂和料液比的情况下,选择超声提取温度分别为25℃、40℃、60℃,在各温度条件下提取时间分别为10 min、30 min、60 min、90 min,10 000 r/min冷冻离心10 min,上清液定容到25.00 ml,用优化的福林-酚测定法测定吸光度。3次重复。
1.2.3 桃品种总酚的提取和测定 取不同果肉颜色桃品种果肉匀浆各2.00 g,按照上述优化的提取和测定方法测定样品总酚含量。
2 结果
2.1 桃果肉总酚含量的测定方法
2.1.1 最佳波长的选择 分别将3个桃样品溶液和没食子酸标准溶液在500 nm至900 nm范围内扫描,结果(图1)显示,样品最大吸收峰值均在765 nm处,可见765 nm为桃总酚含量测定的最大吸收波长。
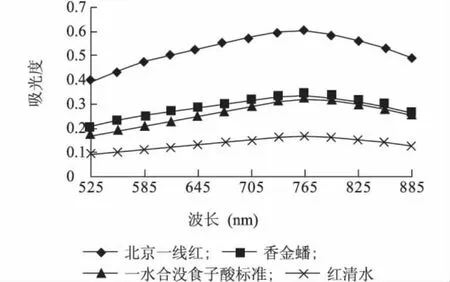
图1 桃样品和标准溶液的扫描结果Fig.1 Obsorbance of peach samples and standard gallic acid solution
2.1.2 最佳比色体系试剂用量的配比 Na2CO3用量对多酚物质的显色效果(吸光度)见图 2。Na2CO3用量不足会导致多酚物质显色不完全。吸光度值随着Na2CO3与福林-酚用量比值增大而增大;当比值大于4∶1时,吸光度值不再明显增加。所以,0.5 mol/L Na2CO3与0.5 mol/L福林-酚的适宜用量配比为4∶1。

图2 0.5 mol/L Na2CO3用量对没食子酸标准溶液显色的影响Fig.2 Effects of 0.5 mol/L Na2CO3on the reaction of standard gallic acid solution with Folin-Ciocalteu reagent
福林-酚用量对多酚物质的显色效果如图3所示。当0.5 mol/L福林-酚与0.50 ml没食子酸用量比值在3∶1时,吸光度值最大,反应最完全;0.5 mol/L福林酚与0.50 ml没食子酸比值过高或者过低均可对显色产生抑制作用。

图3 0.5 mol/L福林-酚试剂用量对没食子酸标准溶液显色的影响Fig.3 Effects of 0.5 mol/L Folin-Ciocalteu reagent amount on the reaction of standard gallic acid solution with Folin-Ciocalteu reagent
2.1.3 反应温度的确定 从图4可以看出,温度的高低影响反应效果。当温度在25℃时反应最充分,吸光度值最大;当温度高于25℃时,吸光度值随着温度的增加而降低。

图4 温度对样品显色的影响Fig.4 Effects of temperature on the reaction of gallic acid with Folin-Ciocalteu reagent
2.1.4 反应时间的确定 由图5可知,在最佳反应温度(25℃)下,多酚物质在60 min后可充分显色,之后随着时间的延长吸光度值基本保持稳定。
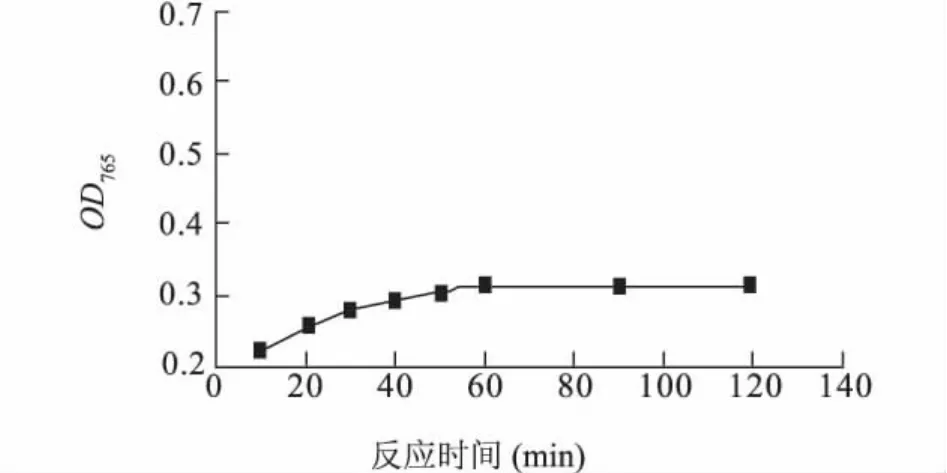
图5 显色时间对样品显色效果的影响Fig.5 Effects of time on the reaction of gallic acid with Folin-Ciocalteu reagent
2.1.5 标准曲线的建立 将平行测定结果进行线性回归,以没食子酸标准溶液浓度为横坐标,吸光度为纵坐标作图,见图6。曲线的线性关系为 Y=0.119 4x+0.004 3,R2=0.999 4,线性良好。

图6 没食子酸标准曲线图Fig.6 Standard curve of gallic acid
2.1.6 稳定性和精密度的检测 没食子酸和北京一线红果肉提取液在最佳测定条件下反应,每隔10 min测定1次吸光度,吸光度值随时间的变化趋势见图7。60 min后吸光度变化趋于平缓;超过100 min,曲线均有略微下倾的趋势,且北京一线红样品下降较明显,说明酚类化合物长时间存在于溶液中稳定性降低。

图7 桃样品的稳定性Fig.7 Stability of peach samples
通过以没食子酸绘制的标准曲线公式计算总酚含量,并进行精密度检验。
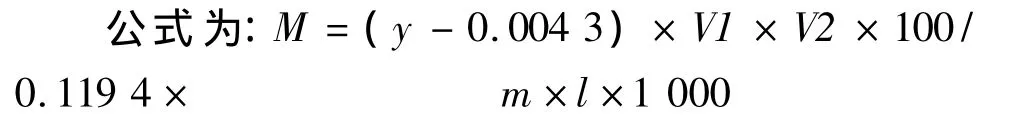
式中:M为桃样品的总酚含量(μg/g);m为桃样品的质量(g);V1、V2分别为样品提取时定容的体积和测定时定容的体积(ml),l为样品取样量(ml)。
5份北京一线红果肉样品中总酚含量的相对标准偏差为1.20%,说明该方法具有较高的精密度。
2.1.7 加标回收率的测定 在相同浓度北京一线红样品中分别添加不同浓度没食子酸进行回收率检验,结果显示,加标回收率都在90.00%以上,相对标准偏差为1.84%,表明此分析方法准确可靠,可用于桃总多酚含量的测定。
2.2 桃果肉总酚的超声波辅助提取方法
2.2.1 不同提取剂对桃总酚的提取 用不同浓度提取剂提取桃果肉总酚,结果(图8)显示,总酚的提取量随着4种溶剂不同浓度的变化而变化。其中乙酸乙酯对桃多酚物质的提取效果最差;浓度为60.00%的乙醇、甲醇和丙酮的提取效果最优,且三者间无显著差异。但考虑到丙酮和甲醇的毒性和价格均较乙醇高,因此,选用60.00%乙醇做桃果肉总酚的提取剂。

图8 不同浓度提取剂对桃总酚的提取效果Fig.8 Effects of different concentrations of extractant on the extraction of total phenol in peach mesocarp
2.2.2 不同料液比对桃总酚的提取效果 从图9可以看出,料液比[桃果肉质量(g)∶60.00%乙醇体积(ml)]越高,吸光度值越大,即总酚提取越完全。料液比1∶8处理下桃总酚提取量比料液比1∶4处理增加51.69%;当料液比大于1∶8后,提取量增加不明显,从1∶8到1∶10,料液比1∶10处理下桃总酚提取量比1∶8处理增加2.36%,1∶12处理下桃总酚提取量比1∶10处理增加仅0.28%。表明料液比1∶10可达较充分的提取效果。
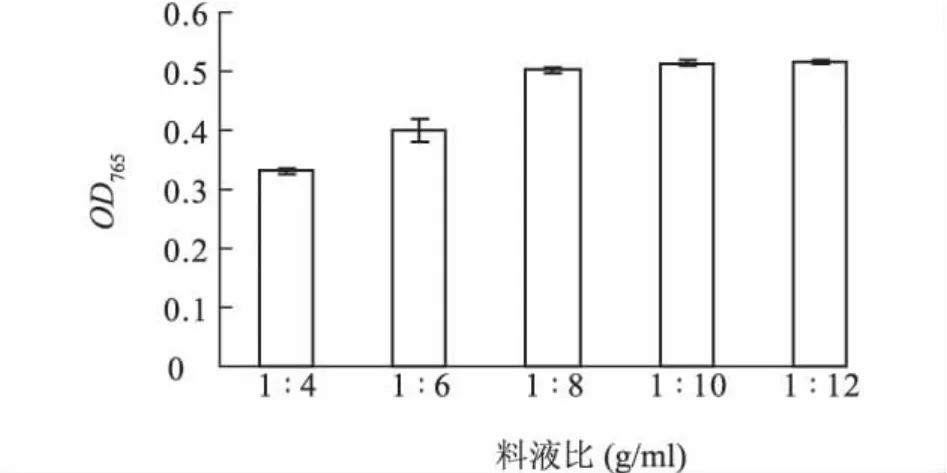
图9 不同料液比对桃果肉总酚提取效果的影响Fig.9 Effects of different ratios of material to solvent on the extraction of total phenol in peach mesocarp
2.2.3 提取温度和时间 如图10所示,提取温度和时间影响桃总酚的提取量。在60℃下提取30 min的桃果肉中总酚提取量最低,在40℃下提取60 min的总酚提取量最高。

图10 不同时间和温度对桃果肉总酚提取效果的影响Fig.10 Effects of time and temperature on the extraction of total phenol in peach mesocarp
2.3 桃果肉总酚的提取和测定
根据优化的方法,对14个桃品种果肉的总酚进行了提取和测定。根据吸光度和标准曲线公式,计算出其总酚含量,结果(图11)显示,不同桃品种的总酚含量差异显著(P<0.05),分布区间为0.221 8 ~3.162 1 mg/g;红肉桃品种的总酚含量明显高于白肉桃和黄肉桃品种。

图11 不同果肉颜色桃品种总酚含量Fig.11 Total phenolic contents in peaches with different flesh colors
3 讨论
近年,从多酚类视角对功能性水果的开发与研究进行得如火如荼。桃作为国际市场上的重要水果之一,开发功能性桃品种无论对于鲜食桃,还是加工用桃均意义重大。总体而言,关于桃多酚的研究均还处于起步阶段,这些研究多集中在对部分桃品种总酚含量的描述[10,13]和抗氧化能力的初步测定[14-15];另外,利用高效液相色谱法(HPLC)对桃酚种类及其含量做了初步的探索[6-8,11],确定的桃多酚物质有儿茶素、表儿茶素、绿原酸、咖啡酸、芦丁以及部分糖苷类。从酚类视角开展功能性桃品种的选育也还刚刚开始[12]。
超声波辅助提取方法[16-17]和福林-酚比色法[18-19]操作简单,结果精确稳定,能很好地对水果总酚含量进行定量研究,在水果总酚含量测定中应用广泛。本试验利用上述方法对桃总酚提取和测定方法进行了研究,获得了桃总酚提取和测定的最佳方法:60.00%乙醇,料液比为1∶10,40℃超声提取60 min;测定波长为765 nm,0.5 mol/L福林-酚与没食子酸的体积比为 3∶1,0.5 mol/L福林-酚与0.5 mol/L Na2CO3体积比为1∶4,反应温度为25℃,反应时间为60 min。该方法简单、稳定性良好、精密度高。前人利用绿原酸作为标准物测定桃总酚均在725 nm 波长处[8,14],而本试验确定 765 nm 为桃总酚测定最佳波长,并且采用在水果总酚测定中普遍利用的没食子酸作为标准物,这便于进行桃与其他水果酚含量和功能性潜力的比较,从而对功能性桃品种的选育提供借鉴。利用优化的方法测定了14个不同果肉颜色的桃品种总酚含量,结果显示红肉桃品种总酚含量明显高于黄肉桃和白肉桃品种,与前人研究结果一致[14-15];这进一步说明红肉桃品种作为当前主要育种目标之一的重要性,以及开发多类型功能性桃品种的可能性。
[1]赵国玲,刘承初.植物性食材的酚类化合物及其对机体的抗氧化保护[J].生物技术通报,2009(增刊):40-45.
[2]刘春丽,杨跃寰.荔枝果肉贮藏过程中酶促褐变物质的变化规律[J].江苏农业科学,2011,39(3):355-356.
[3]贺 佳,李多伟,智彩辉,等.茶叶有效成分综合提取分离生产工艺[J].江苏农业科学,2012,40(9):247-250.
[4]肖凤艳,孙立彬.生地黄总多酚超声法提取工艺研究[J].江苏农业科学,2012,40(11):294-295.
[5]王忠和,初莉娅,宋世庆.水果中多酚类的生物学作用[J].中国园艺文摘,2011,27(5):37-38.
[6]綦菁华,王有年,于同泉,等.不同品种桃的酚类活性成分及其抗氧化功能研究[J].食品与发酵工业,2006,32(1):103-106.
[7]戴 军,华春雷,时政红,等.高效液相色谱法分析山楂汁和水蜜桃汁中酚类化合物[J].冷饮与速冻食品工业,1996(1):24-25.
[8]SCORDINO M,SABATINO L,MURATORE A,et al.Phenolic characterization of Sicilian yellow flesh peach(Prunus persica L.)cultivars at different ripening stages[J].Journal of Food Quality,2012(35):255-262.
[9]TAVARINI S,GIL M I,TOMAS-BARBERAN F A ,et al.Effects of water stress and rootstocks on fruit phenolic composition and physical/chemical quality in Suncrest peach[J].Annals of Applied Biology,2011(2):226-233.
[10]CELIA M C,MARA A M,YOLANDA G.Evaluation of the antioxidant capacity,phenolic compounds,and vitamin C content of different peach and nectarine [Prunus persica(L.)Batsch]breeding progenies[J].Journal of Agricultural and Food Chemistry,2009(11):4586-4592.
[11]ANDREOTTI C,RAVAGLIA D,RAGAINI A,et al.Phenolic compounds in peach(Prunus persica)cultivars at harvest and during fruit maturation[J].Annals of Applied Biology,2008(1):11-23.
[12]CEVALLOS-CASALS B A,BYRNE D,OKIE W R,et al.Selecting new peach and plum genotypes rich in phenolic compounds and enhanced functional properties[J].Food Chemistry,2006(96):273-280.
[13]GIL M I,TOMAS-BARBERAN F A,HESS-PIERCE B,et al.Antioxidant capacities,phenolic compounds,carotenoids,and vitamin C contents of nectarine,peach,and plum cultivars from California[J].Journal of Agricultural and Food Chemistry,2002(50):4976-4982.
[14]BYRNE D,VIZZOTTO M,CISNEROS Z L,et al.Antioxidant content of peach and plum genotypes[J].Hortscience,2004,39(4):798.
[15]沈志军,马瑞娟,俞明亮,等.桃三种肉色类型果实抗氧化因子的比较评价[J].中国农业科学,2012,45(11):2232-2241.
[16]王 雅,马重华,郭 涛,等.杏子果肉多酚超声波辅助提取工艺优化及抗氧化活[J].食品与发酵工业,2011,37(12):193-203.
[17]房玉林,齐 迪,郭志君,等.超声波辅助法提取石榴皮中总多酚工艺[J].食品科学,2012,33(6):115-118.
[18]李巨秀,王柏玉.福林-酚比色法测定桑椹中总酚[J].食品科学,2009,30(18):292-295.
[19]卜彦花,周娜娜,王春悦,等.福林酚试剂法和紫外分光光度法测定冬枣多酚含量的比较研究[J].中国农学通报,2012,28(1):212-217.
