Cry1Ac毒蛋白质对亚洲玉米螟幼虫几种酶活性的影响
2013-08-02黄东林祁静霞吴海燕杨丽芬施敏娟杨益众
周 琼, 黄东林, 祁静霞, 吴海燕, 杨丽芬,2, 施敏娟,3, 杨益众
(1.扬州大学园艺与植物保护学院,江苏 扬州 225009;2.江苏扬农化工集团有限公司,江苏 扬州 225009;3.南通大学医学院,江苏 南通 226001)
亚洲玉米螟[Ostrinia furnacalis(Güenée)]是中国玉米生产上最重要的害虫,上世纪70年代以来对棉花的为害逐年加重[1-3],成为长江中下游和黄河流域玉米、棉花混作区为害棉花的重要钻蛀性害虫[4]。转基因棉花的大面积推广也成为控制亚洲玉米螟为害的重要手段[5]。但Bt作物的持续大面积种植,使多化性害虫连续暴露在Bt毒蛋白质的作用下,增加了选择压,耐受性的群体得到发展,以致在群体水平上产生害虫抗性[6]。研究结果表明,许多害虫对Bt均能产生抗性[7-8]。但抗性的机理仍在不断探讨过程中。
解毒酶和保护酶是昆虫体内的主要酶系,乙酰胆碱酯酶是神经突触部位清除乙酰胆碱、维护神经正常传导的重要酶类,其活性是衡量昆虫神经生理活性的主要指标[9]。而许多杀虫剂是以乙酰胆碱酯酶为靶标,因此该酶与昆虫的解毒作用有密切的关系。昆虫体内的解毒酶系主要有氧化酶、还原酶、水解酶3种代表性酶类和转移酶4类,而水解酶中的酯酶和转移酶类的谷胱甘肽转移酶对分解外源毒物,维持正常的生理代谢起到很重要的作用[10]。已有研究证实,昆虫体内的解毒酶活性受到Bt毒蛋白质的影响而发生变化,可能与虫体对毒蛋白质的代谢及抗性产生有关[11-12]。而超氧化物歧化酶(SOD)和过氧化氢酶(CAT)则是普遍存在于生物体内的2种重要的防御氧化损伤的保护酶。SOD的作用是把O2·-歧化成 H2O2,H2O2能与 O2·-形成毒性更强的氢氧自由基(HO·),但细胞内的CAT可以将H2O2转化成水,生物体内的几种保护酶处于一种动态平衡状态,使自由基维持在一个低水平,起到保护生物机体的作用[13]。因此,研究Bt毒蛋白质与亚洲玉米螟体内相关酶活的关系,不但可以了解Bt转基因棉对亚洲玉米螟的毒性作用,还可以探寻该害虫产生抗性的可能性,也为更好地利用转基因棉控制玉米螟提供理论基础。
1 材料与方法
1.1 材料
1.1.1 供试虫源 亚洲玉米螟来源于扬州大学实验农牧场玉米田。第一代室内试验用采集于玉米上的卵;第二、三代试验虫源分别来自田间捕捉的上代成虫,在室内常温条件下,放置于高10 cm直径7 cm的罐头瓶内饲喂,瓶内壁覆以蜡纸,顶部用窗网封住,并用牛皮筋扎紧,每天早中晚3次用蘸有10%蜜糖水的脱脂棉放在窗网上供成虫补充营养,产卵后用于试验。
1.1.2 Cry1Ac毒蛋白质及人工饲料的配制 20%Cry1Ac毒蛋白质粉剂由中国农业科学院植物保护研究所提供。分别称取20%Cry1Ac毒蛋白质粉剂0.005 350 g、0.013 375 g、0.021 400 g 和0.029 425 g,用50 mmol/L Na2CO3溶液溶解并用蒸馏水定容至100 ml,置4℃冰箱保存。人工饲料的配制参照周大荣等[14]的方法加以改进,待配好的饲料冷却至60℃左右,加入10 ml溶解好的Cry1Ac蛋白质,充分混匀,配制成 200 ng/g、500 ng/g、800 ng/g、1 100 ng/g及对照(不加Cry1Ac蛋白质)5种不同Cry1Ac含量的人工饲料,冷却后置4℃冰箱保存。
1.1.3 幼虫饲喂和样本收集 亚洲玉米螟初孵幼虫分别饲喂在装有不同Cry1Ac含量人工饲料的高10 cm直径7 cm的罐头瓶内。收集生长整齐的3龄幼虫13头及5龄幼虫3头放入离心管中,重复3次。以上供试幼虫均放在-80℃超低温冰箱中保存备用。
1.1.4 试验条件 试验于温度 29℃ ±1℃、相对湿度 85% ±5%、光周期16∶8(L∶D)的光照箱(RXZ智能型人工气候箱,宁波江南仪器厂生产)内进行。
1.1.5 主要供试药剂及试剂盒 碘化硫代乙酰胆碱(ACTHI)、5,5-二硫代双硝基苯甲酸(DTNB)、毒扁豆碱、α-乙酸萘酯、α-萘酚、固蓝B盐、十二烷基磺酸钠(SDS)、磷酸氢二钠、磷酸二氢钠、碳酸氢钠、丙酮、无水乙醇、GSH-ST试剂盒、SOD试剂盒、CAT试剂盒、Bradford蛋白质定量试剂盒。
1.2 乙酰胆碱酯酶及解毒酶测定方法与操作步骤
1.2.1 酶源的制备 将试虫样品导入匀浆器中,加入1 ml pH 7.0的0.1 mol/L磷酸缓冲液(含0.1%TritonX-100),冰浴匀浆。匀浆液在4℃下10 000 g离心15 min,取上清液作为酶源。每个处理重复3次,在酶标仪下(Power wave XS酶标仪,美国Bio-TeK公司产品)分析酶活性。
1.2.2 乙酰胆碱酯酶(AchE)活性测定 参照Ellman等[15]的方法并加以改进。于412 nm下测OD值,扫描20 min,1 min读1次数,计算AchE活性。
1.2.3 α-乙酸萘酯酶活性测定 参照 Van[16]的方法并加以改进。室温下放置10 min,于600 nm处比色,测OD值。以α-萘酚作标准曲线。
1.2.4 羧酸酯酶(CarE)活性测定 参照Van[16]的方法并加以改进。室温下放置10 min,于600 nm处比色,测OD值。
1.2.5 谷胱甘肽-S-转移酶(GST)活性测定 按GST测定试剂盒的说明书进行检测。
1.3 保护酶测定方法与操作步骤
1.3.1 酶源的制备 将试虫样品导入匀浆器中,以生理盐水作介质,加入1 ml 67.25%的生理盐水,冰浴匀浆,匀浆液在4℃下10 000 g离心15 min。取上清液作为酶源。每个处理重复3次,在酶标仪下分析酶活性。
1.3.2 超氧化物歧化酶(SOD)活性测定 按总超氧化物歧化酶(T-SOD)测试盒说明书进行检测。
1.3.3 过氧化氢酶(CAT)活性测定 按过氧化氢酶(CAT)测试盒说明书进行检测。
1.4 可溶性蛋白质含量的测定
采用考马斯亮蓝G-250法测定,以牛血清蛋白质(BSA)为标准蛋白质。操作步骤按Bradford蛋白质定量试剂盒说明书进行。
1.5 数据分析
应用DPS软件中单因素试验统计的Tukey氏固定极差测验法对试验数据进行多重比较分析。
2 结果与分析
2.1 Cry1Ac毒蛋白质对亚洲玉米螟幼虫体内乙酰胆碱酯酶活性的影响
表1表明,不同含量Cry1Ac人工饲料对亚洲玉米螟幼虫乙酰胆碱酯酶活性有显著影响(3龄幼虫:df=4,F=16.05,P<0.05;5 龄幼虫:df=4,F=4.19,P<0.05)。乙酰胆碱酯酶的活性除200 ng/g毒蛋白质的处理外均高于对照,且随着毒蛋白质含量的升高而上升。1 100 ng/g处理的3龄幼虫该酶的活性分别比800 ng/g、500 ng/g、200 ng/g的处理及对照显著升高了 11.19%、17.03%、23.28%、19.85%,800 ng/g处理的酶活性比200 ng/g的处理显著升高了10.88%。1 100 ng/g处理的5龄幼虫酶活性比200 ng/g的处理显著升高19.24%。
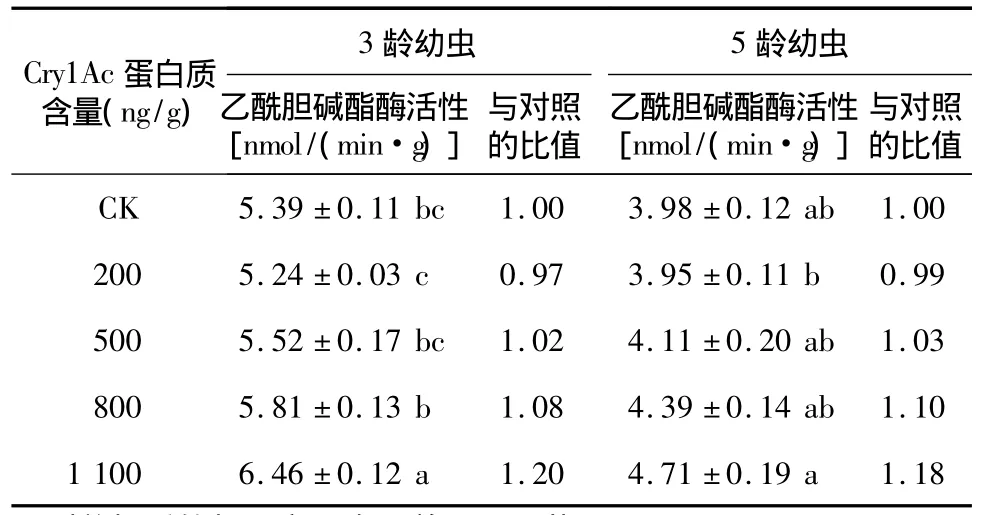
表1 取食不同含量Cry1Ac人工饲料的亚洲玉米螟幼虫体内乙酰胆碱酯酶活性变化Table 1 Changes in the activitiy ofacetylcholinesterase in Ostrinia furnacalis larvae feeding on artificial diets with different contents of Cry1Ac
2.2 Cry1Ac蛋白质对亚洲玉米螟幼虫体内解毒酶活性的影响
如图1所示,亚洲玉米螟取食不同含量Cry1Ac毒蛋白质的人工饲料后,对α-乙酸萘酯酶活性影响显著(3龄幼虫:df=4,F=107.58,P<0.05;5龄幼虫:df=4,F=26.61,P <0.05)。200 ng/g Cry1Ac毒蛋白质处理时,3龄幼虫体内的α-乙酸萘酯酶活性与对照相比有所上升,随着毒蛋白质含量的升高,α-乙酸萘酯酶活性逐渐被抑制;500 ng/g处理时α-乙酸萘酯酶活性比200 ng/g处理时显著降低了11.57%;到800 ng/g处理时,则α-乙酸萘酯酶活性比对照和200 ng/g处理时分别显著降低了14.90%和18.81%;1 100 ng/g处理时,α-乙酸萘酯酶活性比对照和 200 ng/g、500 ng/g、800 ng/g处理时分别显著降低了48.59%、50.95%、44.53%、39.59%。5龄幼虫体内α-乙酸萘酯酶活性也有类似的变化趋势,但只有在1 100 ng/g处理时,α-乙酸萘酯酶活性比对照、200 ng/g、500 ng/g、800 ng/g 处理分别显著降低了39.15%、43.74%、34.04%、38.54%。

图1 取食不同含量Cry1Ac人工饲料后亚洲玉米螟体内α-乙酸萘酯酶活性变化Fig.1 Changes of the activity of α-naphthylacetate esterase in-Ostrinia furnacalis larvea feeding on artificial diets with different contents of Cry1Ac
不同含量Cry1Ac毒蛋白质处理的亚洲玉米螟幼虫体内羧酸酯酶活性与对照相比均被抑制(3龄幼虫:df=4,F=5.93,P <0.05;5龄幼虫:df=4,F=6.34,P < 0.05)。500 ng/g、800 ng/g和1 100 ng/g毒蛋白质处理时,3龄幼虫该酶活性分别比对照显著降低了23.53%、24.56%和25.44%;1 100 ng/g处理时,5龄幼虫羧酸酯酶活性分别比对照和200 ng/g处理显著减少了30.00%和25.32%(图2)。
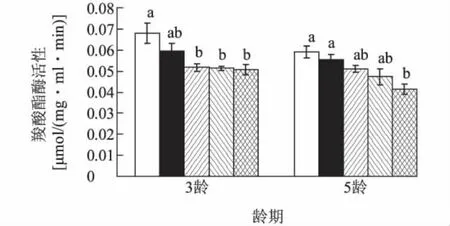
图2 取食不同含量Cry1Ac人工饲料后亚洲玉米螟体内羧酸酯酶活性变化Fig.2 Changes of the activity of carboxylesterase in Ostrinia furnacalis larvae feeding on artificial diets with different contents of Cry1Ac
亚洲玉米螟不同龄期的幼虫在取食不同含量Cry1Ac人工饲料后,谷胱甘肽-S-转移酶的活性受到显著影响(3龄幼虫:df=4,F=5.77,P<0.05;5龄幼虫:df=4,F=3.61,P<0.05)。3龄幼虫体内谷胱甘肽-S-转移酶的活性除200 ng/g Cry1Ac处理外均低于对照,500 ng/g、800 ng/g和1 100 ng/g Cry1Ac 处理分别比对照降低了22.62%、23.18%、24.50%,分别比200 ng/g Cry1Ac处理显著降低了29.57%、30.08%、31.28%。1 100 ng/g Cry1Ac处理的5龄幼虫体内该酶活性比对照显著降低了20.04%(图3)。
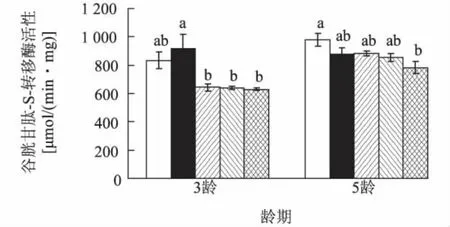
图3 取食不同含量Cry1Ac人工饲料后亚洲玉米螟幼虫体内谷胱甘肽-S-转移酶活性变化Fig.3 Changes of the activity of glutathione-S-transferase in-Ostrinia furnacalis larvea feeding on artificial diets with various contents of Cry1Ac
2.3 Cry1Ac毒蛋白质对亚洲玉米螟幼虫体内保护酶活性的影响
从表2可以看出,Cry1Ac毒蛋白质处理的亚洲玉米螟3龄幼虫体内超氧化物歧化酶活性受到显著影响(df=4,F=6.27,P <0.05),500 ng/g和 800 ng/g Cry1Ac处理时分别比对照显著升高了43.78%和42.26%;5龄幼虫也有相同的变化趋势,但差异不显著(df=4,F=1.81,P >0.05)。

表2 取食不同含量Cry1Ac人工饲料后亚洲玉米螟幼虫体内保护酶活性变化Table 2 Changes in the activities of two protective enzymes in Ostrinia furnacalis larvae feeding on artificial diets with different contents of Cry1Ac
与超氧化物歧化酶活性变化相反,随着Cry1Ac毒蛋白质含量的增加过氧化氢酶活性逐渐下降(3龄幼虫:df=4,F=14.82,P<0.05;5龄幼虫:df=4,F=9.01,P <0.05)。其中 500 ng/g、800 ng/g和1 100 ng/g Cry1Ac处理的3龄幼虫该酶活性分别比对照显著降低19.93%、33.39%、32.61%;1 100 ng/g Cry1Ac处理的5龄幼虫该酶活性分别比对照及200 ng/g Cry1Ac处理的显著降低45.56%和45.12%。
3 讨论
昆虫可以通过改变自身解毒酶或靶标酶的特性等多种途径以适应寄主植物体内的次生代谢产物[17],解毒酶的变化反过来再改变其对杀虫剂的敏感性。转基因作物所表达的杀虫毒蛋白质作为一种导入性外源毒素,同植物代谢的次生物质和化学杀虫剂一样,也可以引起昆虫体内的相关解毒酶系和保护酶系等的活性变化,一方面对昆虫的持续作用可能会破坏其生理生态平衡,导致内部稳态发生紊乱,从而杀死害虫;另一方面也可能诱导虫体产生一定的防御机制,进而影响转基因植物的杀虫效果,甚至导致害虫的抗性发展等。大量的研究已证明了类似的推断[12,18-19]。
一些研究发现,昆虫体内的各种酶活性与毒蛋白质关系不显著。丁双阳等的研究结果表明在饲喂转Bt基因杨树叶片后,美国白蛾幼虫中肠乙酰胆碱酯酶活性与对照相比差异不显著[20]。杨进研究发现转双价基因棉SGK321对斜纹夜蛾3龄幼虫体内的α-乙酸萘酯酶和谷胱甘肽-S-转移酶的活性与对照间差异均不明显[21]。刘旭的研究结果表明在取食转SCK/Cry1Ac毒蛋白质基因稻谷后,米蛾幼虫体内的谷胱甘肽-S-转移酶的活性与对照性相比无显著差异[22]。本研究发现,在取食含有Cry1Ac毒蛋白质粉剂的人工饲料后,亚洲玉米螟3龄幼虫体内的α-乙酸萘酯酶、羧酸酯酶以及谷胱甘肽-S-转移酶的活性受到一定的抑制,且随着毒蛋白质含量的升高,与对照相比表现出显著的抑制作用,而在200 ng/g毒蛋白质下,α-乙酸萘酯酶和谷胱甘肽-S-转移酶的活性均较对照有所升高。徐艳聆等也发现取食转Bt基因玉米48 h后亚洲玉米螟幼虫体内的α-乙酸萘酯酶、谷胱甘肽S-转移酶活性明显低于对照,而乙酰胆碱酯酶活性显著高于对照,推断乙酰胆碱酯酶可能与玉米螟对Bt毒蛋白质的抗性有关[12]。因此Bt毒蛋白质与昆虫体内酶活的关系还有待进一步论证。
本研究发现,随着毒蛋白质含量的升高,亚洲玉米螟幼虫SOD活性呈现先升高后降低的趋势,在1 100 ng/g毒蛋白质含量下SOD活性低于对照,而在其他毒蛋白质含量处理下均高于对照,而CAT活性呈现相反的趋势,呈抑制作用。解娜等的研究结果表明在取食Cry1Ac毒蛋白质后,粘虫体内的SOD活性显著升高,而CAT活性受到显著抑制[23],与本研究结果一致。在本试验中,同一处理下,5龄幼虫的保护酶活力要高于3龄幼虫,而张巍等的研究结果表明在取食转Cry1Ab/Cry1Ac基因水稻后,短时间内(48 h)随着取食时间的延长,Bt处理组的3龄幼虫SOD活性先降低后上升,CAT活性在处理后期受到明显抑制[24],与本试验的结果有所不同,这可能是长时间取食过程中的一个阶段性变化。
转Bt基因抗虫作物中Bt蛋白质的表达及转Bt基因植物里植物次生代谢物的含量均受到多种因素的影响[25-26]。本试验没有采用饲喂新鲜的转基因植物组织来测定昆虫体内的酶系活性,而是直接将Bt-Cry1Ac毒蛋白质粉剂溶解后加入到人工饲料中进行室内试验。二者所引起的昆虫相关响应机制的形式与过程是否完全相同不甚清楚,有可能是各研究的结果不尽相同的原因。
综上所述,亚洲玉米螟取食不同亚致死含量的Cry1Ac人工饲料后,体内的相关酶活性都发生了不同程度的变化。在较低Cry1Ac含量时,虫体产生应激反应,部分解毒酶和保护酶活性被激活,对虫体进行防御;随着含量的增加,酶活性逐渐被抑制,显著低于对照。而乙酰胆碱酯酶活性呈现升高的趋势,这可能与昆虫的抗性有关。毒蛋白质通过干扰SOD和CAT的活性,使虫体自由基清除的动态平衡遭到破坏,扰乱正常的生理代谢,从而达到毒杀害虫的作用。
[1]王振营,鲁 新,何康来,等.我国研究亚洲玉米螟历史、现状与展望[J].沈阳农业大学学报,2000,31(5):402-412.
[2]李 彪,叶 敏,熊 智,等.苦葛不同溶剂提取物对玉米螟和菜粉蝶幼虫的生物活性[J].江苏农业科学,2012,40(4):123-126.
[3]张柱亭,钱海涛,董 辉,等.沈阳几个主栽玉米品种的二代玉米螟抗性初探[J].江苏农业科学,2011(1):170-171.
[4]黄东林,史晓利,邹 敏,等.转基因抗虫棉对亚洲玉米螟抗性的时空动态研究[J].扬州大学学报:农业与生命科学版,2007,28(2):69-72.
[5]黄东林,王 凤,邹 敏,等.GK22、苏抗103及其受体亲本对亚洲玉米螟的抗性比较[J].植物保护学报,2005,32(1):7-12.
[6]林良斌,官春云.Bt毒蛋白基因与植物抗虫基因工程[J].生物工程进展,1997,17(2):51-55.
[7]MCGAUGHEY W H.Insect resistance to the biological insecticide Bacillis thuringinesis[J].Science,1985,229(4709):193-195.
[8]TABASHNIK B E,VAN RENSBURG J B J,CARRIERE Y.Fieldevolved insect resistance to Bt crops:definition,theory,and data[J].Journal of Economic Entomology,2009,102(6):2011-2025.
[9]曲明静,许新军,韩召军,等.昆虫乙酰胆碱酯酶基因突变抗药性机制研究[J].昆虫知识,2007,44(2):191-194.
[10]陈长琨.昆虫生理生化实验[M].北京:农业出版社,1993:26-29,124-128.
[11]梁革梅,谭维嘉,郭予元.棉铃虫Bt抗感种群间数种解毒酶和中肠蛋白酶活性的比较[J].植物保护学报,2001,28(2):133-138.
[12]徐艳聆,王振营,何康来,等.转Bt基因抗虫玉米对亚洲玉米螟幼虫几种主要酶系活性的影响[J].昆虫学报,2006,49(4):562-567.
[13]李周直,沈惠娟,蒋巧根,等.几种昆虫体内保护酶系统活力的研究[J].昆虫学报,1994,37(4):399-403.
[14]周大荣,王玉英,刘宝兰,等.玉米螟人工大量繁殖研究:Ⅰ.一种半人工饲料及其改进[J].植物保护学报,1980,7(2):113-121.
[15]ELLMAN G L,DIANE COURTNEY K,ANDRES V,et al.A new and rapid colormetric determination of acetylcholinesterase activity[J].Biochemical Pharmacology,1961,7:88-95.
[16]VAN ASPEREN K.A study of housefly esterase by means of a sensitive colormetric method [J].Journal of Insect Physiology,1962,8(4):401-414.
[17]李 飞,韩召军,吴智锋.取食不同寄主棉蚜的羧酸酯酶和乙酰胆碱酯酶特性比较[J].南京农业大学学报,2002,25(2):57-60.
[18]姜 涛,姜德锋,褚 栋,等.转Cry1Ac+CpTI双价基因棉对烟粉虱主要解毒酶活性的影响[J].山东农业科学,2008(9):69-72.
[19]张志罡,孙继英,李 勇.Cry1Ab蛋白对稻纵卷叶螟幼虫体内三种保护酶活性的影响[J].生物技术通报,2011(1):148-152.
[20]丁双阳,李怀业,李学锋.转Bt基因杨树对美国白蛾幼虫中肠解毒酶及乙酰胆碱酯酶的影响[J].东北林业大学学报,2001,29(3):28-30.
[21]杨 进.斜纹夜蛾在不同棉花品种上的种群动态及其与体内解毒酶活性的关系研究[D].扬州:扬州大学,2008.
[22]刘 旭.转SCK/Cry1Ac基因稻谷对米蛾生长发育及解毒功能的影响[D].重庆:西南大学,2010.
[23]解 娜,江幸福,罗礼智,等.Cry1Ac杀虫蛋白对粘虫中肠几种酶活性的影响[J].昆虫学报,2012,55(2):168-175.
[24]张 巍,张志罡,付秀芹,等.转Bt基因水稻对稻纵卷叶螟幼虫体内三种保护酶活性的影响[J].昆虫学报,2008,51(10):1022-1027.
[25]SACHS E S,BENEDICT J H,STELLY D M,et al.Expression and segregation of genes encoding Cry1A insecticidal proteins in cotton[J].Crop Science,1998,38(1):1-11.
[26]CHEN D H,YE G Y,YANG C Q,et al.Effect after introducing Bacillus thuringiensis gene on nitrogen metabolism in cotton[J].Field Crops Research,2004,87(2-3):235-244.
