耐盐柳树BADH基因克隆及表达分析
2013-08-02王奎山李玉娟
李 敏, 张 健, 王奎山, 李玉娟, 谈 峰, 王 莹
(江苏沿江地区农业科学研究所,江苏 如皋 226541)
大多数高等植物在受到盐、干旱等胁迫时会在细胞内积累大量甘氨酸甜菜碱(简称甜菜碱)来提高自身抵抗逆境环境因子胁迫的能力[1]。甜菜碱作为季胺类水溶性生物碱,具有渗透调节功能,能够保护质膜的完整性,有助于植物适应非生物逆境[2-3]。
耐盐柳树,具有较强的耐盐能力,能在含盐0.4%、pH 10.4的土壤中正常生长,是中国沿海滩涂主要的造林树种之一。耐盐柳树适应性强,易繁殖,造林成活率高,生长迅速,无论在营造工业用材林,还是在防风固沙、水土保持、盐碱地改造等方面都有广阔的应用前景[4]。目前,国内外学者已从川芎(Liqusticum churning Franch Hort)、枸杞(Lycium barbarum)、刺五加(Eleutherococcus senticosus)、甘菊(Dendranthema lavandulifolium)、胡杨(Populus euphratica)、辽宁碱蓬 (Suaeda liaotungensis)、梭 梭(Haloxy lonammodendron)、盐爪爪(Kalidium foliatum)、大麦(Hordeum vulgare L.)、盐穗木 (Halostachys caspica)等[5-14]植物中相继克隆得到甜菜碱醛脱氢酶(BADH)基因,但有关耐盐柳树BADH基因的研究还未见报道。本研究拟从耐盐柳树中克隆BADH基因,探讨其与其他品种或物种同源基因的相似性,构建系统进化树,并对其进行序列分析和在盐胁迫下的表达分析,旨在为耐盐柳树种质改良研究奠定基础。
1 材料与方法
1.1 植物材料
供试植物为江苏沿江地区农业科学研究所选育的耐盐柳树L0911,取新鲜叶片,用液氮速冻存于-70℃冰箱待用。
1.2 试剂
引物 Taq DNA聚合酶、dNTP(10 mmol/L)、DNA marker和 PCR产物纯化回收试剂盒(生工SK1141)、质粒提取试剂盒(生工 SK1191 UNIQ-10)、荧光定量PCR用试剂盒(SK8661)、常规化学试剂等均购自上海生工生物工程有限公司,pMD18-T载体购自宝生物工程(大连)有限公司。
1.3 RNA提取和总cDNA的合成
采用Trizol试剂(Invitrogen公司)参照试剂说明手册提取总RNA。总cDNA的合成用AMV逆转录酶(BBI公司)按照反转录试剂盒说明书进行。
1.4 BADH 基因克隆
根据毛果杨(Populus trichocarpa)的PtBADH设计引物BADH F1:5'-AGCTCTCAACTCACTAATCGAGT-3';BADH R1:5'-TTATAGCTTGGCGGGAGACTG-3'。以L0911叶片总cNDA为模板,PCR产物经1%琼脂糖电泳后,切胶回收,并进行T/A克隆(pMD18-T)。阳性克隆送上海生工生物工程有限公司测序。所得的克隆序列为2次独立PCR和3个以上质粒的测序结果。
1.5 BADH基因的分子进化分析
在GenBank查找BADH基因的核苷酸和氨基酸相关序列,使用 Clustal W2进行多序列比对,MEGA5.0软件中 Neighbor-Joining(NJ)法进行建树,Bootstrap值设为1 000。
1.6 盐处理
将水培生长健壮的柳树L0911幼苗用200 mmol/L NaCl溶液分别处理0 h、3 h、6 h、9 h、12 h、24 h、48 h、72 h后,取新鲜嫩叶片。将 L0911幼苗分别用 0 mmol/L、100 mmol/L、200 mmol/L 、300 mmol/L NaCl溶液处理12 h后,取新鲜嫩叶片。所有样品用液氮速冻存于-70℃冰箱待用。
1.7 实时荧光定量PCR分析
根据测序结果,设计引物BADH F2(5'-GTGCCAAGTATTTGCGTGCTA-3')和BADH R2(5'-AAACAACCTGCGACATCATCC-3'),对L0911 BADH基因盐胁迫处理后的响应进行分析。用ubiquitin-like(UBQ-L)[15]为内参基因,引物为 UBQ-L-F(5'-TGAGGCTTAGGGGAGGAACT-3')和UBQ-L-R(5'-T GTAGTCGCGAGCTGTCTTG-3')。将经过盐处理的柳树L0911幼苗嫩叶进行总RNA提取以及cDNA合成。按柱式植物总RNA抽提纯化试剂盒(SK8661)配制PCR体系,于ABI Stepone plus型荧光定量PCR仪中进行定量PCR检测,测定其Ct值,用 F=2-△△Ct公式[16]计算样品间目的基因的表达量差异。
2 结果
2.1 柳树L0911 BADH基因的克隆
从图1可以看出,引物BADH F1和BADH R1在柳树L0911的cDNA模板中成功扩增到目的片段,长度大小符合预期目标。测序结果表明,L0911的BADH基因cDNA全长1 539 bp,具有起始密码子、完整的开放阅读框(1 512 bp)、终止密码子、5'非编码区(27 bp),共编码512个氨基酸。获得的氨基酸序列与毛果杨PtBADH2、胡杨PeBADH2编码序列以及拟南芥、水稻的氨基酸序列相似性达到95.83%、95.03%、82.31%、71.68%。说明本试验获得的基因与PtBADH2和PeBADH2是同源的。

图1 引物BADH-F1/R1扩增柳树L0911 cDNA的琼脂糖凝胶电泳检测结果Fig.1 Amplification of Salix cultivar L0911 cDNA by PCR using primers BADH-F1/R1
2.2 柳树L0911氨基酸序列分析和系统进化树构建
用MEGA 5.0对BADH基因编码的氨基酸序列进行分子进化分析,结果与用基因组序列(www.phytozome.net)分析结果一致。柳树 L0911的BADH基因与杨树位于相同的分支(图2)。在胡杨[9]、白骨壤[17]、麻疯树[18]等植物中,BADH 基因的功能已有报道,本研究获得的BADH可能具有相应的生物学功能。
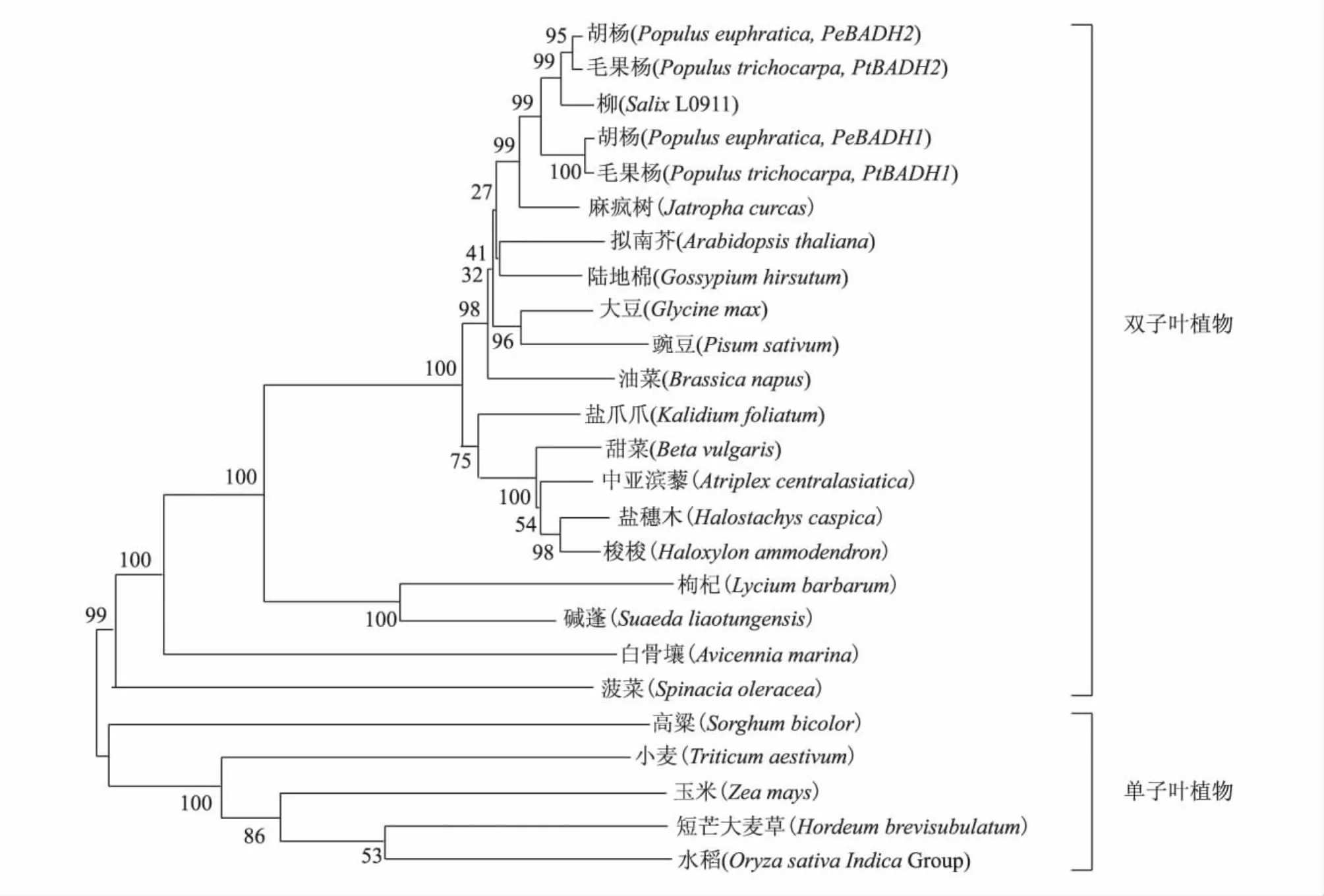
图2 植物BADH基因编码氨基酸的分子进化分析图Fig.2 Phylogentic tree of BADH gene of various plants based on amino acids sequence
2.3 盐胁迫下柳树L0911 BADH基因的表达分析
2.3.1 不同浓度 NaCl溶液胁迫下柳树L0911BADH基因的表达特性 以未进行NaCl胁迫处理的叶片中BADH基因的表达量为对照,对实时荧光定量中得到的目的基因BADH和内参基因UBQ-L的平均Ct值,计算作图,得到图3。可以看出柳树L0911叶片中BADH基因的表达情况随着盐浓度的升高呈先升高后降低的趋势,在200 mmol/L NaCl胁迫下表达量最高,是对照的1.90倍。说明一定浓度的 NaCl胁迫可以诱导柳树 L0911的BADH基因表达量增加,但盐浓度过高BADH基因表达量又会下降。

图3 不同NaCl浓度胁迫12 h后柳树L0911 BADH基因的表达Fig.3 Expression of BADH gene of Salix cultivar L0911 under NaCl stress for 12 h at different concentrations
2.3.2 NaCl不同胁迫时长下 L0911BADH基因的表达特性 从图4可以看出,随NaCl胁迫时间的延长,叶片中BADH基因表达量呈现先升高后降低的趋势。胁迫初期(3 h),L0911 BADH基因表达量低于对照;随着时间的延长,表达量逐渐增大,胁迫12 h时达到最高,是对照组的1.88倍,说明盐胁迫能诱导该基因表达量的增加;随着时间进一步延长,表达量逐渐降低,胁迫72 h时表达量低于对照水平。
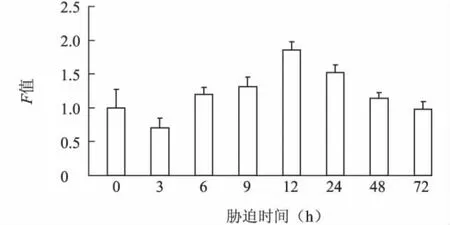
图4 200 mmol/LNaCl胁迫不同时间柳树L0911 BADH基因的表达Fig.4 Expression of BADH gene of Salix cultivar L0911 under 200 mmol/L NaCl stress for different times duration
3 讨论
植物在干旱、盐碱等逆境条件下可积累大量甜菜碱,而植物体内甜菜碱的合成途径相对简单,主要经两步催化合成,即乙酰胆碱→甘氨酸甜菜碱醛→甘氨酸[19]。甜菜碱合成后不能进一步代谢,积累在细胞中作为永久性或半永久性渗透调节剂[20]。因此,甜菜碱合成途径中的甜菜碱醛脱氢酶(BADH)被认为是最有希望的胁迫抗性基因之一,BADH的分子生物学与生物化学研究引起了广泛关注。本研究从柳树L0911克隆到BADH基因,并对该基因的结构、系统进化、表达模式进行了比较详细的研究。
本研究采用同源克隆法从柳树L0911cDNA中扩增并克隆了BADH基因。测序结果表明,该基因含有1个完整的开放阅读框架,核苷酸序列全长为1 539 bp,推测的氨基酸序列全长为512个氨基酸残基。氨基酸序列同源性分析表明L0911的BADH基因与毛果杨、胡杨等同源性最近,为95%,与水稻的同源性为71%。L0911的BADH氨基酸序列同源性分析也表明BADH在高等植物中是相对保守的。
植物在逆境条件下会积累甜菜碱,BADH基因的表达活性又直接影响甜菜碱的合成。本试验用荧光定量的方法检测柳树L0911在盐胁迫下BADH mRNA的表达情况。结果表明,BADH基因是受盐诱导的,当盐浓度升高至200 mmol/L时,表达活性最大;在同一盐浓度下,随着盐胁迫时间的延长,在一定范围内,表达活性也增大。Arakawa等[21]研究结果表明大麦(Hordeum vulgare)BADH酶活性随着盐浓度的增加而增大;Reda等[22]研究结果也表明盐角草(Salicornia europaea)和碱蓬(Suaeda maritima)的BADH mRNA在盐胁迫下的表达水平增加,本研究结果与他们基本一致。这为进一步揭示L0911的耐盐机制及利用该基因进行遗传工程创造耐盐新种质奠定了基础。
[1]CHEN T H H,MURATA N.Glycinebetaine:an effective protectant against abiotic stress in plants[J].Trends Plant Sci,2008,13(9):499-505.
[2]朱先灿,胡鸢雷,王晓丽,等.两种滨藜甜菜碱醛脱氢酶基因的克隆及序列分析[J].生物技术通报,2007(6):89-91.
[3]刘 萍,丁义峰,于 娜,等.维生素C与甘氨酸甜菜碱对芍药花瓣生理生化的影响[J].江苏农业科学,2011,39(6):267-269.
[4]解孝满,李景涛,刘建军,等.柳树无性系苗期试验分析[J].山东林业科技,2008(3):44-45.
[5]周嘉裕,廖 海.川芎甜菜碱醛脱氢酶基因的克隆及序列分析[J].西北农业学报,2011,20(3):45-51.
[6]田跃胜,许洁婷,唐克轩,等.枸杞甜菜碱醛脱氢酶基因全长cDNA的克隆与表达分析[J].扬州大学学报,2010,31(2):48-52.
[7]邢朝斌,吴 鹏,陈 龙,等.刺五加GAPDH基因的克隆及序列分析[J].中草药,2012,43(1):155-158.
[8]刘振林,曹华雯,夏新莉,等.甘菊BADH基因cDNA的克隆及在盐胁迫下的表达[J].武汉植物学研究,2009,27(1):1-7.
[9]刘佳琪,杨 雪,李 迪,等.胡杨甜菜碱醛脱氢酶基因的功能分化[J].生物工程学报,2012,28(3):329-339.
[10]李秋莉,张 毅,尹 辉,等.辽宁碱蓬甜菜碱醛脱氢酶基因(BADH)启动子分离及序列分析[J].生物工程学报,2006,22(1):77-81.
[11]石 磊,甘晓燕,陈虞超,等.梭梭甜菜碱醛脱氢酶基因克隆及序列分析[J].西北植物学报,2010,30(2):223-228.
[12]曾幼玲,幸 婷,蔡忠贞,等.盐生植物盐爪爪甜菜碱醛脱氢酶基因的克隆及在盐胁迫下的BADH基因的表达[J].云南植物研究,2007,29(1):79-84.
[13]ZHAO Y W,HAO J G,BU H Y,et al.Cloning of HvBADH gene from hulless barley and its transformation to tobacco[J].Acta Agronomica Sinica,2008,34(7):1153-1159.
[14]胡有贞,张富春,曾幼玲,等.盐穗木甜菜碱醛脱氢酶基因(BADH)的克隆及其在盐胁迫下的表达分析[J].植物生理学通讯,2010,46(1):47-50.
[15]关亚丽.柳树AP3同源基因的克隆与表达分析[D].南京:南京林业大学,2006.
[16]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ctmethod[J].Method,2001,25:402-408.
[17]周涵韬,李 芳,张赛群,等.红树植物白骨壤甜菜碱醛脱氢酶基因的克隆与功能研究[J].厦门大学学报,2008,47(增刊2):11-15.
[18]ZHANG F L,NIU B,WANG Y C,et al.A novel betaine aldehyde dehydrogenase gene from Jatropha curcas,encoding an enzyme implicated in adaptation to environmental stress[J].Plant Science,2008,174:510-518.
[19]TAKABE T,RAI V,HIBINO T.Metabolic engineeringof glycine betaine[M]//RAI A K,TAKABE T.Abiotic stress tolerance in plants.Berlin:Springer,2006:137-151.
[20]KUMAR S,DHINGRA A,DANIELL H.Plastid-expressed betaine aldehyde dehydrogenase gene in carrot cultured cells,roots,and leaves confers enhanced salt tolerance[J].Plant Physiol,2004,136(1):2843-2854.
[21]ARAKAWA K,KATAYAMA M.Levels of betaine and betaine aldehyde dehydrogenase activity in the green leaves,and etiolated leaves and roots of barley[J].Plant Cell Physiol,1990,31:797-803.
[22]MOGHAIEB R E A,SANEOKA S,FUJITA K.Effect of salinity on osmotic adjustment,glycinebet aine accumulation and the betaine aldehyde dehydrogenase gene expression in two halophytic plants,Salicornia europaea and Suaeda maritime[J].Plant Sci,2004,166:1345-1349.
