聚合物污染土壤的微生物固定化修复
2013-08-02刘江红徐瑞丹
刘江红,徐瑞丹,潘 洋,芦 艳
(1 东北石油大学化学化工学院石油与天然气化工省高校重点实验室,黑龙江 大庆 163318;2 厦门大学生命科学学院,福建 厦门 361005;3 同联集团沈阳抗生素厂,辽宁 沈阳 11012)
部分水解聚丙烯酰胺(partially hydrolyzed polyacrylamide,HPAM)以其良好的絮凝性被广泛用来提高原油的采收率[1],聚丙烯酰胺注入地下后,少部分随原油被采出,而大部分存在于油层中,随原油吸附在土壤及岩石表面,导致油井周围的土壤中含有大量的聚丙烯酰胺和原油,给环境带来危害[2]。微生物降解以其特有的无害化处理将成为解决聚丙烯酰胺引起环境污染潜在毒性的有效手段[3]。然而,游离微生物在处理含聚污水的过程中菌体易流失,且污水中的一些有害物质会对微生物产生毒害作用[4]。而微生物固定化技术可以减轻或消除菌体的流失,并且使微生物保持活性,可反复使用,固定化后微生物对有毒物质的承受能力及对有机物的降解能力都有明显的提 高[5]。因此微生物固定化技术成为生物及环境领域的研究热点[6]。目前,微生物固定化的制备方法可分为吸附法、共价法、包埋法和交联法4 种[7]。
作者采用微生物固定化方法处理聚丙烯酰胺污染和石油污染的土壤,从污染土壤中筛选出聚丙烯酰胺和原油高效降解菌,筛选出的菌株既可以以聚丙烯酰胺作为唯一氮源又可作为唯一作为碳源被利用,解决了之前研究中聚丙烯酰胺只能作为微生物繁殖的氮源不能作为碳源的缺陷。并且选择包埋固定化方法处理聚丙烯酰胺污染土壤。
1 实验材料
1.1 土壤样品
实验用土壤采自大庆油田采油四厂的一口聚丙烯酰胺与原油污染的井场,在离地表约5~20cm 处取样,将取得的样品装入已经灭菌的样品袋中,密封。过40 目筛,样品放置于冰箱中4℃保存。
1.2 培养基
(1)无机盐培养基(g/L):K2HPO4·3H2O 1.0,NH4NO31.0,KH2PO41.0,CaCl20.02,MgSO4·7H2O 0.5,FeCl3痕量。
(2)分离、纯化培养基(g/L):向上述(1)的培养基中加入HPAM 0.5,琼脂1.5%~2.0%,调节pH 值至7.2。
(3)活化培养基(g/L):HPAM 0.5,NaCl 0.5,蛋白胨6.0,尿素9.0,KH2PO40.5,MgSO40.5。
(4)基础培养基(g/L):向上述(1)的培养基中加入HPAM 0.5,调节pH=7.0。
(5)菌种保藏斜面培养基:牛肉膏蛋白胨培养基(细菌)和马丁氏培养基(真菌)。
2 实验方法
2.1 菌种筛选与鉴定
(1)菌种筛选 将10 g 聚丙烯酰胺污染的土壤样品加入到含聚丙烯酰胺100 mg/L,葡萄糖500 mg/L 的上述1.2 节(1)的无机盐培养基中,HZQX100 立式恒温振荡培养箱,120 r/min,35 ℃下培养,待培养液变浑浊,吸取5 mL 培养液,将移取的液体加到含聚丙烯酰胺300 mg/L,葡萄糖 300 mg/L 的培养基中放入恒温振荡培养箱继续培养,重复上述过程直到细菌在含聚丙烯酰胺 500 mg/L,葡萄糖浓度为0 mg/L 的培养基中能生长为止。制作上述1.2 节(2)的分离、纯化培养基,接种环挑取微生物培养液在培养基上划线,划线之后将培养基放入温度为35 ℃,转速为120 r/min 的振荡培养箱中培养,待长出菌落后,通过电镜观察菌株是否纯化。
(2)菌种鉴定 微生物菌株的形态观察与生理生化反应参照常见细菌系统鉴定手册[8]与伯杰氏细菌鉴定手册。将菌株初步鉴定到属。
2.2 测定方法
(1)聚丙烯酰胺降解率的测定:采用淀粉-碘化镉比色法测定聚丙烯酰胺的浓度。
(2)土壤原油含量的测定:分光光度法[9]。
2.3 菌体生物量的测定
采用722 型可见分光光度计测定溶液的OD660值(光密度)来表示生物生长量的多少,OD 值是物质在溶液中吸收特定波长光线强弱的参数。在波长为660 nm 处对含聚丙烯酰胺的微生物培养液进行光密度的测量,光密度值与菌群菌数成正比。将单菌以3%的体积比接入1.2 节(4)的基础培养基中,在35 ℃、120 r/min 条件下放入振荡培养箱中培养,以蒸馏水作为空白对照进行测定,以此作为微生物菌群生长曲线的参考指标。
2.4 单一菌种与混合菌降解聚丙烯酰胺和原油的效果比较
将活化后的单一菌种与4 种单菌R1,R2,R3,Y3 的混合菌按照3%的总体积分数分别加入上述1.2 节(4)的基础培养基中,于35 ℃、120 r/min条件下放入振荡培养箱中培养。3 天后测HPAM 与原油的去除率,比较单一菌种与混合菌种对HPAM和原油的降解效果。
2.5 微生物固定化颗粒的制备
(1)制备湿菌体 将筛选出四种单菌的混合菌作为固定化的菌体,将菌株依次接入200 mL 的1.2节(3)所示的活化培养基中,经过4 次连续活化。取活化后的培养液2 mL 加入到200 mL 的富集培养基中培养2~3 天,富集培养基经离心机离心,得到湿菌体。
(2)包埋法固定化颗粒的制备 4 种固定化方法中包埋固定化法以其操作简单,对微生物活性影响小,制作的固定化微生物小球的强度高等优点优于其它3 种固定化方法,所以本实验采用包埋法。以蒸馏水配置一定浓度的包埋载体溶液,加入一定量的湿菌体,用5 mL 注射器吸取载体溶液,将载体溶液滴入一定浓度的交联剂中,交联一定时间,将固定化颗粒放入200 mL 的1.2 节(4)所示的基础培养基中,35 ℃,120 r/min 振荡培养箱中培养降解聚丙烯酰胺。
(3)5 种包埋固定化制备方法 采用5 种包埋法进行微生物的固定化,5 种包埋固定化法制备微生物固定化颗粒的条件如表1 所示。
按照表1 中的制备条件制备固定化颗粒,比较5 种包埋法制备微生物固定化颗粒的难易程度、小球强度和韧性以及制备费用,从中选择一种制备费用低廉、制备容易、强度和韧性都较好的包埋方法。
2.6 微生物固定化颗粒降解HPAM 和原油的效果
以固定化颗粒对聚丙烯酰胺的降解率与对原油的去除率来比较几种包埋固定化方法。按照表1 中的5 种包埋固定化制备方法,制作固定化颗粒,各称取10 mL 载体与湿菌体的混合物制得的固定化颗粒,分别放入200 mL 的1.2 节(4)所示的基础培养基中,在35 ℃,120 r/min 振荡培养箱中培养3天,测聚丙烯酰胺的降解率。
2.7 微生物固定化处理采油污水污染土壤
取大庆油田采油四厂的一口井场取回的聚丙烯酰胺与原油污染土壤,先除去其中的砖块、瓦砾等杂物后自然风干,再将土样过40 目筛,得到颗粒大小均匀的土样,将土壤样品加入到1.2 节(1)所示的200 mL 基础培养基中,测得培养基中聚丙烯酰胺浓度为500 mg/L,原油浓度为733.21 mg/L。取10 mL PVA+海藻酸钠+添加剂法制得的载体与湿菌体的混合物制得的固定化颗粒放入上述培养基中,在35 ℃,120 r/min 振荡培养箱中培养,每3天测聚丙烯酰胺的降解率,并采用分光光度法测原油含量。
3 结果与讨论
3.1 菌种筛选结果
经分离纯化得到4 株对聚丙烯酰胺有降解效果的菌种,即R1、R2、R3、Y3。菌落图片和菌株电镜扫描图片如图1 所示。参照《伯杰氏细菌鉴定手册》及《常见细菌系统鉴定手册》,可以初步鉴定:R1 为芽孢乳杆菌属,R2 为微球菌属,R3、Y3 为假单胞菌属菌株。
3.2 标准曲线绘制
以HPAM 标准溶液浓度为横坐标,可见分光光度计测得的OD420值为纵坐标绘制的HPAM 浓 度-吸光度标准曲线。曲线的线性回归方程为y=0.0386x+0.0019,R2=0.9995。测定待测溶液吸光度值,即可从线性回归方程计算出待测溶液的实际HPAM 浓度。
3.3 单菌生物量的测定
以OD660值代表细菌的生物量,菌体生长量越多,培养基越浑浊,OD660值越大。因此,OD660值越大。表示菌体生物量越多。微生物生长曲线如图2 所示。
如图2 所示,微生物的生长曲线反映一种微生物在一定生活环境中的生长繁殖和死亡规律。由图2 的生长曲线可以看出,4 种菌体在含500 mg/L 聚丙烯酰胺的培养基中生长繁殖,菌体经历了停滞期、对数期、稳定期和衰亡期。

表1 5 种包埋法制备微生物固定化颗粒的条件

图1 菌落照片和菌株电镜扫描照片(×10K)
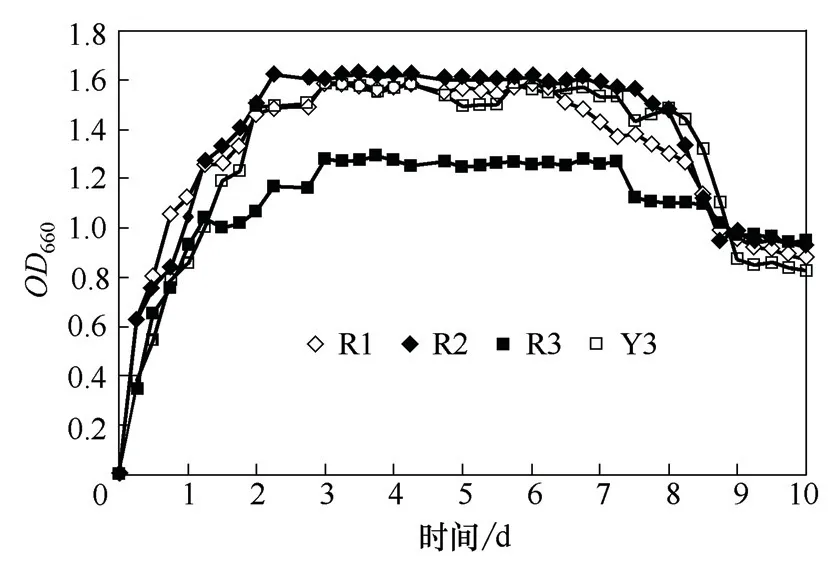
图2 单菌在含聚丙烯酰胺的培养基中生长曲线图
3.4 混合菌的优势
由图3、图4 可知,R1、R2、R3、Y3 四种单菌组成的混合菌对HPAM 和原油的去除率都明显高于4 种单菌,混合菌对HPAM 的降解率在第3 天基本保持稳定,达到55%以上,对原油的去除率可达到75%以上。这可能是由于单一菌种不具备一整套完整的酶系统或基因成分降解这些不易降解的有机物,而微生物群落中不同基因的拥有者却可能发生基因交换或重组,从而导致新的降解途径的实现。
3.5 微生物固定化
(1)5 种包埋方法比较 对5 种包埋法的制备难易程度、固定化后小球的强度和韧性及制作成本进行对比,结果如表2 所示,海藻酸钠包埋与戊二醛交联结合法与明胶-戊二醛法这两种方法制作费用高,且明胶-戊二醛法操作较困难,制成的固定化颗粒形状不规则,海藻酸钠包埋与戊二醛交联结合法制备的小球韧性、强度一般。因此排除海藻酸钠包埋与戊二醛交联结合法与明胶一戊二醛法这两种方法,选用其余3 种制备费用低廉的方法测定固定化微生物颗粒降解HPAM 和原油的 效果。
5 种包埋法制备固定化颗粒的难易程度、小球强度和韧性以及制备费用比较如表2 所示。
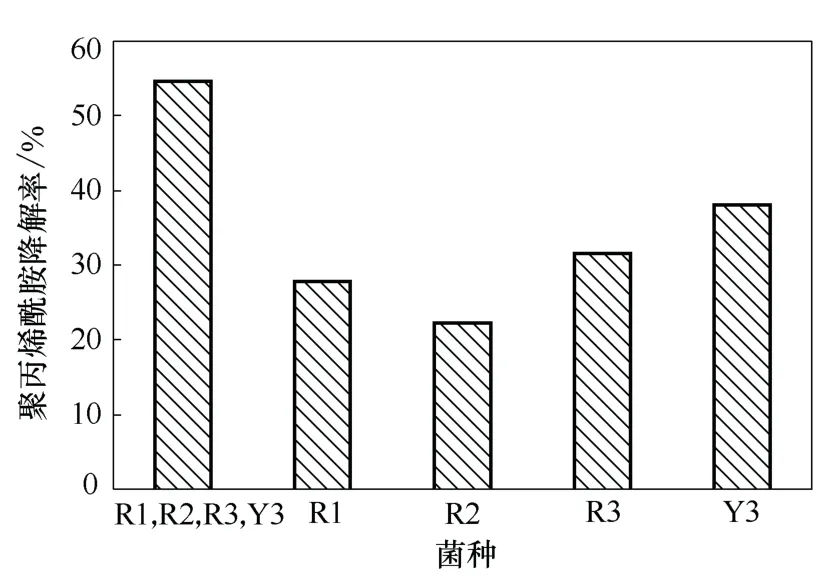
图3 混合菌与单菌对聚丙烯酰胺降解率的比较
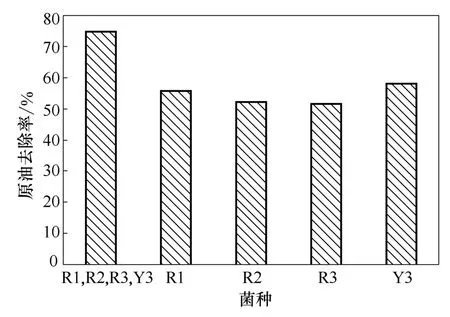
图4 混合菌与单菌对原油去除率的比较

表2 5 种包埋固定化方法的比较
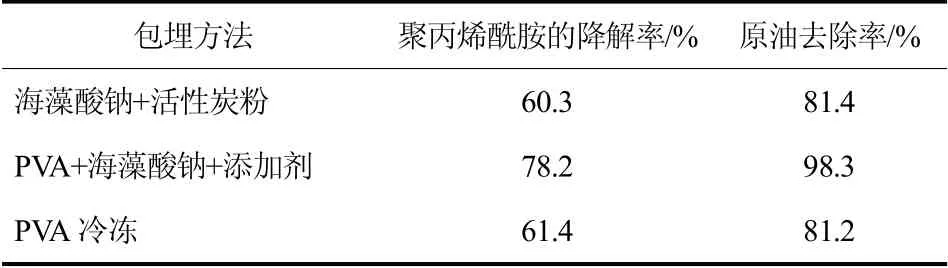
表3 固定化颗粒降解HPAM 和原油的效果
(2)微生物固定化颗粒降解HPAM 和原油的效果 通过由表2 筛选出的3 种包埋固定化方法制得的固定化颗粒对聚丙烯酰胺的降解率的测定,结果如表3 所示,海藻酸钠+活性炭粉法与PVA 冷冻法对聚丙烯酰胺降解率与对原油的去除率低于PVA+海藻酸钠+添加剂法。因此,排除海藻酸钠+活性炭粉法与PVA 冷冻法两种方法。
综合表2 与表3,得知PVA+海藻酸钠+添加剂法制得的固定化颗粒的活性较好,操作简单,强度好,不易破损,且费用低,PVA+海藻酸钠+添加剂法对聚丙烯酰胺的降解率高于其它两种包埋方法。因此选用PVA+海藻酸钠+添加剂法对含聚丙烯酰胺的土壤进行处理。张秀霞等[10]以天然有机材料YJ-05 为载体,采用吸附法制备固定化MM-7 对土壤中石油的降解率可达到27.1%。
由之前的实验3.4 节混合菌的优势可知,游离的混合菌对HPAM 降解率达到55%以上,对原油的去除率可达到75%以上,而由表3 得知在相同实验条件下PVA+海藻酸钠+添加剂法制得的固定化颗粒对聚丙烯酰胺的降解率可达到78.2%,对原油的去处率可达到98.3%。可见固定化后的菌株对聚丙烯酰胺与原油的处理能力要远远强于没有固定化的游离菌株。

图5 固定化颗粒
PVA+海藻酸钠+添加剂法制得的固定化颗粒如图5 所示。图5(a)为10%PVA-1%海藻酸钠与湿菌体按1 ∶2 体积比混合后,加入3%S i O2,0.3%CaCO3。用5 mL 注射器注射到2%的CaCl2饱和硼酸溶液中成球,CaCl2与饱和硼酸共同交联24 h后的固定化颗粒,颗粒并无拖尾现象。图5(b)为在相同制备方法时加入3%的活性炭制得的固定化颗粒,以增加固定化颗粒的通透性,提高微生物的活性。
3.6 微生物固定化处理采油污水污染土壤
PVA+海藻酸钠+添加剂法制得的微生物固定化颗粒处理采油污水污染的土壤,处理后的土壤样品放入电热鼓风干燥箱中干燥后送回井场,固定化颗粒降解土壤中HPAM 和原油的效果实验结果如表4所示。由表4 可以看出,PVA+海藻酸钠+添加剂法制备的固定化颗粒对采油污水污染土壤进行处理,固定化颗粒对HPAM、原油的去除率分别为79.5%和98.7%。
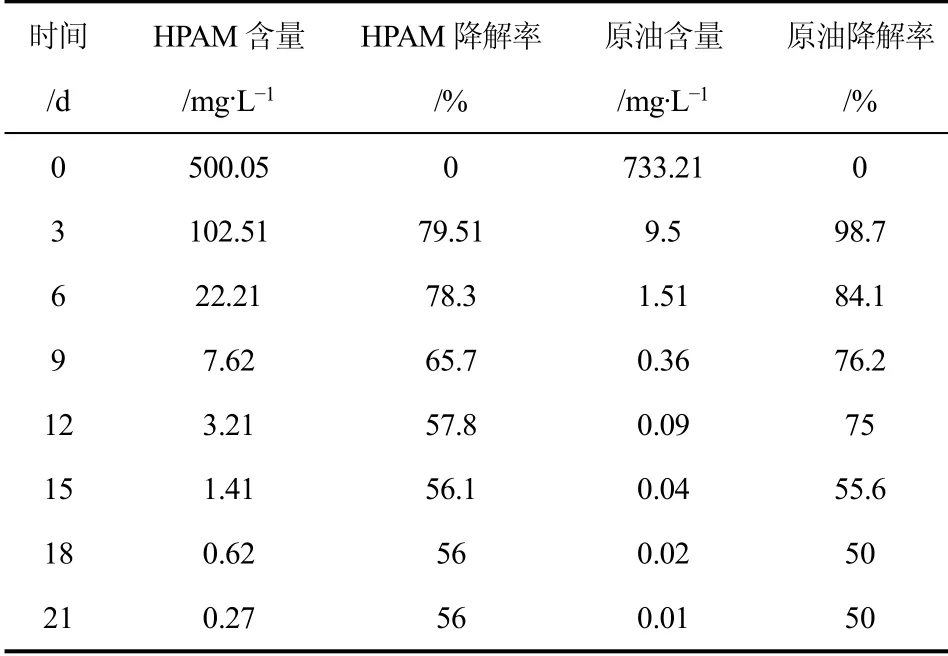
表4 固定化颗粒降解土壤中HPAM 和原油的效果
4 结 论
(1)实验以筛选出以聚丙烯酰胺作为唯一碳源和唯一氮源的菌株为目的,从含HPAM 的土壤中分离、纯化得到对HPAM 具有高效降解能力的R1、R2、R3、Y3 四种单菌。对筛选出的单菌进行鉴定可知:R1 为芽孢乳杆菌属,R2 为微球菌属,R3、Y3 为假单胞菌属菌株。
(2)将R1、R2、R3、Y3 混合,在35℃,120 r/min 条件下,混合菌对HPAM 的降解率可达到55%以上,对原油的去除率达到75%以上。明显高于4种单一菌种对HPAM 和原油的去除率。
(3)为提高混合菌对聚丙烯酰胺与原油的去除率,采用固定化法对混合菌进行固定化实验。比较5 种包埋固定化法得知,PVA+海藻酸钠+添加剂法对聚丙烯酰胺与原油的去除率高于其它4 种包埋固定化方法。PVA+海藻酸钠+添加剂法制得的固定化颗粒的活性较好,操作简单,强度好,不易破损,且费用低。
(4)游离的混合菌对HPAM 与原油的去除率可达到75%与55%以上,而PVA+海藻酸钠+添加剂法制得的固定化颗粒对聚丙烯酰胺与原油的去处率可达到78.2%与98.3%。可见固定化后的菌株对聚丙烯酰胺与原油的处理能力要远远强于没有固定化的游离菌株。
(5)PVA+海藻酸钠+添加剂法制备的固定化颗粒对采油污水污染土壤进行处理,聚丙烯酰胺的去除率可达到79.5%,原油的去除率可达到98.7%。
[1] 包木太,周营营,陈庆国. 部分水解聚丙烯酰胺溶液稳定性的影响因素[J]. 化工进展,2011,30(s1):230-234.
[2] Kurenkov V F ,Hartan H G ,Lobanov F I. Degradation of polyacrylamide and its derivatives in aqueous solutions[J]. Russian Journal of Applied Chemistry,2002,75(7):1057-1068.
[3] Yen Hsing-Yuan ,Yang Mu-Hoe. The ultrasonic degradation of polyacrylamide solution[J].Polymer Testing,2003,3(22):129-131.
[4] Stefan Grötzschel,Jürgen Köster,Raeid M M Abed,et al.Degradation of petroleum model compounds immobilized on clay by a hypersaline microbial mat[J].Biodegradation,2002,13(4):273-283.
[5] 张秀霞,秦丽姣,黄聪聪,等. 微生物固定化载体的选择及其性能[J]. 化工进展,2011,30(12):2781-2786.
[6] Nurdan K P,Merih S A T.Treating denim fabrics with immobilized commercial cellulases[J].Process Biochemistry,2005,40:767-771.
[7] Vanotti M B,Hunt P G. Nitrification treatment of swine wastewater with acclimated nitrifying sludge immobilized in polymer pellets[J].Tansactions of the Asae,2003,43(2):229-231.
[8] 东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:43-66.
[9] 奚旦立,孙裕生,刘秀英. 环境监测[M]. 修订版. 北京:高等教育出版社,1995:404-405.
[10] 张秀霞,刘永博,徐娜娜,等. 固定化MM-7 修复石油污染土壤影响因素重要性[J]. 化工进展,2012,31(2):448-452.
